Экзогенные аллергические альвеолиты: современные подходы к диагностике и терапии
- Аннотация
- Статья
- Ссылки
- English
Введение
Экзогенные аллергические альвеолиты (ЭАА) – группа заболеваний, характеризующихся аллергическим диффузным поражением альвеолярных и интерстициальных структур легких и возникающих в ответ на повторную ингаляцию антигенов пыли органического и неорганического происхождения и применение лекарственных средств.
В литературе встречаются другие названия данного заболевания: гиперчувствительный пневмонит, экзогенный аллергический бронхиолоальвеолит, интерстициальный гранулематозный пневмонит, экзогенный легочный гранулематоз, диффузная пневмопатия.
Первое упоминание об опасности вдыхания мучной пыли было сделано O. Magnus в 1555 г. В 1713 г. отчетливую связь между ингаляцией органической пыли и заболеваниями человека установил B. Ramazzini – основатель медицины профессиональных заболеваний. J.F. Campbell в 1932 г. описал клиническую картину заболевания у пяти фермеров, у которых после работы с влажным заплесневелым сеном появлялись симптомы острой респираторной инфекции. Первая форма заболевания получила название «легкое фермера». Позднее подобную клиническую картину наблюдали у трех больных, занимавшихся разведением голубей. Вторая по значению форма заболевания – «легкое любителей птиц» – в 1965 г. была описана C. Reed.
Термин «экзогенный аллергический альвеолит», предложенный J. Pepys в 1967 г., впоследствии был принят во всей Европе. Он несет в себе важную информацию: указание на проникновение антигенов из внешней среды, характеристику аллергического (иммунологического) патогенеза заболевания, преимущественную анатомическую локализацию патологического процесса [1].
Эпидемиология
Распространенность ЭАА зависит от профессии, бытовых условий, географических особенностей региона, экологической обстановки. Определить, у какого процента пациентов, контактирующих с «виновным» агентом, разовьется ЭАА, очень сложно. Тем не менее большинство экспертов полагают, что примерно от 5 до 15% лиц, подвергшихся экспозиции высокой концентрации этиологического агента, заболевают гиперчувствительным пневмонитом. Распространенность ЭАА среди людей, контактирующих с низкими концентрациями «виновного» агента, пока не определена.
ЭАА чаще болеют жители сельской местности. По данным разных авторов, «легкое фермера», «легкое птицевода», «легкое голубевода» и т.д. наблюдается соответственно у 4–8% лиц, занятых в сельском хозяйстве, у 5–7% работающих на птицефабриках, у 3% голубеводов, у 8% рабочих деревообрабатывающей промышленности, у 5% занятых в производстве солода [2]. В Финляндии и Швеции частота ЭАА, требующих госпитализации, составляет 4 случая на 10 000 фермеров. Во Франции и США фермеров с ЭАА, по данным опросов, 4%, по данным серологических исследований – 1% [3].
Большинство (80–95%) больных ЭАА не курят. Бытует мнение, что у курильщиков подавлен ответ иммунной системы на антигенное раздражение. Не исключено, что курение снижает ответ иммуноглобулинов при ингаляции антигена, влияет на продукцию цитокинов и ослабляет функцию макрофагов [4].
ЭАА чаще встречается у мужчин, чем у женщин (1,2:1), и впервые отмечается в возрасте 40–60 лет. Cчитается, что атопические заболевания не увеличивают риск возникновения ЭАА.
ЭАА развивается не у всех лиц, находящихся в одинаковых условиях. В связи с этим возникло предположение о роли генетических факторов. Описаны семейные случаи ЭАА. Отмечена частая встречаемость HLA-Bg (Human Leucocyte Antigens, человеческие лейкоцитарные антигены) у больных с «легким фермера» и «легким голубевода». А. Camarena и соавт. [5] в своей работе показали, что число гаплотипов HLA-DR и HLA-DQ в группе больных ЭАА «легкое фермера» сравнительно выше, чем среди работающих на фермах, но не отличается от общей популяции.
Скорее всего восприимчивость отдельных любителей птиц и голубеводов к заболеванию не имеет генетически детерминированного механизма, связанного с HLA.
В настоящее время рассматривается роль вирусов в возникновении и развитии ЭАА. Предположительно, развитию ЭАА способствует вирусная инфекция. В ряде случаев вирусные антигены обнаруживаются в жидкости бронхоальвеолярного лаважа (ЖБАЛ) и легочных биоптатах больных ЭАА. В экспериментальной работе G. Gudmundsson и соавт. [6] было показано, что респираторный синцитиальный вирус и вирус Сендай стимулировали развитие ЭАА. Развитие вирусной инфекции на фоне патологического процесса при ЭАА может реализовываться через способность вирусов изменять функциональную способность альвеолярных макрофагов, снижать активность фагоцитирующих клеток, стимулировать пролиферацию Т-лимфоцитов, то есть влиять на иммунные реакции организма [7].
В разных странах и регионах преобладают разные типы ЭАА. Так, в Великобритании среди форм ЭАА «легкое любителя волнистых попугайчиков» развивается у 2–5% владельцев домашних птиц. В США «легкое пользующихся кондиционерами и увлажнителями» составляет 15–70% всех вариантов ЭАА. В Японии на летний тип ЭАА, этиологически связанный с ростом гриба Trichosporon cutaneum, приходится 75% всех типов. В крупных промышленных центрах (в том числе в Москве) основными причинами заболевания являются птичьи и грибковые (Aspergillus spp.) аллергены [8].
На сегодняшний день число больных ЭАА составляет около 3% всех пациентов пульмонологического профиля [2].
Этиология
Активное изучение ЭАА началось в 1960-х гг. Тогда было выделено более 20 видов ЭАА в зависимости от этиологических факторов. Позднее этиологические факторы были детализированы, а перечень ЭАА расширен до 51 варианта [9]. На данный момент известно свыше 300 этиологических факторов, способных вызывать ЭАА. И это не окончательная цифра. Видимо, увеличение количества этиологических форм ЭАА зависит от изменений окружающей среды и диагностических возможностей медицинских центров [1].
Этиологические варианты ЭАА приведены в табл. 1 [2].
Факторы, играющие этиологическую роль в возникновении ЭАА, условно можно разделить на пять групп.
Бактериальные (термофильные актиномицеты, Bacillus subtilis, Micropolispora faeni и др.).
Грибковые (Aspergillus fumigatus, Alternaria, Penicillium, Cryptostroma corticale, различные плесневые грибы).
Белковые антигены животного происхождения (сывороточные белки и экскременты кур, голубей, попугаев и других птиц, крупного рогатого скота, свиней, антигены долгоносика амбарного обыкновенного (Sitophilus granaries), клещей (Dermatophagoides pteronyssinus, Euroglyphus maynei), пыль рыбной и пшеничной муки, пыль, содержащая частицы шерсти животных, экстракт задней доли гипофиза крупного рогатого скота (лекарственный препарат Адиурекрин)).
Антигены растительного происхождения (опилки дуба, кедра, коры клена, красного дерева, заплесневелая солома, экстракты кофейных зерен; пыль, содержащая частицы хлопка, льна, конопли и др.).
Медикаментозные антигены (противомикробные, противовоспалительные, противопаразитарные препараты, ферменты – трипсин, химотрипсин, стрептаза, R-контрастные вещества, лекарственные вещества белкового происхождения).
Контакт с ингаляционными аллергенами носит преимущественно профессиональный характер. ЭАА способен развиться у тех, кто работает в следующих отраслях:
сельское хозяйство: птицеводческие хозяйства, животноводческие комплексы, зерновые хозяйства, заготовка кормов, парниковые хозяйства и др.;
пищевая промышленность: производство пива, молочных продуктов, дрожжей, сыров и др.;
текстильная и швейная промышленность: обработка меха, хлопка, конопли, льна;
химическая и фармацевтическая промышленность: производство моющих средств, пластмасс, красителей, лекарственных препаратов, витаминов;
деревообрабатывающая промышленность: обработка древесины, производство бумаги (контакт с применяемыми для обработки древесины пентахлорфенолами) и др. [10].
Самые важные из этих агентов – термофильные актиномицеты и антигены птиц. В сельскохозяйственных районах ведущими причинными агентами являются термофильные актиномицеты – бактерии размером менее 1 мкм, обладающие морфологическими свойствами грибов. Они встречаются в почве, компосте, воде, кондиционерах. Наиболее распространены виды термофильных актиномицетов, ассоциированные с ЭАА: Мicropolyspora faeni, Thermoactinomyces vulgaris, Thermoactinomyces viridis, Thermoactinomyces saccharis, Thermoactinomyces candidum. Эти микроорганизмы размножаются при температуре 50–60 °С, то есть в тех условиях, которые достигаются в отопительных системах или при гниении органического материала. Термофильные актиномицеты ответственны за развитие «легкого фермера», багассоза (заболевание легких у работающих с сахарным тростником), «легкого лиц, выращивающих грибы», «легкого лиц, пользующихся кондиционерами» и др.
Птичьи антигены представлены в основном сывороточными белками – гамма-глобулином, альбумином. Эти белки содержатся в экскрементах, секретах кожных желез голубей, попугаев, индеек, канареек и других птиц. Люди, ухаживающие за этими птицами, заболевают при постоянном контакте с ними. Протеины свиней и коров также могут вызывать ЭЭА. Примером является заболевание, развивающееся у больных несахарным диабетом, нюхающих порошок гипофиза, – «легкое лиц, нюхающих Адиурекрин».
Среди грибковых антигенов при ЭАА наибольшее значение имеет Aspergillus spp. Различные виды Aspergillus связаны с развитием таких заболеваний, как «легкое варщиков солода», «легкое сыроваров», сабероз (развивается у тех, кто работает с корой пробкового дерева), а также «легкое фермера», «легкое лиц, пользующихся кондиционерами». Aspergillus fumigatus может стать причиной развития ЭАА у городских жителей, поскольку встречается в сырых непроветриваемых теплых помещениях.
Примером ЭАА, связанных с реактогенными химическими соединениями, является заболевание у лиц, занятых в производстве пластмасс, полиуретана, смол, красителей. Наибольшее значение имеют диизоцианаты, фталиковый ангидрид.
В последние годы чаще стали встречаться медикаментозные аллергические альвеолиты. Выраженными аллергенными свойствами обладают прежде всего гормональные препараты белкового происхождения (в частности, инсулин, Адиурекрин), ферменты (трипсин, химотрипсин, стрептаза, дезоксирибонуклеаза, урокиназа). Однако часто медикаментозные аллергические альвеолиты развиваются вследствие необоснованного применения пенициллина и других антибактериальных препаратов. Развитию медикаментозных аллергических альвеолитов способствует получившая широкое распространение полипрагмазия. Она усугубляется в результате самолечения больных, которые при любом недомогании применяют антибиотики, сульфаниламиды и другие препараты [2].
Патогенез
Необходимым условием развития ЭАА является ингаляция антигенного материала с частицами определенного размера в достаточной дозе в течение определенного периода. Чтобы произошла депозиция антигена в мелких дыхательных путях и альвеолах, частицы антигена должны иметь размер менее 5 мкм. Однако заболевание может развиться и при абсорбции растворимых антигенов с частицами больших размеров, осевших в проксимальных отделах бронхиального дерева. Большинство людей, подвергшихся экспозиции антигенного материала, не заболевают ЭАА. Важная роль в развитии гиперчувствительного пневмонита принадлежит другим факторам, прежде всего индивидуальной иммунологической реактивности, интенсивности мукоцилиарного транспорта, активности фагоцитоза, осуществляемой макрофагами, сопутствующим воспалительным процессом в легких.
ЭАА справедливо считают иммунопатологическим заболеванием, в развитии которого ведущая роль принадлежит аллергическим реакциям 3-го и 4-го типов (по классификации аллергических и аутоиммунных реакций Гелла Кумбса (Gell Coombs)). Имеет значение и неиммунное воспаление.
Иммунокомплексные реакции (3-й тип) играют важную роль на ранних этапах развития ЭАА. Образование иммунных комплексов (ИК) происходит в интерстиции при взаимодействии ингалируемого антигена и иммуноглобулина (Ig) класса G. Локальная депозиция ИК вызывает острое повреждение интерстиция и альвеол, характеризующееся нейтрофильным альвеолитом и повышением сосудистой проницаемости. Образование ИК приводит к активации системы комплемента и альвеолярных макрофагов. Активные компоненты комплемента повышают проницаемость сосудов и оказывают хемотаксическое действие на нейтрофилы и макрофаги. Активированные нейтрофилы и макрофаги вырабатывают и высвобождают провоспалительные и токсичные продукты, такие как кислородные радикалы, гидролитические ферменты, продукты арахидоновой кислоты, цитокины (интерлейкин-1, фактор некроза опухоли альфа (ФНО-альфа)). Эти медиаторы приводят к дальнейшему повреждению и некрозу клеток и матричных компонентов интерстиция, усиливают острый воспалительный ответ организма и вызывают приток лимфоцитов и моноцитов, которые в дальнейшем поддерживают реакции гиперчувствительности замедленного типа. Доказательствами развития иммунокомплексных реакций при ЭАА являются:
сроки воспалительного ответа после контакта с антигеном (4–8 часов);
обнаружение высоких концентраций преципитирующих антител IgG в сыворотке и ЖБАЛ больных;
обнаружение в гистологическом материале легочной ткани при остром ЭАА иммуноглобулина, компонентов комплемента и антигенов, то есть всех составляющих ИК;
классические кожные реакции Артюса у больных ЭАА, вызываемые высокоочищенными препаратами «виновных» антигенов;
повышение числа нейтрофильных лейкоцитов в ЖБАЛ после ингаляционных провокационных тестов.
Иммунные реакции, опосредованные Т-лимфоцитами (4-й тип), включают CD4+-Т-клеточную гиперчувствительность замедленного типа и CD8+-Т-клеточную цитотоксичность. Реакции замедленного типа развиваются через 24–48 часов после экспозиции антигена. Цитокины, высвободившиеся в результате иммунокомплексного повреждения, особенно ФНО-альфа, индуцируют экспрессию адгезивных молекул на клеточных мембранах лейкоцитов и эндотелиальных клеток, что значительно увеличивает последующую миграцию лимфоцитов и моноцитов в очаг воспаления. Отличительной особенностью реакций замедленного типа является активация макрофагов гамма-интерфероном, секретируемым активированными лимфоцитами СD4+. Продолжающаяся антигенная стимуляция поддерживает развитие реакций замедленного типа и ведет к формированию гранулем и активации фибробластов ростовыми факторами, а следовательно, к избыточному синтезу коллагена и интерстициальному фиброзу [11–13]. Доказательствами реакций 4-го типа являются:
наличие Т-лимфоцитов памяти как в крови, так и в легких больных ЭАА;
гистологическое подтверждение при подостром и хроническом течении ЭАА в виде гранулем, лимфомоноцитарных инфильтратов и интерстициального фиброза.
На моделях животных с экспериментальным ЭАА показано, что для индукции заболевания необходимо присутствие Т-лимфоцитов CD4+.
Гистологические изменения
Гистологические изменения зависят от стадии заболевания.
Острая форма ЭАА характеризуется отеком интерстициальной ткани легких, инфильтрацией альвеол и межальвеолярных перегородок лимфоцитами, плазматическими клетками, гистиоцитами и макрофагами. Пенистые альвеолярные макрофаги преобладают внутри альвеол, а лимфоциты – в интерстиции. Макрофаги с пенистой цитоплазмой, окруженные мононуклеарными клетками, патогномоничны для ЭАА. На ранних стадиях ЭАА обнаруживают интраальвеолярный фибринозный и белковый выпот. Нередко морфологические изменения затрагивают и бронхиолы, что приводит к развитию облитерирующего бронхиолита, образованию лимфатических фолликул перибронхиальных воспалительных инфильтратов.
Для подострой стадии болезни характерно образование эпителиоидноклеточных неказеозных гранулем, которые могут быть обнаружены в 67–90% случаев. Гранулемы при ЭАА отличаются от саркоидозных менее правильной формой (при саркоидозе их называют штампованными из-за похожести друг на друга), нечеткими границами, меньшими размерами, наличием большего количества лимфоцитов, утолщениями альвеолярных стенок, диффузными лимфоцитарными инфильтратами. Гранулемы обычно разрешаются в течение 6 месяцев при отсутствии повторного контакта с антигеном. При ЭАА некроз в центре гранулем отсутствует, тогда как при саркоидозе иногда выявляются гиалиновые, а при туберкулезе – казеозные некрозы. Наблюдаются различия и в расположении гранулем. При саркоидозе они располагаются в интерстициальной ткани легких и подслизистом слое крупных бронхов, а также пери- и интраваскулярно. Для ЭАА наиболее характерно расположение гранулем в интерстиции легких. Гранулематоз, альвеолит и бронхиолит составляют так называемую триаду морфологических признаков при ЭАА, хотя все элементы триады выявляют не всегда.
Хроническую стадию ЭАА отличает преобладание пролиферативных процессов. Увеличение клеточных и неклеточных элементов соединительной ткани способствует формированию интерстициального и внутриальвеолярного фиброза. Замещение эластических волокон проколлагеновыми и коллагеновыми приводит к коллагенизации интерстициальной стромы легких. Гранулемы трансформируются в соединительнотканные структуры. Для хронической стадии ЭАА характерно наличие телец Шаумана с отложением кальция и железа. Иногда такие тельца могут достигать значительных размеров. Формируются вторичная рубцовая эмфизема легких, кистозные изменения. Легкое приобретает сотовидное строение. Морфологическая картина становится аналогичной той, которая наблюдается при других формах фиброзирующих альвеолитов, в частности при идиопатическом (ИФА). В стадии «сотового легкого» специфичность морфологических изменений при ЭАА утрачивается, что следует учитывать при диагностике.
Такая морфологическая картина при хронической форме болезни очень похожа на патологические изменения при ИФА [14, 15].
Клиническая картина
Клиническая симптоматика ЭАА зависит от степени антигенности причинного аллергена, массивности и продолжительности антигенного воздействия, особенностей макроорганизма (генетические факторы, иммунный ответ).
Эти факторы и определяют течение болезни – острое, подострое, хроническое.
Острая форма ЭАА обычно развивается после массивной экспозиции антигена в домашних, производственных или окружающих условиях через 4–8 часов после контакта. Отмечаются следующие варианты течения:
гриппоподобный: озноб, повышение температуры тела, кашель, одышка, миалгии, артралгии, тошнота, головная боль, слабость. При аускультации – жесткое дыхание;
пневмониеподобный: признаки выраженной интоксикации, одышка смешанного типа с явлениями дыхательной недостаточности, кашель сухой или со скудной слизистой мокротой, боль в груди. При аускультации легких выслушивается крепитация, более выраженная в базальных отделах. На обзорных рентгенограммах грудной клетки – зоны паренхиматозной инфильтрации;
бронхитический: сухой непродуктивный кашель, сопровождающийся экспираторной одышкой и сухими рассеянными или свистящими хрипами в легких [16].
В случае прекращения контакта с антигеном перечисленные симптомы могут исчезать без лечения в течение 24–72 часов. Однако если контакт с причинным агентом продолжается, обычно ставится ошибочный диагноз. Диагностируют грипп, острую респираторную вирусную инфекцию, пневмонию, острый бронхит, диссеминированный туберкулез легких, бронхиальную астму. По данным Е.И. Шмелева, при анализе частоты диагностических ошибок у больных ЭАА, находившихся под наблюдением отдела гранулематозных болезней легких ЦНИИТ РАМН в течение 15 лет, в 63% случаев начальный диагноз ошибочен [1]. При проведении противопоказанных при ЭАА лекарственных воздействий (в первую очередь антибактериальная терапия) острая форма болезни принимает прогрессирующее течение и прогноз заболевания становится более серьезным.
Подострая форма развивается при менее интенсивной хронической экспозиции «виновных» антигенов, чаще в профессиональных или бытовых условиях. Наглядный пример – ЭАА, возникающий при контакте с домашними птицами. Основные симптомы – одышка при физической нагрузке, быстрая утомляемость, кашель со слизистой мокротой, субфебрильная температура тела, снижение аппетита, похудание. Типичен в этих случаях «феномен понедельника»: острые проявления наблюдаются в дни после отдыха, а к концу рабочей недели исчезают или протекают менее заметно. В легких, обычно в базальных отделах, выслушивается мягкая крепитация. Дифференциальный диагноз проводится с саркоидозом и другими интерстициальными заболеваниями легких.
Хроническая форма ЭАА может развиться при длительной ингаляции пыли и невысокой дозе ингалируемого антигена (например, если больной держит дома одну или двух птиц). Нераспознанный или нелеченый подострый ЭАА способен перейти в хроническую форму. Иногда хроническая форма развивается без предшествовавшей острой формы ЭАА и прогрессирует даже после прекращения контакта с антигеном.
Характерным симптомом хронической формы альвеолита является прогрессирующая одышка при физической нагрузке, периодически сопровождающаяся анорексией и выраженным снижением массы тела. Больные жалуются на кашель, общее недомогание, повышенную утомляемость, слабость. Температура тела часто остается нормальной. По мере прогрессирования заболевания появляются признаки дыхательной недостаточности и легочного сердца: диффузный серо-пепельный цианоз, усиление 2-го тона над легочной артерией, тахикардия, набухание шейных вен, периферические отеки. Незаметное начало симптомов и отсутствие острых эпизодов нередко затрудняют диагностику: ЭАА сложно отделить от других интерстициальных заболеваний легких, в частности от ИФА. Тахипноэ и крепитация также часто выявляются при хроническом ЭАА. Свистящие хрипы могут наблюдаться при обструкции дыхательных путей, но не являются характерным признаком заболевания, однако у некоторых пациентов способны привести к ошибкам при диагностировании. При хроническом течении ЭАА часто отмечается синдром гипертрофической остеоартропатии (концевые фаланги пальцев рук напоминают барабанные палочки), что предвещает неблагоприятный исход заболевания [17].
Диагностика
Анамнез. Необходимо уделять внимание профессии и роду занятий заболевших, выявлять возможный источник аллергена в быту и на производстве. При острой форме заболевания каждый контакт с антигеном проявляется сходной клинической картиной, при хронической форме четкой связи между контактом с антигеном и обострением нет.
Кожные пробы при ЭАА нельзя считать ни чувствительными, ни специфичными, поэтому в настоящее время для диагностики данного заболевания они применяются крайне редко. Так, при проведении проб с антигенами термофильных актиномицетов и многих плесневых грибов часто наблюдаются ложноположительные результаты, поскольку эти антигены вызывают неспецифическое раздражение кожи. Кожные пробы можно проводить при заболеваниях, вызванных сывороточными белками. При проведении кожных проб выявляется феномен Артюса, развивающийся в течение 4–6 часов и указывающий на взаимодействие антигена, антител IgG и комплемента.
Провокационный ингаляционный тест. Ингаляционные тесты впервые были проведены J. Williams (1963) в клинике Brompton. Ему удалось воспроизвести симптомы острого ЭАА. Аэрозоли для тестов были приготовлены из пыли и экстрактов заплесневелого сена, экстрактов актиномицетов из заплесневелого сена. В каждом случае болезнь «воспроизводилась» у фермеров, имевших ЭАА в анамнезе.
Сегодня не существует доступных коммерческих стандартизированных, высокоочищенных, специфичных антигенов для провокационных тестов, равно как и стандартизированных методов для проведения тестов или надежных показателей «доза – ответ». У чувствительных пациентов после теста иногда наблюдаются выраженное обострение заболевания и значительная гипоксемия. Поскольку ингаляция антигена способна привести к резкому ухудшению состояния, требующему госпитализации и внутривенного введения глюкокортикостероидов (ГКС), провокационные пробы проводят только в специализированных лабораториях. Результаты тестов оценивают по снижению жизненной емкости легких (ЖЕЛ), увеличению числа лейкоцитов в крови, повышению температуры тела. Постановка диагноза ЭАА редко требует проведения таких процедур. Однако когда необходимо убедительно доказать причинный фактор заболевания (по экономическим или социальным причинам), провокационные тесты проводятся. Один из вариантов таких тестов – наблюдение за пациентом в естественных профессиональных или бытовых условиях. Повторный контакт с антигеном в естественных условиях – это простой и относительно безопасный способ диагностики ЭАА. На определенный период полностью исключают контакт больного с «виновным» антигеном, затем больного возвращают в среду естественного контакта с этим антигеном. До и после контакта проводят физикальное обследование, рентгенографию грудной клетки и спирометрию. Отмечено, что результаты провокационных ингаляционных тестов в естественных условиях отличаются высокой специфичностью и не сопровождаются серьезными осложнениями [18].
Лабораторные исследования. Изменения в клиническом анализе крови у больных ЭАА зависят от остроты течения болезни и ее стадии. Для острой формы характерен лейкоцитоз, в среднем до 12–15 × 10⁹/л, иногда – 20–30 × 10⁹/л. Нередко отмечается сдвиг лейкоцитарной формулы влево. У некоторых больных определяется умеренная эозинофилия. Гиперэозинофилия, как правило, имеет место при ЭАА, вызванном грибами рода Aspergillus. У большинства пациентов отмечаются нормальные значения скорости оседания эритроцитов (СОЭ), но в 31% случаев этот показатель достигает 20–40 мм/ч и в 8% превышает 40 мм/ч [8]. Нередко выявляют повышенные уровни общих IgG и IgM, иногда – уровень общего IgA. Достаточно часто повышается уровень общей лактатдегидрогеназы, что может свидетельствовать об активности воспалительного процесса в паренхиме легких. У больных с хронической формой ЭАА выявляют умеренное повышение активности ревматоидного фактора. При исследовании белковых фракций определяется диспротеинемия (гипергаммаглобулинемия) [19].
Характерный признак ЭАА – появление в сыворотке преципитирующих антител, обычно IgG [20]. Выявить специфические антитела можно с помощью метода двойной диффузии по Оухтерлони, встречного иммуноэлектрофореза и иммуноферментных методов (ELISA, ELIEDA). Присутствие в сыворотке преципитирующих антител к какому-либо антигену полностью не доказывает его участия в патогенезе заболевания, а лишь свидетельствует о контакте с антигеном и развитии иммунного ответа, который может не проявляться клинически. Преципитирующие антитела выявляются у 90% больных с «легким фермера» в острой стадии. После прекращения контакта с антигеном антитела обнаруживаются в сыворотке в течение 1–3 лет. При хроническом течении преципитирующие антитела часто не выявляются. Возможны и ложноположительные результаты. Специфические антитела обнаруживаются в сыворотке 50% здоровых людей, постоянно контактирующих с тем или иным аллергеном, вызывающим ЭАА [17]. Таким образом, присутствие преципитирующих антител не всегда подтверждает диагноз ЭАА, а их отсутствие не исключает наличия заболевания. Однако обнаружение специфических антител может помочь в диагностике ЭАА, когда имеется предположение о наличии ЭАА, построенное на клинических данных, а природа «виновного» агента не ясна.
Рентгенологическая картина. Изменения, выявляемые у больных ЭАА, зависят от формы болезни (острая, подострая, хроническая). При острой форме отмечается усиление легочного рисунка без четких границ, локальные затемнения по типу инфильтрации. Рентгенологическая картина в 20% случаев может быть в норме при острой форме ЭАА. Рентгенологические изменения при острой форме ЭАА обычно разрешаются в течение 4–6 недель при отсутствии повторного контакта с «виновным» аллергеном. При подострой форме ЭАА наблюдается снижение прозрачности легочных полей по типу «матового стекла», выявляются распространенные узелково-сетчатые затемнения диаметром 2–5 мм. При хронической форме ЭАА выявляют хорошо очерченные линейные тени, выраженные интерстициальные изменения, узелковые затемнения, уменьшение размеров легочных полей, при далеко зашедших стадиях – картину «сотового легкого».
Наиболее ценную информацию можно получить при помощи компьютерной томографии (КТ), особенно высокого разрешения. КТ выявляет невидимые при обычной рентгенографии узелковые затемнения, зоны «матового стекла», картину «сотового легкого». КТ показывает нерегулярные линейные тени, снижение прозрачности легочных полей и кистозные просветления диаметром от 2 до 20 мм с толстыми неровными стенками, обычно располагающимися несколькими слоями субплеврально. С помощью КТ признаки «сотового легкого» выявляют в 70% случаев. Для сравнения: этот показатель при обзорной рентгенографии составляет 15–30%.
Функциональные тесты. Результаты исследования функции внешнего дыхания зависят от стадии процесса и выраженности фиброза. Изменения показателей функциональных легочных тестов при остром течении ЭАА обычно появляются через 6 часов после экспозиции антигена и демонстрируют рестриктивный тип нарушения вентиляции. Изменения функции внешнего дыхания иногда могут протекать двухфазно: немедленные изменения по обструктивному типу, включая снижение объема форсированного выдоха за 1-ю секунду (ОФВ₁), снижение коэффициента Тиффно (ОФВ₁/ФЖЕЛ (форсированная жизненная емкость легких)). Эти изменения сохраняются около часа, а через 4–8 часов меняются на рестриктивный тип вентиляции: уменьшение легочных объемов – общей емкости легких, ЖЕЛ, функциональной остаточной емкости (ФОЕ), остаточного объема легких. Коэффициент Тиффно – в пределах нормальных значений, возможно снижение максимального среднеэкспираторного потока (МСЭП 25–75), что свидетельствует о наличии обструкции на уровне мелких дыхательных путей. При хроническом ЭАА наиболее характерным изменением является также рестриктивный синдром, имеющий тенденцию к прогрессированию – снижению статических объемов легких. Иногда при хронических изменениях уменьшается эластическая отдача, что говорит об обструкции дыхательных путей при эмфиземе. Примерно у 10–25% пациентов обнаруживают признаки гиперреактивности дыхательных путей. Наличие корреляции между изменениями функций внешнего дыхания и прогнозом ЭАА не установлено. Пациенты с выраженными функциональными изменениями могут полностью выздороветь. В то же время у больных с небольшими функциональными дефектами в дебюте заболевания впоследствии можно наблюдать прогрессирующее течение заболевания с развитием фиброза и обструкции мелких дыхательных путей.
Наиболее чувствительным функциональным изменением является диффузионная способность легких (ДСЛ). Ее снижение – один из ранних признаков заболевания. Выраженность изменений ДСЛ может служить предиктором морфологической картины: выявлена достоверная корреляция между диффузионной способностью и выраженностью гистологических изменений, однако исходная ДСЛ не предсказывает дальнейшее течение ЭАА и ответ на противовоспалительную терапию. ДСЛ также является хорошим предиктором кислородного транспорта: ее снижение свидетельствует о выраженности десатурации во время физической нагрузки. Нарушение газообмена обычно отражает гипоксемию в покое, усугубляющуюся при физической нагрузке, увеличенный альвеолоартериальный градиент Р(А-а)О₂ и нормальное или незначительно сниженное парциальное напряжение СО₂ в артериальной крови. На ранних стадиях заболевания наблюдается нормальное напряжение О₂ в артериальной крови, но отмечается снижение сатурации во время физической нагрузки.
Исследование легочно-сердечной гемодинамики. Результаты исследования гемодинамики малого круга кровообращения у больных ЭАА методом эходопплерокардиографии показывают, что у больных с хронической формой болезни по мере прогрессирования патологического процесса происходят изменения в правых отделах сердца. Это проявляется гипертрофией или дилатацией правого желудочка и умеренным повышением давления в легочной артерии. Впоследствии формируется хроническое легочное сердце [2].
Ценным изотопным методом признано позитронное томографическое сканирование легких после ингаляции диэтилен-триаминпентаацетата, меченного технецием-99 (99mТс-DTRA). Данный метод позволяет оценить проницаемость альвеолярно-капиллярной мембраны и диффузного альвеолярного повреждения. Повреждение альвеол при интерстициальных заболеваниях легких отражает снижение клиренса технеция (99mТс), меченного DTRA, из легких в кровь.
Бронхологическое исследование. Бронхоскопия не имеет самостоятельного значения при ЭАА. Нередко при бронхоскопии наблюдается умеренный катаральный бронхит, реже – небольшое количество слизистого секрета.
Бронхоальвеолярный лаваж (БАЛ) – важнейший диагностический метод при ЭАА, позволяющий получить для исследования клетки и жидкость из нижних отделов дыхательных путей. Перечислим его преимущества:
возможность получить материал из большего количества альвеол, чем при биопсии;
относительная неинвазивность;
возможность многократного повторения;
безопасность.
Общее число осложнений при БАЛ не превышает 0–3% по сравнению с 7% при трансбронхиальной биопсии и 13% – при открытой биопсии легких. БАЛ имеет диагностическую значимость, позволяет оценить течение и прогноз ЭАА, мониторировать активность воспалительного процесса при терапии заболевания. Во многих случаях БАЛ позволяет обнаружить увеличенное число клеточных элементов (примерно в 5 раз) с преобладанием лимфоцитов, которые могут составлять от 20–30 до 70–80% общего числа всех клеток БАЛ. Лимфоциты представлены в основном Т-клетками, большинство из которых являются лимфоцитами CD8+. Соотношение CD8+/CD4+ при ЭАА не превышает 1:2, тогда как в норме составляет 1,2:1–1,6:1, а при саркоидозе – не менее 2:1. Подобная картина БАЛ характерна для подострого и хронического течения ЭАА. Если лаваж проведен в течение 3 суток после контакта с «виновным» антигеном, то состав БАЛ может быть совсем иным – с повышенным количеством нейтрофилов без сопутствующего лимфоцитоза. Часто в БАЛ при ЭАА отмечается и повышенное содержание тучных клеток. Их количество может превышать нормальный уровень в десятки раз. Как правило, тучные клетки выявляются при недавней экспозиции с антигеном (не позднее 3 месяцев). Считается, что именно число тучных клеток наиболее точно отражает активность заболевания и степень активации процессов фиброгенеза. При подостром течении ЭАА в БАЛ могут присутствовать плазматические клетки.
Диагностическое и прогностическое значение имеют и неклеточные компоненты БАЛ. При ЭАА в БАЛ наблюдается значительное повышение циркулирующих иммунных комплексов, уровня IgG, IgА и IgМ, причем отношение IgG к альбумину в БАЛ выше, чем в сыворотке, что, вероятно, связано с местной продукцией иммуноглобулинов. Альбумин также может иметь определенное значение. Содержание альбумина в БАЛ у больных альвеолитом значительно повышается, причем уровень альбумина тесно связан с лимфоцитозом в БАЛ, индексом сканирования с галлием-67 и ДСЛ.
Липидный состав БАЛ, отражающий систему сурфактанта, при ЭАА существенно изменяется: снижается общий уровень фосфолипидов, меняется соотношение их фракций, уменьшается отношение фосфатидилгликоля к фосфатидилинозитолу. Одним из наиболее популярных маркеров активности при ЭАА является другой компонент сурфактанта – протеин сурфактанта А (SP-A). Его содержание в БАЛ при ЭАА значительно снижено.
К другим неклеточным компонентам БАЛ, позволяющим оценить активность воспалительного процесса при ЭАА, относятся продукты секреции альвеолоцитов 2-го типа (муцин-антигены KL-6), фибробластов (проколлаген-3-пептид и гиалуронан), тучных клеток (гистамин и триптаза), эндотелиальных клеток (ангиотензинпревращающий фермент), компонентов внеклеточного матрикса (фибронектин и витронектин).
Открытая биопсия легких (ОБЛ) является «золотым диагностическим стандартом» при ЭАА и позволяет не только установить диагноз, но и предсказать прогноз заболевания и возможный ответ на терапию. Диагностическая информативность ОБЛ превышает 94%, общее число осложнений – около 5–19%, летальность – 3%. Биопсию производят из нескольких участков: из участков с наибольшими изменениями, по данным рентгенографии или КТ, и из участков с относительно сохранной паренхимой. Обычно берется 2–4 образца из верхней и нижней доли легкого. Язычковые сегменты и средняя доля в меньшей степени подходят для биопсии, поскольку в них обычно развиваются застойные явления или фиброз, не связанный с диффузным заболеванием легких. Кроме обычных морфологических и бактериологических/вирусологических исследований, биопсийные материалы могут использоваться для иммунофлуоресцентного, иммуногистохимического и электронно-микроскопического исследований. Это необходимо учитывать уже при заборе материала, поскольку каждое исследование требует специального приготовления и фиксации образцов. Помимо качественной оценки биопсии предложены специальные балльные системы для количественной оценки биопсий, которые учитывают выраженность клеточных воспалительных реакций, фиброза, десквамации, «сотовых» изменений. Такая оценка позволяет стандартизировать оценку биопсийных образцов и более точно установить стадию развития заболевания.
Видеосопровождаемая биопсия легких (ВСБЛ) – менее инвазивный метод биопсии, приобретающий все большую популярность в последнее время. ВСБЛ позволяет выполнить забор такого же числа и размера образцов, как и при ОБЛ, получить информацию в 95% случаев. Однако при ВСБЛ сокращаются продолжительность дренажа плевральной полости, длительность пребывания больных в стационаре и число осложнений процедуры (около 9%). Во многих клинических и исследовательских центрах отмечается тенденция к повышению доли числа ВСБЛ за счет уменьшения процедур ОБЛ и медиастиноскопии.
Трансбронхиальная биопсия (ТББ) используется для диагностики таких заболеваний, как саркоидоз, ЭАА, облитерирующий бронхиолит с организующейся пневмонией и без нее. Преимущество ТББ – большая безопасность по сравнению с ОБЛ, недостаток – малый размер получаемого образца, а следовательно, меньшая информативность. Осложнения при ТББ не превышают 7%, летальность практически нулевая.
Чрескожная пункционная биопсия (ЧКПБ) – еще один инвазивный метод диагностики. Процедура выполняется специальной режущей иглой типа Silverman под местной анестезией. Информативность ЧКПБ при интерстициальных заболеваниях легких – около 70%, число осложнений – до 30%, летальность нулевая. Несмотря на неоспоримую ценность исследования, биопсия выполняется лишь у небольшой части больных ЭАА.
Объем необходимых исследований в амбулаторных условиях включает:
клинический анализ крови;
анализ мочи;
рентгенографию органов грудной полости в прямой и боковой проекциях;
спирографию;
перфузионную сцинтиграфию легких и компьютерную томографию (по показаниям).
В стационарных условиях приведенный перечень дополняется детальным исследованием показателей, характеризующих:
иммунный статус больного (включая определение преципитирующих антител);
углубленное исследование вентиляционной способности легких (общая плетизмография, определение диффузионной способности легких, газов крови);
фибробронхоскопию – проведение диагностического БАЛ с последующим изучением его клеточного состава и ряда иммунологических показателей. При отсутствии противопоказаний во время фибробронхоскопии выполняется чрезбронхиальная биопсия легкого. В тех случаях, когда чрезбронхиальная биопсия неинформативна, а болезнь имеет тенденцию к прогрессированию, необходимо решать вопрос о видеоторакоскопической или открытой биопсии легкого. Обследование пациентов с ЭАА проводится только в специализированном пульмонологическом отделении или центре, оснащенном современной диагностической аппаратурой [10].
Группа исследователей из Америки, Европы, Японии поставила перед собой задачу разработать диагностические критерии для гиперчувствительного пневмонита. Для получения статистически достоверных диагностических критериев с февраля 1998 г. по сентябрь 2001 г. был обследован 1061 пациент. В результате проведенных исследований выявлено шесть статистически достоверных диагностических критериев:
Воздействие «виновного» антигена.
Возникновение симптомов спустя 4–8 часов после воздействия антигена.
Крепитация в легких при физикальном обследовании.
Повторяющиеся симптомы эпизодов заболевания (рецидивы симптомов).
Выявление преципитирующих антител в сыворотке крови.
Снижение массы тела.
Золотым стандартом в диагностике ЭАА являются:
исследование БАЛ;
проведение компьютерной томографии высокого разрешения [21].
Национальный институт сердца, легких и крови, Институт редких болезней и Национальный институт здоровья 10 и 11 мая 2004 г. организовали встречу, на которую пригласили исследователей, чтобы выработать рекомендации по улучшению диагностики и лечения ЭАА. Рабочая группа отметила необходимость в улучшении документации по изучению частоты и распространенности ЭАА в популяционных исследованиях и предложила классифицировать заболевание как рецидивирующее или постепенно развивающееся, а не острое, подострое и хроническое.
Будущие исследования должны включать больных с клиническими проявлениями, которые четко характеризуют стадии ЭАА. Больных без симптомов, но подвергшихся такому же контакту, следует включать в контрольную группу [22].
Рабочая группа рекомендует следующее.
Установить многоцентровое сотрудничество с определенными государственными структурами, заинтересованными в изучении ЭАА, улучшить распознавание, диагностику и лечение болезни, включающие сканирование и биопсию для улучшения клинических и лабораторных исследований.
Определить факторы риска организма человека (генетические и окружающей среды), влияющие на возникновение и естественное течение болезни. Исследовать генную регуляцию продукции воспалительных цитокинов и других маркеров заболевания.
Установить разумную, приемлемую, проверенную систему определения ЭАА, отражающую отличия в дизайнах исследований. Например, определение ЭАА, используемое в эпидемиологических исследованиях популяции высокого риска, будет отличаться от такового, используемого в гистологических анализах и сканировании. Исследование ЭАА будет улучшено при определении гистологических критериев, особенностей контакта с антигенами и лучшей характеристики фенотипов болезни (рецидивирующий или постепенно развивающийся).
Изучить обоснованность применения биомаркеров как при контакте, так и при развитии болезни. Назальный лаваж, индуцированная мокрота, конденсат выдыхаемого воздуха, периферическая кровь, БАЛ, мононуклеарные клетки в анализах пролиферации антиген-специфических лимфоцитов могут представлять собой дополнительные диагностические и исследовательские возможности при ЭАА.
Разработать и поддержать популяционные исследования, особенно в эндемичных районах, чтобы понять внешнесредовые и клинические особенности этих случаев. Для этого потребуется междисциплинарная оценка контакта, научная экспертиза аэрозоля для понимания связи «контакт – доза – ответ».
Определить естественное течение болезни в контексте других заболеваний, таких как астма. Изучить взаимоотношение иммунного и клинического ответа между ЭАА и симптомами верхних дыхательных путей.
Разработать набор стандартизированных антигенов, способных вызывать ЭАА, и сделать их доступными для клиницистов и исследователей как для диагностики, так и для научных исследований патогенеза.
Использовать КТ высокого разрешения для перспективной оценки и исследований по длительному наблюдению при ЭАА и других заболеваниях, вызванных органической пылью.
Осложнения
Прогрессирование интерстициального фиброза, редукция сосудистого русла легких приводят к повышению давления в малом круге кровообращения, формированию легочного сердца в далеко зашедших стадиях болезни. Кровохарканье, плевриты, пневмотораксы для ЭАА не характерны.
Исходы ЭАА
Прекращение контакта с причинным объектом, раннее установление диагноза и адекватное лечение обычно способствуют полному выздоровлению. В тех случаях, когда одно из упомянутых условий не соблюдено, болезнь приобретает подострое, а затем хроническое течение. Как уже отмечалось, хроническая форма ЭАА по течению практически не отличается от таковой ИФА [23, 24].
Дифференциальная диагностика
Дифференциальный диагноз нужно проводить с пневмониями, бронхиальной астмой, диссеминированными поражениями легких (милиарным туберкулезом, альвеолярным и метастатическим раком, саркоидозом, бронхолегочным аспергиллезом и другими фиброзирующими альвеолитами).
Диагноз «пневмония» («двусторонняя пневмония») – наиболее частая диагностическая ошибка. Можно выделить следующие признаки, отличающие бактериальную пневмонию от ЭАА:
связь начала заболевания с простудным фактором (в большинстве случаев) или возникновение пневмонии как осложнения других заболеваний. Начало ЭАА обусловлено ингаляцией органической или неорганической пыли, обладающей антигенными свойствами, или приемом внутрь, в ингаляциях или парентерально лекарственных средств, приобретающих в организме человека свойства антигена;
особенности клинических проявлений пневмонии: кашель, боль в груди, признаки общей интоксикации. У больных экзогенным аллергическим альвеолитом наряду с упомянутыми клиническими признаками имеет место инспираторная одышка, доминирующая в клинической картине;
аускультация выявляет крепитацию (мелкопузырчатые хрипы) над областью поражения (локальные) при пневмонии. У больных острой формой ЭАА крепитирующие хрипы выслушиваются обычно над всей поверхностью легких;
отсутствие прогрессирующих рестриктивных нарушений вентиляционной способности легких, существенного снижения диффузионной способности легких у больных пневмонией и наличие упомянутых нарушений у больных ЭАА, особенно при переходе болезни в подострую или хроническую форму;
бактериологическая идентификация возбудителя пневмонии в мокроте (бронхиальном смыве) в диагностических титрах;
четкое определение на рентгенограммах органов грудной полости у больных пневмонией границ пневмонической инфильтрации (сегмент, сегменты, доля, доли). У больных ЭАА рентгенологические изменения (интерстициальные, инфильтративные, очаговые) не имеют четких границ;
эффективность противомикробной и противовоспалительной терапии при пневмонии и неэффективность (противопоказана) при ЭАА;
быстрая положительная динамика клинических проявлений и рентгенологических изменений у больных ЭАА на фоне глюкокортикостероидной терапии [2].
Из-за острого начала болезни, сопровождающегося одышкой, кашлем и хрипами в легких, необходимо проводить дифференциальную диагностику с бронхиальной астмой.
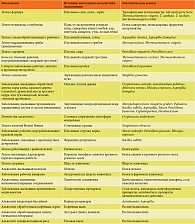
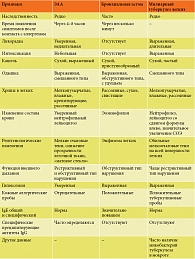
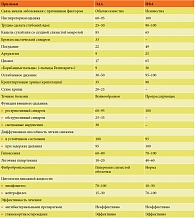
У отдельных больных ЭАА из-за сходства рентгенологических изменений приходится дифференцировать острую форму с милиарным туберкулезом. Милиарный туберкулез легких отличается от ЭАА отсутствием связи с внешними антигенами (для милиарного туберкулеза важен контакт с туберкулезными больными), более выраженной тяжестью и длительностью течения заболевания, особенностью рентгенологических проявлений (при милиарном туберкулезе тени обычно располагаются равномерно по всем легочным полям, их намного больше и они отчетливее, чем при ЭАА), положительными серологическими и кожными реакциями с туберкулезным антигеном, отсутствием в сыворотке крови повышенных титров преципитирующих антител к какому-либо экзоаллергену, который может привести к ЭАА. Различия между ЭАА, бронхиальной астмой и милиарным туберкулезом представлены в табл. 2.
Раковое поражение отличается от ЭАА отсутствием связи заболевания с воздействием экзогенного аллергена, неуклонным прогрессированием и более тяжелым течением заболевания, особенностями рентгенологических признаков поражения легких, отсутствием в сыворотке крови преципитирующих антител к какому-либо аллергену.
Дифференциальную диагностику проводят с не связанным с профессией саркоидозом, при котором поражаются не только легкие, но и другие органы, развивается гиперкальцийурия, рентгенологически в грудной клетке часто выявляются увеличенные прикорневые лимфоузлы, имеется гистологическое подтверждение саркоидозного процесса.
ЭАА следует дифференцировать от бронхолегочного аспергиллеза, который обычно сочетается с бронхиальной астмой. При рентгенологическом обследовании в легких обнаруживают преходящие несегментарные тени. Повторные обострения заболевания приводят к образованию проксимальных бронхоэктазов. В анализе крови и мокроты отмечают повышенное содержание эозинофилов. Кожные пробы и провокационные тесты с аллергенами аспергилл положительные.
Дифференциальную диагностику ЭАА следует проводить с другими формами фиброзирующих альвеолитов, в частности с ИФА. Основным признаком, отличающим эти две формы фиброзирующих альвеолитов, является известный причинный фактор, вызвавший заболевание при ЭАА, и неизвестный – при ИФА. Инспираторная одышка может иметь место при обоих заболеваниях, но при ИФА это доминирующий признак, практически определяющий всю клиническую картину. Кашель при обоих заболеваниях сухой или со скудной слизистой мокротой. У одной трети больных ЭАА имеет место бронхоспазм. Наличие этого признака практически исключает ИФА. Эти и другие признаки, отличающие ЭАА от ИФА, представлены в табл. 3.
Лечение
К основным принципам лечения больных ЭАА относят:
элиминацию аллергена;
подавление иммунного воспаления;
лечение дыхательной недостаточности.
Прекращение контакта с аллергеном, меры, направленные на элиминацию антигена из организма, определяют эффективность последующих лечебных мероприятий [25]. Элиминационных мероприятий иногда бывает недостаточно для полного выздоровления: состояние пациентов может быть средним или тяжелым при длительной и массивной экспозиции антигена. Такие случаи являются абсолютным показанием к назначению базисной терапии, то есть ГКС. Основные механизмы противовоспалительного действия ГКС заключаются в ингибировании миграции лимфоцитов и моноцитов в ткань легких, нарушении высвобождения цитокинов, супрессии иммунного ответа.
Вопрос о начальной дозе ГКС и длительности лечения решается индивидуально в зависимости от остроты процесса, степени выраженности клинических проявлений, возраста, массы тела, наличия сопутствующих заболеваний (гипертоническая болезнь, сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки).
Длительность приема ГКС зависит от быстроты обратной динамики клинических проявлений болезни, рентгенологических изменений и нарушений иммунологических показателей. Многие больные ЭАА положительно отвечают на терапию ГКС [26]. Начальная доза ГКС обычно не превышает 1 мг на 1 кг массы тела (в пересчете на преднизолон), но может быть и меньше. Продолжительность терапии ГКС в острой фазе ЭАА обычно не превышает одного месяца, при подострой фазе – не менее трех месяцев. В течение этого периода обычно достигается положительная клиническая и рентгенологическая динамика [1].
Высокие дозы ГКС вызывают множество побочных явлений. Развиваются метаболические и эндокринные осложнения: сахарный диабет, остеопороз, подавление функции надпочечников, нарушение водного и электролитного обмена, развитие желудочных язв, задняя субкапсулярная катаракта, психологические нарушения, миопатия. Стероидная миопатия нарушает функцию диафрагмы и межреберных мышц, приводя к снижению силы и выносливости дыхательной мускулатуры, что также вносит вклад в развитие диспноэ. Был описан успешный опыт использования более безопасной схемы ГКС при ЭАА: терапия преднизолоном 40 мг в течение пяти дней с последующим переходом на небулайзерную терапию Пульмикортом 4 мг/сут в течение недели и 2 мг/сут в течение трех месяцев. Использование ингаляционных ГКС (Пульмикорт Турбухалер, циклесонид, беклометазон, содержащие ультрамелкодисперсные частицы) в сочетании с системными (таблетированными) ГКС позволяет уменьшить дозу последних, а при длительном поддерживающем лечении – заменить их ингаляционными. Такая лечебная тактика позволяет избежать многочисленных побочных эффектов, свойственных системным ГКС [2].
При нарушениях бронхиальной проходимости (около 30% больных ЭАА испытывают приступы затрудненного дыхания) целесообразно назначать бронходилатирующие средства (предпочтительны ингаляционные бета-2-агонисты и антихолинергические препараты).
В остром и подостром периодах эффективны экстракорпоральные методы. Наиболее доступным из них является плазмаферез [27]. Показаниями к его проведению являются:
высокая степень активности патологического процесса, неуклонно прогрессирующее течение, резистентное к проводимой терапии;
наличие сопутствующих заболеваний (гипертоническая болезнь, ожирение и др.), ограничивающих применение ГКС;
возникновение побочных эффектов и осложнений после медикаментозного лечения при хроническом течении болезни (язва желудка, остеопороз и др.);
выраженные нарушения иммунного статуса (высокие уровни циркулирующих иммунных комплексов, иммуноглобулинов, дисбаланс показателей клеточного иммунитета).
Применение двух-трех сеансов плазмафереза с удалением средних объемов плазмы (до 1000 мл) один раз в неделю существенно повышает эффективность терапии системными ГКС и снижает потребность в высоких дозах ГКС. Эффективность плазмафереза, как, впрочем, и ГКС, снижается по мере формирования «сотового легкого».
При резистентности заболевания к ГКС или при наличии противопоказаний к их применению целесообразно использовать азатиоприн.
Азатиоприн – цитостатический препарат, относится к пуриновым аналогам, основным механизмом действия является блокада синтеза ДНК. Азатиоприн индуцирует лимфопению, снижает число Т- и В-лимфоцитов, подавляет синтез антител, оказывает мощное противовоспалительное действие: блокирует синтез простагландинов, уменьшает проникновение лимфоцитов, нейтрофилов в очаг воспаления. Назначается по 150 мг/сут в течение 1,5 месяцев, далее 4–6 месяцев сначала по 100 мг/сут, затем по 50 мг/сут. Основными побочными эффектами являются панцитопения (при снижении числа лейкоцитов менее 3 тыс/мл или тромбоцитов менее 100 тыс/мл доза препарата должна быть уменьшена), желудочно-кишечные нарушения, гонадо- и тератотоксичность.
При лечении ЭАА можно применять и другие иммуносупрессивные препараты, например D-пеницилламин и колхицин.
D-пеницилламин (Купренил) блокирует образование поперечных связей коллагена и дальнейшее фиброзообразование. Препарат наиболее эффективен при обострении или быстром прогрессировании заболевания. Назначают по 150–200 мг/сут в течение 4–6 месяцев с последующим приемом по 100 мг/сут в течение двух лет.
Колхицин уменьшает продукцию макрофагами фибронектина, инсулиноподобного фактора роста, снижает конверсию проколлагена в коллаген, ингибирует миграцию и пролиферацию фибробластов.
Кроме того, при терапии ЭАА используют циклоспорин.
Циклоспорин А является эффективным супрессором Т-лимфоцитов, уменьшает гуморальный и клеточный иммунный ответ. Поскольку Т-лимфоциты играют важную роль в процессе воспаления при ЭАА, применение циклоспорина А при заболевании вполне обоснованно.
При развитии гипоксемии, как и при других заболеваниях легких, кроме медикаментозной терапии используют терапию кислородом. Показания к длительной оксигенотерапии обычно не отличаются от принятых при хроническом обструктивном заболевании легких:
PaO₂ в покое 55 мм рт. ст.;
РаO₂ в покое в пределах 55–60 мм рт. ст. при наличии признаков легочного сердца или полицитемии;
снижение РаO₂ менее 55 мм рт. ст. при физических нагрузках, во время сна.
Пациенты с ЭАА нуждаются в более высоком назначении потока O₂, чем при других заболеваниях легких, из-за более выраженного вентиляционно-перфузионного дисбаланса и ограничения ДСЛ. Кислородотерапия способна уменьшить диспноэ, повысить интенсивность и длительность физических нагрузок у больных ЭАА [1].
Перспективными направлениями терапии ЭАА признаны ингибиторы факторов роста, ингибиторы цитокинов, антифиброзные препараты (нацин, таурин, пирфенидон), антипротеазы, препараты сурфактанта, генная терапия.
Прогноз
Распознавание ЭАА на ранних стадиях острого течения позволяет достичь полного выздоровления благодаря прекращению контакта с причинным агентом и назначению (при необходимости) лечения. Ошибочная диагностика и продолжение контакта с причинным фактором, неправильная лечебная тактика способствуют активизации процессов пролиферации в легочной ткани и переходу болезни в необратимую стадию, клинически выражающуюся прогрессирующей дыхательной недостаточностью, морфологически-прогрессирующим интерстициальным и внутриальвеолярным фиброзом, облитерирующим бронхиолитом и формированием «сотового легкого». В этих случаях прогноз неблагоприятный. Длительность жизни больных с хронической формой ЭАА существенно не отличается от таковой при ИФА и составляет 7,1 года [28].
Профилактика
Основными методами профилактики профессионально обусловленных ЭАА являются меры по механизации и автоматизации технологических процессов на производствах, связанных с запылением рабочих мест, а также использование индивидуальных средств защиты (респираторы, спецодежда).
Профилактика медикаментозных ЭАА сводится к рациональному использованию лекарственных средств с учетом аллергологического анамнеза, исключению полипрагмазии и самолечения.
Профилактика ЭАА, связанных с экологией жилища, предполагает борьбу с размножением плесени (характерно для сырых помещений). Лица, содержащие декоративных птиц (попугаев, канареек и др.), подвергаются риску развития ЭАА.
Особое значение имеет рациональное трудоустройство лиц, перенесших острую и подострую форму ЭАА, а также лиц, относящихся к группе риска развития ЭАА [2].
Разумное использование профилактических мер, выявление групп риска, своевременная диагностика и лечение позволяют успешно решать проблемы ЭАА.
Ye.P. Terekhova
Russian Medical Academy for Postgraduate Education
Contact person: Yekaterina Petrovna Terekhova, e.p._terekhova57@mail.ru
The article addresses prevalence, classification, pathogenesis, current methods of diagnosis, differential diagnosis and management of extrinsic allergic alveolitis.
