количество статей
6422
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Антибактериальная терапия: выбор у детей с расщелиной твердого нёба в предоперационном и постоперационном периодах
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" №1
- Аннотация
- Статья
- Ссылки
У детей с врожденной изолированной расщелиной губы и нёба были проведены микробиологические исследования мазков из зева для выбора рациональной антибиотикотерапии. Было выявлено преобладание грамотрицательной микрофлоры в полости рта. Для предупреждения развития интеркуррентных заболеваний и послеоперационных осложнений, по результатам исследования, в дооперационном и послеоперационном периодах должны использоваться парентеральные цефалоспорины III и IV поколения, перорально – цефиксим и защищенные аминопенициллины.
Рис. 1. Ребенок с расщелиной твердого нёба
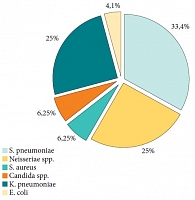
Рис. 2. Результаты микробиологического обследования (48 штаммов)
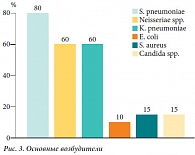
Рис. 3. Основные возбудители
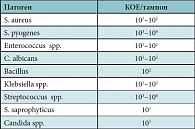
Таблица 1. Нормоценоз ротоглотки
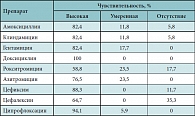
Таблица 2. Чувствительность альфа-гемолитического Streptococcus к антибиотикам (17 штаммов)
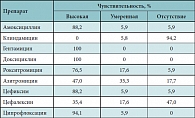
Таблица 3. Чувствительность Neisseriae spp. к антибиотикам (17 штаммов)
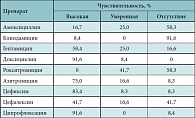
Таблица 4. Чувствительность Klebsiella spp. к антибиотикам (12 штаммов)
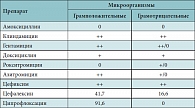
Таблица 5. Сравнительная антимикробная активность антибиотиков
ВРГН – анатомический дефект, который влияет на одну из важных защитных функций иммунной системы, особенно если ребенок подвержен заболеваниям ЛОР-органов и верхних дыхательных путей. В норме лимфоглоточное кольцо с момента рождения защищает ребенка от респираторных вирусов, бактерий, грибов. Одним из первых ученых, который сформулировал и выдвинул теорию значения местного иммунитета ротовой полости в 1925 г., был А.М. Безредка. Он подчеркивал независимость механизмов местного иммунитета от системного и значение местных иммунных механизмов слизистых полости рта при развитии инфекционных заболеваний. Как видно из таблицы 1, в норме в полости рта содержатся условно-патогенные (и грамположительные, и грамотрицательные) микроорганизмы, большое значение имеет их количество по КОЕ. Ротовая полость у ребенка выполняет ряд неотъемлемых функций: сосательную, глотательную, пищеварительную, дыхательную, слюнообразовательную. К основным и необходимым относится также поддержание нормального состояния слизистой полости рта. Слюна содержит факторы специфической и неспецифической защиты. В качестве факторов специфической защиты выступают иммуноглобулины, Т- и В-лимфоциты. Барьерная функция иммуноглобулинов проявляется:
- обеспечением связывания и нейтрализации микроорганизмов, находящихся на поверхности слизистых;
- ингибированием адгезии возбудителей и снижением риска проникновения в организм;
- связыванием комплемента и предупреждением развития воспаления;
- осуществлением взаимодействия антигенсвязывающих центров антител с эпитопами антигенов;
- потенцированием активности факторов неспецифической защиты.
- интерферонами (повышают противовирусную защиту клеток эпителия и активизируют натуральные киллеры и макрофаги);
- лизоцимом (обладает бактерицидным эффектом, элиминирует возбудителей, блокирует транскриптазу вирусных частиц);
- лактоферрином (снижает степень колонизации сидерофильных бактерий за счет их связывания с железом);
- макрофагами, нейтрофилами и др.
В этом возрасте происходит переориентация иммунного ответа на инфекционные антигены с превалирования Th2-ответа, свойственного новорожденным и детям первых месяцев жизни, на Th1, свойственный взрослым [3]. Анатомический дефект лимфоглоточного кольца способствует дисфункции микробиоценоза и местного иммунитета слизистой рото- и носоглотки. Так, у детей с хронической формой аденоидита в назальном секрете и слюне было значительно снижено общее количество секреторного иммуноглобулина (sIgA), лизоцима, а также сывороточного IgA. Дефицит секреторного иммуноглобулина А, дисфункция нормальной микрофлоры, способствует развитию воспалительных заболеваний кожи и слизистых верхних дыхательных путей [4]. Дети с расщелиной нёба относятся к категории часто болеющих детей (ЧБД), так как начинают болеть респираторными заболеваниями практически с первых месяцев жизни. Такие заболевания, как ОРВИ, ОРЗ, ринит, бронхит, начинаясь с рождения, протекают волнообразно до периода операции.
У ЧБД выявляются также нарушения в системе продукции интерферона (ИФН). В исследовании, проведенном группой авторов, у часто болеющих детей в 80% случаев было показано снижение способности клеток к синтезу гамма-ИФН в 2 раза по сравнению с редко болеющими детьми. Учитывая дефект местной защиты, можно предположить, что в развитии частых воспалительных заболеваний рото- и носоглотки у данной группы детей будет иметь значение наличие патогенной микрофлоры, особенно грамотрицательной [5–7]. Для хирурга важным аспектом при проведении успешной операции является наличие нормальной микрофлоры полости зева. Нередко безупречно выполненная операция может иметь осложнения в результате размножения патогенной микрофлоры или развития респираторных заболеваний в послеоперационном периоде. Успех антибактериального лечения напрямую связан со своевременным выявлением микрофлоры полости рта ребенка, что позволяет назначить этиотропный антибиотик.
Согласно данным разных авторов, в качественном составе и количестве микрофлоры, взятой из расщелины, преобладают Candida spp. (74,7%), E. сoli (12,7%), Klebsiella spp. (18,7%) [8]. В этой ситуации неверно выбранный вначале антибиотик может послужить причиной неэффективности дальнейшей терапии, назначения повторных курсов терапии, что значительно увеличит не только количество койко-дней, но и стоимость всего лечения. Именно поэтому в последние годы уделяется большое внимание рациональному выбору антибактериальных средств, что предполагает не новизну препарата, а своевременное назначение этиотропной терапии с учетом бактериального агента, полученного в ходе проведения микробиологического исследования. У детей с расщелиной губы и нёба следует учитывать также факт неоднократной госпитализации, возможность формирования устойчивой госпитальной микрофлоры разных стационаров России. Кроме того, выбор антибиотиков, в особенности у детей первых месяцев и первых двух лет жизни, ограничен из-за токсичности многих препаратов (аминогликозидов, хлорамфеникола, сульфаниламидов, цефтриаксона, фторхинолонов). Антибактериальные препараты, используемые у детей, должны быть не только высокоэффективными, но и обладать минимальным риском развития дисбактериоза, токсических и аллергических реакций [9].
Материалы и методы
Нами было проведено микробиологическое обследование детей с ВРГН для выявления основных возбудителей и выбора адекватной антибактериальной терапии. В исследование были включены 20 детей (9 девочек и 11 мальчиков) преимущественно первых двух лет жизни (85%) с отягощенным акушерско-гинекологическим анамнезом. Из 20 детей 15 поступили в стационар из разных городов России, 5 – из Москвы. У 30% отмечались респираторные заболевания, бронхит и пневмония как в дооперационном, так и в послеоперационном периоде. Троим детям по этой причине не была проведена операция. Оценивая течение до- и послеоперационного периода у 17 оперированных детей, можно выделить 4 (23,5%) с благоприятным течением заболевания. Оказалось, что оперативное вмешательство у них проводилось в ранние сроки (3–8-й день госпитализации), осложнений не было, и выписка из стационара также осуществлялась в более ранние сроки (14–21-й день). У 13 детей (76,5%) сроки проведения операции были больше (16–31-й день госпитализации), соответственно, и выписка из стационара – на 25–48-й день.
Проведение операции в более поздние сроки было обусловлено респираторными заболеваниями (у 5 пациентов), бронхообструктивным синдромом и инфекцией мочевых путей (по 1 больному соответственно). Известно, что условием нормального течения послеоперационного периода является нормальный уровень гемоглобина. У трех детей сниженный гемоглобин стал причиной переноса оперативного вмешательства. В ранние сроки после проведения операции у трех детей было выявлено повышение внутричерепного давления. Анамнез показал, что они страдали гипертензионно-гидроцефальным синдромом с рождения, что следует учитывать. Таких детей желательно консультировать у невролога до операции.
Результаты и обсуждение
Микробиологическое обследование микрофлоры из носо- и ротоглотки проводилось до операции и исследовалось в ФБУН "МНИИЭМ им. Н.И. Габричевского" с определением чувствительности к наиболее часто применяемым на практике антибиотикам. После получения микробиологических результатов назначалось этиотропное антибактериальное лечение. Результаты микробиологического обследования представлены на рисунке 2. Из представленной диаграммы видно, что у всех обследованных детей выявлены следующие основные возбудители: Streptococcus pneumoniae, Neisseriae spp., Klebsiella pneumoniae, E. coli, Staphilococcus aureus, Candida. Грамотрицательная микрофлора составила 54,1%. На рисунке 3 представлены преобладающие возбудители у 20 обследованных детей. У 80% детей определялся Streptococcus pneumoniae, у 60% – Neisseriae spp. и Klebsiella pneumoniae, реже – E. coli, Staphilococcus aureus и Candida. Смешанная микрофлора имела место у 60% детей. При анализе сочетания различных возбудителей оказалось, что грамотрицательная микрофлора (Neisseriae spp., Klebsiella pneumoniae, E. coli) выделялась у всех детей (100%), в то же время грамположительная микрофлора (Streptococcus pneumoniae и Staphilococcus aureus) – у 60% детей. Очевидно, что для детей с ВРГН характерно преобладание грамотрицательной микрофлоры с раннего возраста из-за анатомического дефекта и соединения рото- и носоглотки. Нами была также проанализирована плотность возбудителей, превышающих их нормальное содержание в ротоглотке. Так, 75% штаммов альфа-гемолитического Streptococcus, 63,2% Neisseriae spp. и 33,3% Klebsiella pneumoniae выявлялось в концентрации, превышающей 107 КОЕ/мл.
Были определены чувствительность и резистентность основных возбудителей (Streptococcus pneumoniae, Neisseriae spp., Klebsiella pneumoniae) к антибиотикам (табл. 2, 3, 4). Высокую чувствительность (88,3–100%) альфа-гемолитические Streptococcus pneumoniae проявили к цефиксиму, ципрофлоксацину и доксициклину, однако применение двух последних в педиатрической практике ограничено или не разрешено. Чуть меньшая чувствительность (82,4%) выявлена по отношению к амоксициллину, клиндамицину, гентамицину. Однако, как показали последние разработки в области химиотерапии, гентамицин практически не применяется в педиатрической практике из-за нефро- и ототоксического эффекта, особенно когда речь идет о новорожденных и детях первых месяцев жизни. Передозировка аминогликозидов может проявиться в угнетении центральной нервной системы (ЦНС), повышенной вялости, ступоре, угнетении дыхания и развитии комы. Из-за пониженной функции почек у детей раннего возраста преобладает более длительный период полувыведения, что может привести к накоплению аминогликозидов и их токсическому действию [10]. Между тем большинство наблюдаемых нами больных – дети первого года жизни (65%) и дети с перинатальным поражением ЦНС (30%). Известно также, что большинство педиатров в своей практике активно применяют цефалоспорины I поколения и макролиды. К широко используемым в педиатрии препаратам, таким как азитромицин, рокситромицин, цефалексин, у детей изучаемой группы оказалась довольно низкая антибактериальная активность (соответственно 76,5%, 58,8%, 64,7%).
Neisseriae spp. относятся к грамотрицательным коккам, которые при определенных условиях и высокой их плотности могут вызывать различные воспалительные процессы носоглотки, ротоглотки, суставов, мочевых путей, легких. Оценивая чувствительность Neisseriae spp. к антибиотикам, можно выделить два основных высокочувствительных препарата – цефиксим и амоксициллин. У азитромицина и цефалексина – очень низкая антибактериальная активность, 94% штамма резистентны к клиндамицину. Сложно выбрать также нужный антибиотик для лечения инфекции, вызванной Klebsiella pneumoniae, поскольку большинство штаммов либо мало-чувствительны, либо резистентны. Антибиотиком выбора в этом случае является цефиксим. Умеренно чувствителен – азитромицин. Суммируя, таким образом, результаты антимикробной активности препаратов, нами была предложена таблица сравнительной антимикробной активности препаратов (табл. 5). При выборе антибиотика для лечения детей с преобладанием изолированной или смешанной грамположительной микрофлоры в тяжелых случаях следует ориентироваться на выбор цефалоспоринов I, II и III поколения и аминогликозидов II поколения [11].
Для перорального приема антибиотиками выбора могут быть цефиксим и амоксициллин. Для лечения грамотрицательной микрофлоры в тяжелых случаях предпочтительны цефалоспорины III и IV поколения, карбапенемы. При смешанной микрофлоре – грамположительной и грамотрицательной – следует руководствоваться этими же критериями. Результаты данного исследования следует учитывать в практике работы хирургического отделения, поскольку основным из наиболее часто назначаемых антибиотиков до настоящей работы был цефазолин (цефалоспорин I поколения). После проведения исследования были пересмотрены показания к назначению антибиотиков с учетом чувствительности основной микрофлоры. Одними из основных антибиотиков выбора в нашей работе являлись амоксициллин (кроме случаев с Klebsiella pneumoniae) и цефиксим. Амоксициллин – полусинтетический пенициллин широкого спектра действия, угнетающий синтез бактериальной стенки. Механизм устойчивости грамотрицательных бактерий к бета-лактамам связан с продукцией бета-лактамаз широкого спектра, разрушающих бета-лактамное кольцо. Бета-лактамное кольцо ингибитора бета-лактамаз обеспечивает возможность образования стабильного комплекса между ним и бета-лактамазой бактерий, что приводит к необратимому подавлению активности фермента и предотвращению инактивации антибиотика [12].
Для преодоления резистентности в настоящее время используют комбинированные препараты, содержащие антибиотик и ингибитор бета-лактамаз, в том числе клавулановую кислоту. Клавулановая кислота является производным Streptomyces clavuligeris. Амоксициллин/клавуланат давно стал базовым препаратом в педиатрической практике для лечения таких заболеваний, как синусит, отит, тонзиллофарингит, пневмония [13]. Вместе с тем известны и нежелательные действия клавуланата на систему пищеварения, которые проявляются в виде диареи и диспептических расстройств. По данным ряда авторов, на долю таких явлений приходится от 18 до 20% [14]. Почему это происходит? Амоксициллин представляет собой слабое основание, и поэтому наиболее полное его всасывание происходит при щелочном значении рН в верхних отделах кишечника. Клавулановая кислота представляет собой слабую кислоту, поэтому абсорбция препарата будет неполной, а остаточные концентрации высокими [15]. Поэтому для предотвращения данных последствий в последние годы проводились разработки лекарственных форм по инновационной технологии, в основе которой лежит равномерная дисперсия частиц для уменьшения побочных явлений.
Согласно данной технологии происходит повышение всасывания клавулановой кислоты до 62–68%, а действующее вещество в неизмененном виде максимально всасывается в зоне воспаления [15]. Цефиксим – пероральный цефалоспорин III поколения – имеет широкий спектр действия на следующие возбудители: грамположительные Streptococcus spp., семейство Enterobacteriaceae, грамотрицательные Klebsiella pneumoniae, а также H. influenzae, Moraxella catarrhalis. В ранее проведенных исследованиях в России и за рубежом была показана клиническая эффективность цефиксима при заболеваниях ЛОР-органов: острых и хронических синуситах, отитах, тонзиллофарингитах, эпиглоттитах, заболеваниях верхних и нижних дыхательных путей, инфекциях мочевой системы [16–20]. Важно отметить, что препарат устойчив к действию бета-лактамаз, продуцируемых большинством грамположительных и грамотрицательных бактерий.
Цефиксим в виде суспензии назначается детям с 6-месячного возраста до 12 лет (8 мг/кг в сутки) и в капсулах по 400 мг (6 штук в упаковке) детям старше 12 лет и взрослым. Благодаря пролонгированной фармакокинетике он создает эффективные концентрации в очаге воспаления, в крови, тканях и жидкостях организма. Отличительными особенностями цефиксима являются: однократный прием, приятные органолептические свойства (вкус клубники), возможность применения в стационаре и амбулаторной практике. Продолжительность курса лечения определяется исходя из ряда обстоятельств: тяжести, догоспитального приема антибиотиков, острого или хронического процесса, развития возможных бактериальных осложнений. Целесообразно "ступенчатое" назначение цефиксима, при котором в первые 3 дня цефалоспорины (II–IV поколения) вводятся в организм парентерально, а затем курс лечения продолжается цефиксимом еще 3–7 дней. В целом курс лечения цефалоспоринами может составлять в среднем 7–10 дней.
Кроме того, преимуществами назначения цефиксима в стационаре являются уменьшение нагрузки на медицинский персонал, возможность хранения без холодильника, независимость от приема пищи и, безусловно, отсутствие болевого фактора и психической травмы для ребенка. При приеме внутрь цефиксима отмечается хорошая его переносимость. Относительно редки нежелательные явления в виде диареи, тошноты, кожной сыпи. При взаимодействии с другими лекарственными средствами осложнений не выявлено. В рекомендациях 2007 г. [15] для лечения детей в отделениях челюстно-лицевой хирургии в качестве антибиотиков выбора были рекомендованы амоксициллин, линкомицин, клиндамицин, цефуроксим. Как показали наши исследования, большинство штаммов грамположительных и грамотрицательных бактерий были не чувствительны к линкомицину, клиндамицину и цефуроксиму. Благодаря проведенному исследованию, помимо амоксициллина, выбор пал на цефиксим, исходя из знания основных возбудителей и их резистентности у детей с ВРГН. По результатам проведенной работы рекомендован следующий алгоритм обследования ребенка:
- Мазок из зева на флору (для выявления преобладающей микрофлоры полости рото- и носоглотки).
- Контроль общего анализа крови до поступления в стационар и в первые дни поступления для коррекции анемии.
- Наличие данных нейросонографии или электроэнцефалографии (при указании на перенесенные перинатальные поражения ЦНС).
Заключение
Таким образом, дети с ВРГН – часто болеющие дети в основном первого года жизни (65%) со своеобразным преобладанием грамотрицательной микрофлоры в полости рта. Благоприятное течение послеоперационного периода возможно при проведении операции в ранние сроки – на 3–8-й день – и выписке на 14–21-й день госпитализации. Неблагоприятное течение и более длительные сроки пребывания в стационаре (до 48 дней) обусловлены развитием интеркуррентных (ОРЗ, бронхит, пневмония, ИМП) и сопутствующих (анемия, повышение внутричерепного давления) заболеваний. Для предупреждения развития интеркуррентных заболеваний и осложнений рекомендуется проводить микробиологическое исследование, общий анализ крови в ранние сроки – до поступления или в первые дни госпитализации. Антибиотиками выбора в дооперационном и послеоперационном периодах должны быть цефалоспорины III–IV поколения (парентерально) и цефиксим перорально, а также защищенные аминопенициллины. Успех лечения данной категории детей на практике во многом будет зависеть от вышеперечисленных условий обследования и лечения.
1. Гончакова С.Г., Бельченко В.А., Притыко А.Г., Кулаков А.А. Опыт хирургического лечения пациентов с обширными дефектами нёба и альвеолярного отростка верхней челюсти // 5-й Международный симпозиум "Актуальные вопросы черепно-челюстно-лицевой хирургии и нейропатологии". М., 2005. С. 21.
2. Гончаков Г.В., Притыко А.Г., Гончакова С.Г. Тактика оперативного лечения детей с врожденными двусторонними расщелинами верхней губы // 6-й Международный симпозиум "Актуальные вопросы черепно-челюстно-лицевой хирургии и нейропатологии". М., 2008. С. 55.
3. Гриппи М. Патофизиология легких. 2-е изд. М.: Бином, 2005. 303 с.
4. Вавилова В.П., Перевощикова Н.К. Образовательная программа для педиатров и врачей общей практики "Реабилитация часто болеющих детей". М.: Международный фонд охраны здоровья матери и ребенка, 2004. 24 с.
5. Балева Л.С., Балясинская Г.Л., Блистинова З.А. и др. Современные подходы к лечению и реабилитации часто болеющих детей. М., 2006. 46 с.
6. Ильенко Л.И., Холодова И.Н., Сырьева Т.Н. и др. Часто болеющий ребенок. Клинико-экспериментальное и экономическое обоснование новых технологий профилактических и восстановительных мероприятий в амбулаторно-поликлинических условиях (учебно-методическое пособие). М., 2008. 64 с.
7. Хелминская Н.М. Клиника, диагностика и методы хирургического лечения больных с орбитальным гипертелоризмом I–II степени: Дисс. … канд. мед. наук. М., 1993. 124 с.
8. Вологина М.В. Колонизационная резистентность полости рта у детей с врожденной расщелиной нёба до уранопластики: Автореф. дисс. … канд. мед. наук. Ростов, 2008. 23 с.
9. Постников С.С. Педиатрические аспекты клинической фармакологии // Фарматека. 2007. № 1. С. 18–25.
10. Страчунский Л.С., Белоусов Ю.Б., Козлов С.Н. Практическое руководство по антиинфекционной химиотерапии. М., 2002. С. 382.
11. Яковлев С.В., Яковлев В.П. Современная антимикробная терапия // Consilium Medicum. 2007. Т. 9. № 1. С. 87.
12. Зайцев А.А., Колобанова Е.В., Синопальников А.И. Внебольничные инфекции дыхательных путей: место "защищенных" аминопенициллинов // Лечащий врач. 2008. № 5. С. 75–79.
13. Алексеева Е.И., Валиева С.И., Александров А.Е., Хмызова С.А. Эффективность амоксициллина/клавуланата при лечении острой внебольничной пневмонии у детей // Педиатрическая фармакология. 2006. Т. 3. № 5. С. 60–63.
14. Белобородова Н.В., Блохин Б.М., Богомильский М.Р. и др. Современные режимы дозирования пероральных аминопенициллинов. Образовательный проект ЭРА (экспертные рекомендации по антибиотикотерапии) // Трудный пациент. 2004. Т. 2. № 9. С. 24–28.
15. Карпов О.И. Флемоклав Солютаб – новая лекарственная форма амоксициллина/клавуланата в лечении синусита // Клин. фармакол. тер. 2006. Т. 15. № 4. С. 1–4.
16. Савенкова М.С. Значение и место оральных цефалоспоринов III поколения в педиатрической практике // Соnsilium Medicum. Педиатрия. Приложение. 2007. № 2. С. 62–66.
17. Савенкова М.С. Современные аспекты этиопатогенеза и тактики ведения детей с острым стенозирующим ларингитом // Педиатрия. 2008. Т. 87. № 1. С. 133–138.
18. Котлуков В.К., Кузьменко Л.Г. Рациональная антибиотикотерапия инфекций дыхательных путей и ЛОР-органов у детей в амбулаторной практике педиатра // Педиатрия. 2008. Т. 86. № 6. С. 110–115.
19. Егорова О.А., Козлов С.Н. Цефиксим в терапии инфекций ЛОР-органов у детей // Вопросы современной педиатрии. 2008. Т. 7. № 3. С. 54–59.
20. Савенкова М.С., Балясинская Г.Л., Бычков В.А. и др. Острый эпиглоттит у детей (этиопатогенез, диагностика, лечение) // Вопросы современной педиатрии. 2008. Т. 7. № 5. С. 91–97.
Новости на тему
СТАТЬИ по теме
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
