Ацетилхолинергическая терапия в восстановительном периоде ишемического инсульта
- Аннотация
- Статья
- Ссылки
- English

Введение
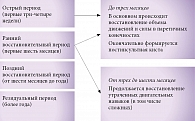
Инсульт был и остается самым распространенным и одним из самых тяжелых неврологических заболеваний. По эпидемиологическим данным, заболеваемость инсультом составляет 2,5–3 новых случая на 1000 населения в год. В остром периоде инсульта погибает 35% больных, а к концу первого года – 50%. В течение пяти лет после первого инсульта повторное острое нарушение мозгового кровообращения развивается в 26% случаев, а в течение десяти лет – в 39% случаев. Инсульт занимает первое место среди всех причин инвалидности: в настоящее время 3 из 10 000 человек имеют инвалидность вследствие инсульта. По данным Национального регистра, 31% пациентов, перенесших инсульт, нуждаются в постоянном уходе, а к труду возвращаются лишь 20% выживших больных [1–3]. Общепринятая периодизация инсульта приведена на рис. 1. Ведение больных после перенесенного ишемического инсульта в значительной степени зависит от особенностей неврологических нарушений, выявляемых во время тщательного осмотра.
Основные принципы реабилитации
Реабилитация – комплекс медицинских, педагогических, психологических и иных мероприятий, направленных на максимально возможное восстановление или компенсацию нарушенных или полностью утраченных функций. Реабилитационные мероприятия начинают проводить с первого дня госпитализации и продолжают после выписки больного в течение необходимого времени [3–5]. Основная предпосылка и главное условие восстановления нарушенных неврологических функций – способность нейронов изменять микроструктурные и функциональные свойства. Это фундаментальное свойство нервной ткани получило в литературе название «феномен нейропластичности» [6, 7].
Наиболее активными реабилитационные мероприятия должны быть в остром и раннем восстановительном периоде инсульта. Лучше всего, если их будут проводить специалисты мультидисциплинарной бригады, в состав которой входят врач по медицинской реабилитации, врач и инструктор лечебной физической культуры, логопед, психолог/психотерапевт, эрготерапевт, физиотерапевт, медицинская сестра, а также социальный работник. Члены бригады используют различные методы физической реабилитации: лечебную гимнастику, лечение положением, массаж, рефлексотерапию, физиотерапию, мануальную терапию, психотерапию, эрготерапию и др. В последние годы в реабилитации активно применяются тренажеры различных конструкций (тредмил, вело- и гребные тренажеры и др.), столы-вертикализаторы, автоматизированные устройства для восстановления походки, экзоскелет нижних конечностей, многофункциональный «петлевой» комплекс для пулитерапии (блокотерапии), бассейны для физических упражнений в водной среде [5, 8–10].
Реабилитационные мероприятия должны разрабатываться индивидуально для каждого пациента с учетом выявляемых неврологических расстройств. Для их оценки и отслеживания последующей динамики на фоне проводимой реабилитации международное научное сообщество рекомендует пользоваться формализованными клиническими неврологическими шкалами: шкалой комы Глазго, шкалой тяжести инсульта Национального института здоровья США (National Institutes of Health Stroke Scale – NIHSS), шкалой оценки мышечной силы Комитета медицинских исследований, модифицированной шкалой Рэнкина, индексом мобильности Ривермид, модифицированной шкалой Ашфорта, визуальной аналоговой шкалой, шкалой баланса Берга, индексом ходьбы Хаузера, шкалой функциональной независимости, тестом для оценки функции руки Френчай и др. [3, 4].
К основным принципам и задачам реабилитационных мероприятий после инсульта относятся:
- ранняя мобилизация;
- профилактика развития контрактур, артропатий и пролежней;
- профилактика тромбоза глубоких вен;
- диагностика и коррекция дисфагии;
- нутритивная поддержка;
- формирование нормальных циркадианных ритмов;
- диагностика и коррекция постинсультных когнитивных нарушений;
- коррекция эмоционально-поведенческих расстройств, в том числе постинсультной депрессии;
- диагностика и терапия боли в плече, постинсультной центральной боли;
- профилактика падений вследствие постинсультной атаксии;
- профилактика постинсультного остеопороза;
- ранняя бытовая адаптация.
Ранняя активизация
К наиболее инвалидизирующим последствиям инсульта относятся двигательные нарушения в виде центральных параличей и парезов различной степени выраженности. Среди целей, которые преследует двигательная реабилитация в раннем восстановительном периоде, следует отметить активизацию больных, улучшение функции ходьбы, тренировку устойчивости вертикальной позы, повышение толерантности к физическим нагрузкам, овладение различными бытовыми навыками. Ранняя активизация позволяет избежать многих осложнений обездвиженности: тромбофлебитов, пролежней, гипостатической пневмонии [8, 10–13].
Коррекция спастичности
Особое внимание во время проведения реабилитационных мероприятий в раннем восстановительном периоде инсульта следует обращать на состояние мышечного тонуса. Спастичность в паретичных конечностях обычно нарастает в течение первых нескольких недель и месяцев с момента развития инсульта, что приводит к дальнейшему ухудшению двигательных функций, способствует развитию контрактур и деформации конечности и может сопровождаться болезненными мышечными спазмами. Важно отметить, что коррекция спастичности необходима только в тех случаях, когда она ухудшает двигательные функции пациента, приносит ему дискомфорт и затрудняет уход за ним. Для коррекции спастичности используют немедикаментозные методы (лечебную гимнастику, избирательный массаж, лечение положением, нервно-мышечную электростимуляцию, физиотерапевтические методы, направленные на профилактику образования контрактур) и лекарственную терапию миорелаксантами (тизанидином, толперизоном, баклофеном). При локальной спастичности наиболее эффективным методом лечения считается местное введение ботулинического токсина [8, 10–13].
Профилактика развития контрактур, артропатий и пролежней
Контрактуры возникают в паретичных конечностях у 60% пациентов в течение первого года после инсульта. Самая частая локализация – локтевые и запястные суставы. Для лечения и профилактики развития контрактур необходимы правильное позиционирование пациента, смена положения в постели, выполнение медленных пассивных движений в суставах пораженных конечностей посредством здоровой руки или с помощью родственников. Нужно выбирать такие положения конечностей, при которых пораженная сторона имела бы опору. Из медикаментозной терапии применяются локальные инъекции ботулинического токсина [8, 11, 12].
Одно из возможных осложнений центрального пареза – развитие артропатий, которые могут привести к образованию контрактур, значительному ограничению объема активных и пассивных движений из-за болезненности в области суставов. При артропатиях можно использовать теплолечение, вакуумный или турбулентный массаж, лечебную гимнастику [8, 10, 11, 13].
Лечение положением – специальная укладка больного, которая должна предупредить развитие мышечных контрактур и тугоподвижности в суставах, придать суставам и паретичным мышцам оптимальное положение. Данный метод применяется для профилактики развития патологических синкинезий и синергий, способствует более раннему восстановлению активных движений и улучшению периферического кровообращения, предотвращает образование пролежней и трофических язв [8, 10–13].
Для предупреждения развития пролежней необходимо регулярно менять положение больного. Важно ежедневно осматривать участки тела, потерявшие чувствительность, выявлять синяки, трещины, побелевшие или покрасневшие участки кожи. Особого внимания требуют места костных выступов: области ягодиц, крестец, грудной отдел позвоночника, лодыжки, колени, большой вертел бедренной кости, пятки, лопатки, локти, затылок, ушные раковины. Кроме того, каждый день нужно выполнять туалет всей поверхности кожи, использовать противопролежневые матрацы, массировать участки кожи, подверженные наибольшему давлению [10, 11].
Профилактика падений
Одно из частых осложнений раннего восстановительного периода инсульта – падения с переломами костей (чаще всего шейки бедра и костей таза). После падения у пациентов нередко развивается страх самостоятельного передвижения, что может снижать уровень физической активности и усиливать дезадаптацию. Именно поэтому необходимо тщательно наблюдать за больными с высоким риском падений. Не следует назначать им препараты, вызывающие сонливость, снижение концентрации внимания, слабость в паретичной ноге. Могут применяться специальные технические средства, такие как кресла-каталки, скобы, поручни, за которые пациент может держаться в палате, ванной комнате, коридоре и др. [8, 10].
Нутритивная поддержка и диагностика дисфагий
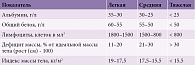
Крайне важно обеспечить адекватное питание пациентов, перенесших инсульт. По рекомендациям экспертов Национальной ассоциации по борьбе с инсультом, прежде всего следует выполнить количественную и качественную оценку сознания больного с помощью шкалы возбуждения и седации Ричмонда. Далее устанавливается нутритивный статус по шкале для определения риска развития нутриционной недостаточности. Если сумма баллов по данной шкале составляет 3 и более, то необходимо оценить состояние пациента по критериям питательной недостаточности с использованием лабораторных исследований, указанных в таблице [14, 15].
Нарушение глотания (дисфагия) – одно из наиболее опасных осложнений инсульта. Развитие дисфагии приводит к высокому риску аспирационной пневмонии, выступает в качестве предиктора плохого функционального восстановления и увеличивает риск внезапной смерти. У пациентов с острым нарушением мозгового кровообращения дисфагия развивается при поражении бульбарного отдела ствола или двустороннем поражении корково-ядерных путей. Кроме того, в первые дни и недели после инсульта дисфагия наблюдается приблизительно у 50% больных с полушарным инсультом. При обследовании пациентов с нарушением глотания необходимо определить конкретный патофизиологический механизм дисфагии и выработать индивидуальную стратегию питания [14, 15].
К признакам, свидетельствующим о высокой вероятности дисфагии, относятся:
- кашель до, во время или после глотания;
- изменение качества голоса во время или после глотания, например «влажный» или «булькающий» голос, хрипота, временная потеря голоса;
- затрудненное дыхание, прерывистое дыхание после глотания;
- затруднения при жевании;
- слюнотечение или неспособность сглатывать слюну;
- выпадение пищи изо рта во время еды (это может быть следствием того, что у больного плохо смыкаются губы или его язык давит вперед во время глотка вместо нормальных движений вверх и назад);
- срыгивание.
При подозрении на развитие дисфагии необходима консультация специалиста по глотанию [14, 15].
При выборе метода искусственного лечебного питания следует отдавать предпочтение более физиологичному энтеральному питанию. Парентеральное питание, даже полностью сбалансированное и удовлетворяющее потребности организма, не может предотвратить осложнения со стороны желудочно-кишечного тракта, поэтому должно быть хотя бы минимальное энтеральное питание в виде 200–300 мл/сут питательной смеси. Энтеральное питание может быть как пероральным, так и зондовым. Выбор метода нутритивной поддержки зависит от степени выраженности дисфагии и питательной недостаточности. Парентеральное (внутривенное) питание проводят начиная с пятых-шестых суток интенсивной терапии только при условии неадекватности энтерального питания в течение первых трех – пяти суток [14, 15].
Диагностика и коррекция постинсультных когнитивных нарушений
Не менее чем у 40–70% пациентов, перенесших инсульт, обнаруживаются когнитивные нарушения, которые в 6–32% случаев достигают степени деменции. В большинстве публикаций к постинсультным когнитивным нарушениям относят когнитивные расстройства, обнаруженные в первые три – шесть месяцев после перенесенного инсульта. Важность своевременной диагностики когнитивных нарушений связана с тем, что они значительно затрудняют ведение пациента в восстановительном периоде инсульта, снижают эффективность проводимых реабилитационных мероприятий и приверженность пациента к терапии.
Когнитивные нарушения могут быть вызваны не только перенесенным ишемическим инсультом, но и предшествующим асимптомным или малосимптомным сосудистым поражением белого вещества головного мозга или сопутствующим нейродегенеративным заболеванием (чаще всего болезнью Альцгеймера). Когнитивные нарушения могут достигать степени деменции при единичном инфаркте в стратегической для познавательной деятельности зоне головного мозга (угловой извилине, головке хвостатого ядра, таламусе, бледном шаре, гиппокампе, префронтальной лобной коре, стыке височно-теменно-затылочных долей головного мозга) [16, 17].
Для оценки когнитивных функций выполняется детальное нейропсихологическое исследование. К наиболее характерным симптомам сосудистых когнитивных нарушений и сосудистой деменции относятся нарушения внимания и управляющих функций (планирование, контроль). Пациентам с легкими и умеренными когнитивными нарушениями для улучшения памяти и других когнитивных функций рекомендуют проходить регулярные когнитивные тренинги, направленные на тренировку нарушенных функций и создание когнитивного резерва, а также принимать нейрометаболические и вазотропные препараты. При выраженных когнитивных нарушениях, достигающих степени деменции, применяются мемантин, ингибиторы ацетилхолинэстеразы (донепезил, галантамин, ривастигмин) и неконкурентный антагонист NMDA-рецепторов к глутамату мемантин [16, 17].
Важнейший вид постинсультных когнитивных нарушений – нарушения речи. Ведущее значение в реабилитации речевых расстройств имеет восстановительное обучение, которое проводит логопед-афазиолог или нейропсихолог. Положительный эффект от логопедических занятий наиболее заметен в ранние сроки после инсульта, поэтому занятия по восстановлению речи необходимо начинать в первые три недели. На амбулаторном этапе реабилитации занятия проводятся два-три раза в неделю по 45–60 минут. Помимо индивидуальных занятий с логопедом-афазиологом также эффективны групповые занятия (пациенты в группе должны быть с однотипными формами речевых расстройств и относительно одинаковой степенью их выраженности) и тренировки с помощью компьютерных программ [8, 18, 19].
Примерно в 30–40% случаев после инсульта развивается депрессия, которая также признана значимым фактором риска повторных инсультов, инфаркта миокарда и летального исхода в течение первых десяти лет после инсульта. Постинсультная депрессия может значительно снижать эффективность проводимых реабилитационных мероприятий. Показано, что эмоциональные нарушения наиболее часто развиваются в раннем восстановительном периоде инсульта. Для диагностики депрессии у пациентов, перенесших ишемический инсульт, можно использовать шкалу депрессии Бека, шкалу депрессии Гамильтона, шкалу самооценки депрессии Уэйкфилда, шкалу депрессии при афазии. Терапия постинсультной депрессии включает применение антидепрессантов. Более предпочтительны препараты без холинолитического эффекта, например селективные ингибиторы обратного захвата серотонина или ингибиторы обратного захвата серотонина и норадреналина. Помимо медикаментозной коррекции рекомендуется когнитивная психотерапия [20, 21].
Еще один распространенный вид поведенческих нарушений в постинсультном периоде – апатия, расстройство эмоционально-волевой сферы, проявляющееся в безразличии к себе и окружающему миру, отсутствии желаний и побуждений к деятельности. Апатия значительно затрудняет проведение реабилитационных мероприятий. Для коррекции апатии также назначаются препараты из группы антидепрессантов. Имеется позитивный опыт применения мемантина и ингибиторов ацетилхолинэстеразы, особенно у пациентов с когнитивными нарушениями. Используются также психотерапевтические методики [8].
Коррекция тазовых расстройств
По данным литературы, нарушения мочеиспускания через три – шесть месяцев после развития инсульта отмечаются у 25% пациентов, а через год – у 10–15%. Как правило, имеет место гиперактивный мочевой пузырь, который проявляется учащенным мочеиспусканием, императивными позывами, никтурией. Препаратами выбора для лечения гиперактивного мочевого пузыря являются антихолинергические средства (оксибутинин, толтеродин, троспия хлорид, солифенацин), которые снижают повышенную активность детрузора. Кроме того, возможно внутрипузырное применение препаратов ботулинического токсина под контролем цистоскопии. Немедикаментозные методы включают в себя обучение опорожнению мочевого пузыря до появления позыва на мочеиспускание. Полезно вести дневник с указанием объема введенной и выделенной жидкости. Разработаны также специальные упражнения для укрепления мышц тазового дна. При недержании мочи рекомендуется использовать прокладки и впитывающие трусы для взрослых [13].
Коррекция постинсультного болевого синдрома
Серьезное последствие инсульта – хронический болевой синдром, который только в части случаев непосредственно связан с поражением центральной нервной системы (центральные боли). Центральный болевой синдром у большинства больных развивается в среднем через три-четыре месяца после перенесенного инсульта. Медикаментозная терапия центральной боли включает назначение антиконвульсантов (габапентина, прегабалина), антидепрессантов (амитриптилина, ингибиторов обратного захвата серотонина и норадреналина) или опиоидных анальгетиков (трамадола). В случае недостаточной эффективности медикаментозного лечения используют физиотерапевтические методы (транскраниальную магнитную стимуляцию, транскраниальную электростимуляцию) [8, 10].
Однако в большинстве случаев причиной боли у пациентов, перенесших инсульт, является скелетно-мышечная дисфункция вследствие недостаточной физической активности и изменения двигательного стереотипа. Другая частая причина – плечелопаточная периартропатия (синдром «замороженного плеча») на пораженной стороне. Для профилактики данного осложнения важно придать правильное положение конечности и поддерживать объем движений в плечевом суставе. В качестве медикаментозной терапии назначаются антиконвульсанты. При выраженной гемиплегической боли и значительном ограничении диапазона движений также может быть рекомендовано хирургическое вмешательство [8, 10].
Нейрометаболическая поддержка реабилитационных мероприятий
Как уже было отмечено выше, восстановление неврологических функций после острого нарушения мозгового кровообращения обусловлено нейропластичностью. С целью стимулирования процессов нейрональной пластичности в восстановительном периоде ишемического инсульта целесообразно проведение нейрометаболической терапии для поддержания на оптимальном уровне внутриклеточного метаболизма, усиления синтеза и активности церебральных нейротрансмиттеров. В серии крупных рандомизированных исследований и широкой клинической практике в восстановительном периоде инсульта хорошо зарекомендовал себя нейрометаболический препарат Глиатилин.
Глиатилин (альфа-GPC, холина альфосцерат) представляет собой соединение, которое обладает центральным холиномиметическим действием и стабилизирует нейрональные мембраны. Холина альфосцерат, попадая в организм, расщепляется на метаболически защищенный холин и глицерофосфат. Благодаря быстрому повышению концентрации в плазме и электрической нейтральности холин, освобождаемый при распаде холина альфосцерата, проникает через гематоэнцефалический барьер и служит донором для синтеза нейротрансмиттера ацетилхолина в пресинаптических мембранах холинергических нейронов. Холина альфосцерат также оказывает дозозависимое стимулирующее действие на выделение ацетилхолина из пресинаптической щели, демонстрируя фармакологический эффект центрального холиномиметика. В результате происходит усиление холинергической активности за счет увеличения синтеза ацетилхолина и его высвобождения. Холиномиметическая активность холина альфосцерата у человека подтверждена его стимулирующим влиянием на секрецию гормона роста [22]. Активизация церебральной ацетилхолинергической системы имеет исключительное значение в раннем восстановительном периоде инсульта, поскольку способствует повышению эффективности восстановительного обучения речи и двигательной реабилитации, улучшает когнитивные функции и облегчает взаимодействие пациента с лечащим врачом и другим медицинским персоналом.
Кроме того, в процессе метаболизма холина альфосцерата высвобождается глицерофосфат, предшественник фосфатидилхолина – основного компонента нейрональных мембран. Глицерофосфат активизирует синтез фосфолипидов мембраны нейронов и тем самым повышает пластичность мембран и функцию рецепторного аппарата. На модели крыс со спонтанной артериальной гипертензией показана способность холина альфосцерата замедлять развитие астроглиоза и препятствовать разрушению фосфорилированных нейрофиламентов, предупреждая таким образом гибель нейронов [23, 24]. Кроме того, при экспериментальном ишемическом инсульте холина альфосцерат уменьшал зону инфаркта [25].
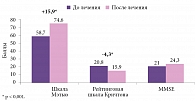
Высокая клиническая эффективность и хорошая переносимость Глиатилина были показаны в нескольких клинических исследованиях, наиболее крупное из которых провели S.G. Barbagallo и соавт. (1994). Авторы представили результаты наблюдения за 2058 пациентами с острым нарушением мозгового кровообращения (инсультом или транзиторной ишемической атакой). Лечение начиналось в течение десяти дней после инсульта или транзиторной ишемической атаки. Глиатилин назначался по схеме 1000 мг/сут внутримышечно или внутривенно в течение 28 дней, а далее в дозе 800 мг/сут перорально в течение пяти месяцев. Применение Глиатилина способствовало более быстрому регрессу неврологического дефицита, достоверному уменьшению функционального ограничения повседневной деятельности и улучшению когнитивных функций (рис. 2) [26].
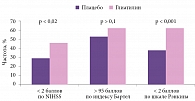
Особого внимания заслуживают результаты многоцентрового исследования эффективности Глиатилина у пациентов с острым ишемическим инсультом, проводившегося в 2006–2008 гг. в России. 122 пациента получали базисную терапию и Глиатилин в течение трех месяцев после инсульта. Глиатилин назначался по схеме: внутривенно капельно по 2000 мг/сут в течение 15 дней, затем внутримышечно по 1000 мг/сут в течение последующих 15 дней, далее внутрь по 800 мг/сут в течение 60 дней. На фоне проводимой терапии наблюдались достоверно более выраженный регресс неврологического дефицита по NIHSS и уменьшение степени инвалидизации по шкале Рэнкина по сравнению с показателями группы плацебо (рис. 3). Важно подчеркнуть, что отмеченное клиническое улучшение коррелировало с данными нейровизуализации: в группе пациентов, получавших Глиатилин, к 30-му дню зафиксирован достоверно больший регресс размеров инфаркта мозга [27].
В другом российском исследовании холина альфосцерат назначался в виде внутривенных инфузий 1000 мг/сут в течение 12 дней на первом, шестом и одиннадцатом месяцах после инсульта. Достаточное и полное восстановление неврологических функций и бытовой адаптации было достигнуто у 69,8% пациентов, в то время как в контрольной группе – только у 24,8% пациентов [28].
L. Parnetti и соавт. проанализировали результаты 13 клинических исследований холина альфосцерата, в том числе с использованием двойного слепого метода, в которых принимало участие в общей сложности 1570 пациентов с болезнью Альцгеймера или сосудистой деменцией [29]. На фоне лечения у больных достоверно улучшилось состояние когнитивных функций (памяти, внимания) и эмоциональное состояние (снижение раздражительности и эмоциональной лабильности), уменьшилась выраженность общей слабости и головокружения. Исследуемый препарат был безопасен и хорошо переносился пожилыми пациентами.
В настоящее время Глиатилин доступен не только в виде раствора для внутривенного введения и капсул, но и в форме раствора для приема внутрь (600 мг/7 мл). Питьевой раствор может иметь преимущество перед капсулами при постинсультной дисфагии, нарушениях глотания иной природы, а также у пациентов с выраженной деменцией. Показано, что прием питьевого раствора холина альфосцерата в течение трех месяцев в дозе 600 мг/7 мл два раза в день способствовал улучшению когнитивных функций при различных формах деменции, в том числе постинсультной (рис. 4) [30].
Заключение
У пациентов, перенесших ишемический инсульт, необходимо как можно раньше начинать активные реабилитационные мероприятия для минимизации постинсультного неврологического дефекта. Проводимая лекарственная терапия должна обеспечить нейрометаболическую поддержку нейрореабилитации и улучшение когнитивных функций. Использование комплексного подхода, включающего как медикаментозные, так и немедикаментозные методы, имеет наибольшие перспективы у пациентов, перенесших острые нарушения мозгового кровообращения.
D.O. Gromova, N.V. Vakhnina, PhD
I.M. Sechenov First Moscow State Medical University
Contact person: Natalya V. Vakhnina, nvakhnina71@mail.ru
The article describes the basic principles and objectives of post-stroke rehabilitation, which includes early activation of the patient, prevention of contractures and arthropathies, nutritional support and diagnosis of dysphagia, correction of motor disorders, post-stroke cognitive impairment, pelvic disorders, pain syndrome. In this connection, active rehabilitation measures should be started as early as possible to minimize post-stroke neurological defect. Neurometabolic support for neurorehabilitation should be provided by drug therapy. Noted that the use of an integrated approach, including both drug and non-drug methods, has the greatest prospects in patients who have suffered acute cerebral circulation disorders.
