Диабетическая тонковолоконная полинейропатия
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются клинические признаки диабетической тонковолоконной полинейропатии, обсуждаются трудности и возможные методы ее диагностики, а также вопросы лечения. Единственным препаратом для патогенетической терапии ДПН является альфа-липоевая кислота, эффективность которой была неоднократно подтверждена в клинических исследованиях.
В статье рассматриваются клинические признаки диабетической тонковолоконной полинейропатии, обсуждаются трудности и возможные методы ее диагностики, а также вопросы лечения. Единственным препаратом для патогенетической терапии ДПН является альфа-липоевая кислота, эффективность которой была неоднократно подтверждена в клинических исследованиях.
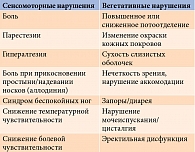

Введение
Сахарный диабет (СД) является одной из самых серьезных угроз для здоровья общемирового масштаба в XXI в.
По актуальным оценкам Международной диабетической федерации (International Diabetes Federation – IDF), в мире проживает не менее 425 млн человек, больных СД, – 8,8% взрослого населения в возрасте 20–79 лет. Из них две трети – люди трудоспособного возраста [1].
Общая численность пациентов с СД в РФ на 31 декабря 2017 г. составила 4 498 955 (3,06% населения РФ) [2].
Одним из наиболее распространенных осложнений СД является диабетическая полинейропатия (ДПН), которая встречается у 50% пациентов [3, 4]. Классически ДПН проявляется дистальной полинейропатией, дебютирует симметрично с нижних конечностей и по мере прогрессирования может распространяться на руки. Чувствительные нарушения, как правило, предшествуют двигательным расстройствам. Диагноз обычно устанавливается на основании характерных жалоб (онемение, боли, парестезии в дистальных отделах конечностей), данных осмотра (гип- или гиперестезия, снижение вибрационной и тактильной чувствительности, суставно-мышечного чувства, симметричное снижение сухожильных рефлексов), в ряде случаев используют дополнительные методы исследования. Электронейромиография (ЭНМГ) является стандартным инструментальным методом, используемым для подтверждения диагноза ДПН. Однако у ряда пациентов с четкими полиневритическими жалобами ЭНМГ не выявляет признаков повреждения двигательных и/или чувствительных нервов. Это объясняется изолированным поражением тонких нервных волокон, функцию которых невозможно оценить при помощи ЭНМГ [5].
Нейропатия тонких волокон
Периферические нервы содержат в своем составе 70–90% тонких волокон [6], отвечающих за восприятие температурных и болевых стимулов, а также регулирующих потоотделение и сосудистый тонус. Они представлены миелинизированными А-дельта- и немиелинизированными С-волокнами. Основной функцией А-дельта-волокон является восприятие холода и в меньшей степени боли. Немиелинизированные С-волокна входят в состав постганглионарных волокон вегетативной нервной системы, а также проводят возбуждение от тепловых и болевых рецепторов [7–9].
Клиническая картина
Повреждение тонких нервных волокон лежит в основе возникновения чувствительных и вегетативных симптомов (табл. 1). Наиболее распространенной жалобой пациентов является жжение в стопах. Болевые ощущения описываются пациентами как острые, жгучие, прокалывающие, зудящие, ноющие [10]. Как правило, боль локализуется в дистальных отделах конечностей, преимущественно ног (в стопах, подошвах), симметрично, возникает спонтанно и усиливается в покое, особенно в ночные часы, что приводит к нарушению сна [11]. Помимо спонтанной боли у ряда больных могут отмечаться гипералгезия и аллодиния, при которой любое прикосновение усиливает боли. Пациенты также могут жаловаться на зябкость в стопах, при этом объективно их ноги остаются теплыми на ощупь [12].
Кроме того, повреждение тонких нервных волокон приводит к вегетативно-трофическим нарушениям, что играет ключевую роль в возникновении диабетических язв [8]. Денервация потовых желез приводит к уменьшению потоотделения, в результате чего кожа становится сухой и формируются условия для возникновения трещин и нарушения целостности кожного покрова. В то же время из-за снижения болевой чувствительности увеличивается риск травматизации, так как пациент не замечает как неудобств при ношении обуви, так и образования ран и их последующего инфицирования [13].
Диагностика
Нейропатия тонких волокон часто является первым проявлением ДПН. При биопсии икроножного нерва у пациентов с начальными проявлениями ДПН было выявлено, что повреждение тонких волокон предшествует повреждению толстых, миелинизированных [6, 14]. Этот факт имеет крайне важное значение, поскольку ранняя диагностика ДПН позволяет начать своевременное патогенетическое лечение и предотвратить дальнейшее прогрессирование заболевания.
В рутинной практике даже при углубленном осмотре диагностика тонковолоконной полинейропатии зачастую вызывает затруднения, так как неврологический осмотр и ЭНМГ оказываются малоинформативными и не выявляют изменений. Тем не менее на сегодняшний день существуют различные методы, которые помогают подтвердить данный диагноз.
Удобным диагностическим инструментом являются опросники нейропатической боли. Лидская шкала оценки нейропатической боли (Leeds Assessment of Neuropathic Symptoms and Signs Pain Scale – LANSS), диагностический опросник нейропатической боли (Douleur Neuropathique en 4 questions – DN4), опросник Pain DETECТ обладают высокой диагностической ценностью. Важно, что эти шкалы переведены на русский язык и прошли лингвистическую валидацию с соблюдением всех требований [15, 16].
В большинстве случаев при наличии диабетической автономной нейропатии (ДАН) диагноз можно поставить на основании опроса и физикального обследования пациента, однако иногда применяют лабораторные и инструментальные методы. При кардиоваскулярной ДАН проводят холтеровское мониторирование ЭКГ (удлинение интервала QT, снижение вариабельности сердечного ритма), суточное мониторирование артериального давления (отсутствие снижения в ночные часы). Для подтверждения нарушения моторики желудочно-кишечного тракта при гастроинтестинальной форме ДАН могут быть использованы рентгеноконтрастные методы исследования желудка и кишечника с использованием бария, эндоскопические методы, радиоизотопная сцинтиграфия желудка и др. В случае урогенитальной ДАН используют ультразвуковое исследование мочевого пузыря, цистографию, цистоскопию. При эректильной дисфункции можно проводить мониторинг эрекций во время ночного сна, исследование вызванных кожных симпатических потенциалов с поверхности полового члена [17].
Количественное сенсорное тестирование – безболезненный психофизический метод, использующийся для определения порогов температурной, болевой и вибрационной чувствительности. Результаты исследования зависят от психоэмоционального состояния пациента, его способности правильно понимать и выполнять инструкции, а также от ряда температурных и технических условий. По данным различных исследований, чувствительность метода колеблется от 36 до 85% [18–21]. В связи с этим, согласно рекомендациям Группы специального интереса по нейропатической боли от 2013 г., при подозрении на тонковолоконную полинейропатию количественное сенсорное тестирование следует использовать в совокупности с другими методами исследования [22].
К патоморфологическим методам относится биопсия икроножного нерва и панч-биопсия кожи. Пункционная биопсия кожи с количественной оценкой плотности интраэпидермальных нервных волокон является золотым стандартом в диагностике повреждения тонких немиелинизированных волокон [23]. Обнаружено, что плотность интраэпидермальных нервных волокон значимо снижается у пациентов именно с болевой формой ДПН [24, 25]. Однако с учетом того, что патоморфологические методы являются инвазивными, сопряжены с определенными рисками осложнений, а также требуют соответствующего технического оснащения, их использование в ежедневной клинической практике ограниченно.
Конфокальная микроскопия роговицы – новый неинвазивный метод, позволяющий получать качественные изображения суббазального нервного сплетения передней пограничной мембраны роговицы и оценивать плотность и длину нервных волокон на 1 мм2. В связи с тем что в роговице содержится большое число А-дельта- и С-волокон, данный метод используется для оценки повреждения тонких нервных волокон, а также для отслеживания эффективности лечения [26]. Cнижение плотности нервных волокон в роговице коррелирует со снижением плотности интраэпидермальных нервных волокон и со степенью тяжести ДПН [27]. Метод конфокальной микроскопии роговицы обладает высокой диагностической значимостью, сопоставимой с оценкой плотности интраэпидермальных нервных волокон [28].
Диагностические градации тонковолоконной полинейропатии представлены в табл. 2 [4].
Патогенез и патогенетические подходы к терапии ДПН
Выделяют три основных процесса, приводящих к развитию ДПН: воспаление, окислительный стресс и митохондриальную дисфункцию. Воспалительные механизмы запускают активацию нуклеарного фактора каппа В, белка-активатора 1, митоген-активируемой протеинкиназы. Окислительный стресс, возникающий из-за гипергликемии, формируется за счет ускорения полиолового и гексозаминового путей окисления, активации протеинкиназы C и избыточного образования конечных продуктов гликирования. Митохондриальная дисфункция в свою очередь вносит наибольший вклад в образование свободных форм кислорода и азота. Формирующиеся в результате этих процессов свободные радикалы вызывают перекисное окисление липидов, модификацию белков, повреждение нуклеиновой кислоты и в конечном итоге приводят к аксональной дегенерации и сегментарной демиелинизации нервных волокон [29].
Основой профилактики и лечения ДПН является достижение и поддержание индивидуальных целевых показателей углеводного обмена [30]. Исследование DCCT, включавшее 1441 пациента с СД 1 типа, показало, что адекватный гликемический контроль приводил к уменьшению частоты развития новых случаев полинейропатии, а у пациентов с недавно выявленной полинейропатией – к регрессу клинических симптомов [31]. При дальнейшем наблюдении за указанной когортой пациентов были получены аналогичные данные [32]. В отношении пациентов с СД 2 типа и прогнозом развития ДПН выводы неоднозначны. Результаты одних исследований поддерживают гипотезу о том, что контроль гликемии предупреждает развитие ДПН, другие исследования говорят о несостоятельности этой гипотезы [33].
Ранее было показано, что достижение целевого уровня гликированного гемоглобина не позволяет нормализовать оксидантный статус у пациентов с сахарным диабетом 2 типа [34]. Все это определяет обоснованность включения в комплекс терапевтических мер препаратов, оказывающих патогенетическое действие в отношении лечения ДПН. В первую очередь используются препараты с антиоксидантным эффектом.
Альфа-липоевая кислота
На сегодняшний день среди антиоксидантов наибольшая доказательная база собрана в отношении альфа-липоевой кислоты (АЛК). АЛК является коферментом митохондриальных мультиферментных комплексов и участвует в окислительном декарбоксилировании пировиноградной кислоты и альфа-кетокислот. АЛК может существовать в окисленной и восстановленной формах, благодаря чему реализуются ее коферментные и антиоксидантные функции [35].
Первое рандомизированное исследование ALADIN, посвященное изучению эффективности АЛК у пациентов с ДПН, проводилось в Германии в 1995 г. Согласно полученным результатам, внутривенное введение АЛК на протяжении трех недель в суточной дозе 600–1200 мг приводило к снижению выраженности симптомов ДПН, однако доза 600 мг/сут признана наиболее оптимальной в связи с меньшей частотой нежелательных явлений [36]. Результаты дальнейших исследований [37–39] с последующим метаанализом [40] подтвердили безопасность и эффективность внутривенной терапии АЛК в дозе 600 мг/сут в отношении позитивной и негативной симптоматики ДПН.
Оценка эффективности перорального приема АЛК проводилась в исследовании ORPIL, включавшем 24 пациента с ДПН, разделенных поровну на две группы. Первая группа пациентов (n = 12) в течение трех недель получала внутрь АЛК в дозе 600 мг три раза в день, вторая группа пациентов (n = 12) – плацебо. По результатам исследования, статистически значимый эффект в виде уменьшения признаков нейропатии по шкале общей оценки симптомов (Total Symptom Score – TSS) наблюдался в группе активой терапии [41]. По данным рандомизированного контролируемого мультицентрового исследования DEKAN, включавшего 73 пациента с автономной кардиоваскулярной нейропатией, пероральный прием АЛК в дозе 800 мг/сут в течение четырех месяцев приводил к достоверному увеличению вариабельности сердечного ритма [42].
Изучение эффективности различных суточных доз АЛК проводилось в исследовании SYDNEY 2, в котором принял участие 181 пациент, каждый из которых получал АЛК внутрь в дозе 600/1200/1800 мг/сут или плацебо на протяжении пяти недель. Статистически значимый эффект был достигнут во всех группах активной терапии. В связи с тем что такие нежелательные явления, как тошнота, рвота и головокружение, носили дозозависимый характер, доза 600 мг/сут была признана оптимальной [43]. Крайне важными являются результаты исследования NATHAN 1, свидетельствующие о возможности замедления прогрессирования ДПН при длительном пероральном приеме АЛК [44].
В связи с наличием столь масштабной доказательной базы АЛК признана единственным препаратом для патогенетического лечения ДПН [4]. Возможность применения АЛК при ДПН подтверждена экспертами IDF [45].
Согласно результатам систематического обзора, опубликованного в 2012 г., внутривенная терапия АЛК в дозе 600 мг/сут на протяжении трех недель значимо уменьшает интенсивность нейропатического болевого синдрома [46], что позволяет рекомендовать использование АЛК в виде монотерапии при интенсивности боли до трех баллов по визуальной аналоговой шкале (ВАШ) [47]. Если нейропатический болевой синдром выраженный (более четырех баллов по ВАШ), рекомендуется комбинировать АЛК с антиконвульсантами (габапентином, прегабалином), антидепрессантами (амитриптилином, дулоксетином, венлафаксином) и/или меcтными анестетиками [47].
Опыт применения
Ниже представлены собственные клинические наблюдения, в которых использование АЛК привело к положительным результатам.
Клинический случай 1. Пациент В., 60 лет, обратился с жалобами на выраженное снижение чувствительности в ногах до уровня колен, периодическое покалывание и жжение в них, особенно в ночное время. Известно, что в течение десяти лет больной страдает СД 2 типа, получает комбинированную пероральную сахароснижающую терапию, на фоне которой уровень глюкозы натощак составил 6,7 ммоль/л, гликированного гемоглобина – 6,8%. В течение последнего года отметил появление парестезий и чувства жжения в стопах. Несколько позже, во время занятий в тренажерном зале, пациент случайно уронил на правую стопу гантель, однако боли при этом не ощутил, что его, конечно, удивило, насторожило и заставило обратиться к врачу.
На момент осмотра в неврологическом статусе выявляется болевая гипестезия до уровня нижней трети голени, снижение ахилловых рефлексов. Интенсивность болевых ощущений в стопах не превышала одного-двух баллов по ВАШ. При выполнении ЭНМГ признаков нарушения функции чувствительных и двигательных нервов нижних конечностей выявлено не было.
На основании характерных жалоб, данных осмотра и отсутствия изменений по ЭНМГ пациенту был установлен диагноз вероятной тонковолоконной ДПН. С учетом наличия хорошей компенсации углеводного обмена и отсутствия выраженного болевого синдрома пациенту был рекомендован длительный (не менее трех месяцев) прием АЛК внутрь в суточной дозе 600 мг с целью замедления прогрессирования ДПН. Ввиду наличия выраженного нарушения болевой чувствительности, с пациентом была проведена беседа о необходимости проведения регулярных осмотров кожных покровов нижних конечностей, даны рекомендации по уходу за ногами.
Клинический случай 2. Больная Ж., 65 лет, обратилась с жалобами на интенсивные жгучие боли и онемение в стопах, бессонницу, общую слабость и плаксивость, учащенное мочеиспускание. В анамнезе – СД 2 типа с 2001 г., получала пероральную терапию, в 2010 г. переведена на инсулинотерапию. Сопутствующие заболевания – артериальная гипертензия третьей степени, второй стадии, риск сердечно-сосудистых осложнений четвертой степени.
При осмотре пациентки обнаружен парез разгибателей стопы до 3,5 балла, снижение коленных и ахилловых сухожильных рефлексов, снижение болевой чувствительности до уровня нижней трети голени в сочетании с аллодинией, снижение вибрационной (до трех-четырех баллов) и температурной чувствительности. Интенсивность болевых ощущений в стопах достигала семи-восьми баллов по ВАШ. Кроме того, в неврологическом статусе отмечено наличие рефлексов орального автоматизма, легкой постуральной неустойчивости, тазовых нарушений в виде учащенного мочеиспускания в ночное время, которое не было обусловлено гипергликемией.
Проведено дообследование: в биохимическом анализе крови показатели гликемии и гликированного гемоглобина находились в целевом диапазоне. При ЭНМГ выявлены признаки сенсомоторного аксонального поражения длинных нервов нижних конечностей. При магнитно-резонансной томографии головного мозга в больших полушариях выявлены мелкие очаговые изменения сосудистого генеза. При ультразвуковом исследовании брахиоцефальных артерий головного мозга – проявления атеросклероза в виде гемодинамически незначимых атеросклеротических бляшек.
На основании обследований, учитывая клинико-анамнестические данные, были диагностированы сенсомоторная аксональная ДПН, дисциркуляторная энцефалопатия, артериальная гипертензия, атеросклероз.
В данном случае в рамках ДПН у пациентки имело место поражение как толстых, так и тонких волокон периферических нервов.
С целью уменьшения симптомов ДПН на фоне тщательного контроля гликемического профиля проводилось внутривенное введение АЛК 600 мг/сут в течение 14 дней с последующим переводом на пероральный прием препарата в той же дозе. С учетом выраженности нейропатического болевого синдрома, а также наличия астено-невротической симптоматики и тазовых нарушений было принято решение о дополнительном назначении антидепрессанта (амитриптилина). На фоне комбинированного лечения было отмечено убедительное снижение болевого синдрома с восьми до трех баллов по ВАШ, улучшение настроения, сна и нормализация мочеиспускания.
Представленные клинические случаи демонстрируют возможности применения антиоксидантной терапии АЛК в различных клинических ситуациях, в том числе у коморбидных у пациентов с ДПН.
Заключение
Сахарный диабет является самой частой причиной тонковолоконной полинейропатии, приводя к возникновению нейропатического болевого синдрома и таким образом существенно снижая качество жизни пациентов. Тонкие волокна повреждаются на самых ранних стадиях ДПН. Однако из-за отсутствия изменений при проведении ЭНМГ (наиболее используемый в рутинной практике метод диагностики полинейропатии) жалобы пациентов нередко неправильно интерпретируются. Это приводит к поздней диагностике и несвоевременному лечению.
В то же время диагностика ДПН на ранних стадиях позволяет вовремя провести патогенетическую терапию препаратами АЛК. Их применение способно уменьшить выраженность основных симптомов и, что особенно важно, замедлить прогрессирование поражения периферических нервов.
D.A. Semikova, N.V. Belova, D.A. Grishina, K.V. Antonova, N.A. Suponeva
Research Center of Neurology
Contact person: Darya Andreyevna Semikova, dariagr@yandex.ru
Diabetic polyneuropathy is one of the most common complications of diabetes mellitus. In diabetic polyneuropathy nerve fibers of different thickness including small ones are damaged that results in debilitating neuropathic pain syndrome. The article presents clinical manifestations of diabetic small fiber neuropathy and discusses challenges and possible diagnostic methods as well as treatment aspects. Alpha-lipoic acid is the only available pathogenic treatment of diabetic polyneuropathy. Its effectiveness was proved in numerous clinical studies.
