Эффективное лечение ожирения – путь борьбы с эпидемией Diabetus mellipidus. Отчет национального координатора Всероссийской наблюдательной программы «Весна»
- Аннотация
- Статья
- Ссылки

Введение
Распространенность избыточной массы тела и ожирения неуклонно растет – в настоящее время с этой проблемой сталкиваются не только в высокоразвитых странах, но и в странах со средним и даже низким уровнем дохода на душу населения [1, 2]. По данным Всемирной организации здравоохранения (ВОЗ), в 2008 г. более 1,7 млрд взрослого населения в возрасте двадцати лет и старше страдали от избыточного веса, из них свыше 500 млн имели ожирение [3]. В 2010 г. более 40 млн детей в возрасте до 5 лет страдали от избыточного веса. К 2025 г., по прогнозам экспертов ВОЗ, количество лиц с ожирением увеличится практически в два раза [3]. Высокие темпы роста и широкая распространенность данного заболевания позволили назвать ожирение новой «неинфекционной эпидемией». В России уже сейчас распространенность избыточной массы тела / ожирения составляет 46,5% среди мужчин и 51,7% среди женщин [4]. Эта цифра неуклонно растет, и сегодня по распространенности ожирения мы приближаемся к лидерам печального рейтинга, в частности к США.
Стремительное распространение ожирения способствует нарастанию заболеваемости сахарным диабетом 2 типа. По данным экспертов Международной диабетической федерации (International Diabetes Federation, IDF), в 2011 г. сахарным диабетом 2 типа страдали 366 млн человек, 4,6 млн умерли от связанных с ним заболеваний, 465 млрд долларов затрачено на здравоохранение в этой сфере [5]. По различным данным, 80–85% больных сахарным диабетом имеют ожирение [6]. В нескольких исследованиях было показано, что взаимосвязь между ожирением и инсулиннезависимым сахарным диабетом более выражена у людей с абдоминальным и висцеральным ожирением, чем у людей с периферическим ожирением [4].
Нарушения углеводного и жирового обмена изучаются в течение многих десятилетий, однако только в последние годы ученые приблизились к пониманию взаимосвязи между ожирением и сахарным диабетом. Патогенетической основой может являться механизм липотоксичности [4]. Впервые этот термин предложил R. Unger в 2002 г. для описания токсичных эффектов свободных жирных кислот (СЖК) в тканях, участвующих в метаболизме глюкозы [7]. В исследованиях in vitro хроническое повышение СЖК (преимущественно пальмитиновой, линоленовой и стеариновой кислот) приводило к ингибированию глюкозостимулированной секреции инсулина, потере чувствительности бета-клеток и последующему их апоптозу, а также развитию инсулинорезистентности в печени и мышцах.
В настоящее время предполагается, что избыточное накопление СЖК в нежировых тканях является основной причиной развития метаболического синдрома. В условиях повышенного поступления в организм пищи, насыщенной жирами и углеводами, стимулируется секреция инсулина, который, в свою очередь, активирует липогенез и отложение СЖК в жировой ткани. Однако у способности накапливать липиды существует генетически детерминированный предел, и когда объем жировой ткани достигает максимума, избыток СЖК начинает поступать в печень и мышцы, запуская различные патогенетические механизмы. Инсулинорезистентность, обычно рассматриваемая в качестве этиологического фактора нарушений углеводного обмена, может являться вторичным компенсаторным изменением в органах и тканях, необходимым для ограничения поступления энергетического субстрата в клетку, насыщенную СЖК. В данной модели развития событий липотоксичность выступает центральным механизмом, запускающим нарушение углеводного и жирового обмена.
Под воздействием СЖК в жировой ткани образуются более крупные адипоциты, резистентные к действию инсулина, инициируется процесс местного воспаления, увеличивается секреция провоспалительных цитокинов, что способствует развитию нечувствительных жировых клеток. У лиц с ожирением адипоциты секретируют относительно большое количество фактора некроза опухоли альфа. Показано, что фактор некроза опухоли альфа нарушает передачу сигнала инсулина в мышечной и жировой ткани и тем самым может способствовать развитию инсулинорезистентности.
При изучении влияния СЖК на бета-клетку поджелудочной железы было выявлено несколько патологических механизмов. Так, воздействие высокого уровня СЖК на культуру бета-клеток и изолированные островки приводит к потере первой фазы глюкозостимулированной секреции инсулина, ингибированию экспрессии гена инсулина, ускорению апоптоза в бета-клетках, повышению синтеза церамидов и активации окислительного стресса. Таким образом, влияние СЖК на поджелудочную железу, вероятно, является одним из основных факторов нарастающего снижения массы бета-клеток и прогрессии сахарного диабета 2 типа.
Свободные жирные кислоты блокируют ингибирующий эффект инсулина на глюконеогенез в печени, что сопровождается увеличением продукции глюкозы и развитием гипергликемии. Кроме того, повышение уровня СЖК замедляет метаболизм инсулина в печени, что способствует развитию гиперинсулинемии. Повышение в плазме СЖК вызывает иснулинорезистентность в печени путем ингибирования трансдукции сигнала инсулина. У пациентов с сахарным диабетом 2 типа увеличение концентрации в плазме СЖК сопровождается повышением плазменного уровня глюкагона и чувствительности печени к активации гликогенолиза. Дополнительным негативным эффектом СЖК в печени является активация апоптоза гепатоцитов, что способствует развитию стеатогепатоза. Гибель гепатоцитов и насыщение печени липидами лежат в основе развития инсулинорезистентности, а нарушение механизмов глюконеогенеза и гликогенолиза способствует развитию гипергликемии.
Предположительно, кроме воздействия на печень СЖК ингибируют сигналы инсулина в мышечной ткани. Повышенные концентрации СЖК могут вызвать резистентность к инсулину в мышцах с помощью нескольких механизмов, связанных с изменениями в различных внутриклеточных сигнальных молекулах, которые оказывают ингибирующее действие на систему сигнализации инсулина, транспорт глюкозы, фосфорилирование глюкозы и гликогенсинтазы.
Свободные жирные кислоты оказывают токсичное влияние на основные органы и ткани, вовлеченные в нарушение углеводного обмена, вызывая развитие и прогрессирование инсулинорезистентности и дисфункции бета-клеток. У большинства пациентов с ожирением механизм липотоксичности включается уже с ранних этапов развития заболевания и играет важную роль в патогенезе нарушения углеводного обмена.
Подчеркивая ключевую роль висцерального ожирения и липотоксичности в развитии сахарного диабета 2 типа, представляется целесообразным использовать термин Diabetes mellipidus. Для предотвращения распространения этой неинфекционной эпидемии требуются разработка и внедрение общенациональных программ по снижению и контролю массы тела. Этим целям как нельзя более полно отвечает формат Всероссийской наблюдательной программы «Весна».
Многоцентровая фармакоэпидемиологическая программа «Весна» проходила в условиях повседневной отечественной медицинской практики лечения ожирения, то есть применялись только рутинные методы обследования пациентов. Препарат Редуксин® назначался только в соответствии с инструкцией.
Материалы и методы
В программе приняли участие 1520 врачей различных специальностей: эндокринологи, терапевты, гастроэнтерологи, гинекологи, неврологи и кардиологи из 52 городов России – от южных регионов до Сибири.
В программе «Весна» были поставлены следующие цели: мониторинг безопасности шестимесячного применения препарата Редуксин® в рутинной клинической практике, а также оценка влияния шестимесячной терапии Редуксином на состояние здоровья и качество жизни пациентов, получавших препарат в ходе первичных и повторных курсов медикаментозной терапии алиментарного ожирения.
В наблюдательную программу были включены мужчины и женщины в возрасте от 18 до 60 лет с диагнозом «алиментарное ожирение», как принимавшие, так и не принимавшие ранее сибутрамин. Некоторые из них ранее получали другие виды терапии по поводу ожирения или принимали процедуры, направленные на снижение веса. Требовалось получение письменного информированного согласия пациента на предоставление персональных данных.
В программу не включались пациенты, имевшие противопоказания и ограничения к применению Редуксина согласно инструкции по медицинскому применению препарата; пациенты, принимавшие участие в других клинических исследованиях лекарственных препаратов за 30 дней до включения в программу «Весна»; пациенты, не способные выполнять рутинные визиты к врачу в течение 6 месяцев; пациенты, принимавшие препараты, содержащие сибутрамин, более 6 месяцев перед включением в программу; пациенты с плохой переносимостью сибутрамина в суточной дозе 10 мг или принимавшие более 15 мг сибутрамина в сутки в анамнезе.
Эффективность препарата Редуксин® оценивалась по динамике индекса массы тела (ИМТ), антропометрических показателей (масса тела; окружность талии) и пищевого поведения.
Препарат применялся согласно инструкции по медицинскому применению в суточной дозе 10–15 мг.
Для контроля безопасности препарата Редуксин® и влияния на сердечно-сосудистую систему регулярно измерялись артериальное давление и частота сердечных сокращений. Проводилась оценка лабораторных показателей в динамике (липидограмма плазмы крови; уровень глюкозы в плазме крови; общий билирубин, общий белок, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ)), регистрировались частота возникновения и тип нежелательных явлений, а также проводилась оценка качества жизни и субъективного самочувствия пациентов.
В программу «Весна» планировалось включение более 10 000 пациентов, набор пациентов проводился в течение года. Планируемая длительность лечения Редуксином – 6 месяцев у каждого пациента.
При статистической обработке полученных данных использовались следующие методы: для показателей эффективности и безопасности статистическая значимость изменений тестировалась с помощью непараметрического подхода – критерия знаковых рангов Уилкоксона. Для оценки относительных изменений лабораторных показателей применялся параметрический подход – одновыборочный критерий Стьюдента. Вероятность ошибки первого рода (двусторонний уровень значимости) устанавливался на уровне 5% для всех сравнений. Все данные представлены как среднее арифметическое ± стандартное отклонение.
Результаты и их обсуждение
Итоговое количество и исходные характеристики пациентов
За год в программу «Весна» было включено 34 719 пациентов из 52 городов России. Наибольшее количество пациентов – 43% – проживают в Москве и Московской области.
Статистической обработке подлежало 32 828 анкет пациентов. Исследуемая популяция включала 56,9% (18 679) женщин и 43,1% (14 149) мужчин. Средний возраст пациентов составил 40,17 ± 11,4 года.
Исходные характеристики популяции наблюдения: ИМТ 34,60 ± 4,76 кг/м2 (25,00–64,81 кг/м2), масса тела 95,79 ± 14,88 кг (60,00–210,00 кг), окружность талии 103,83 ± 14,43 см (60,00–190,00 см).
28,6% пациентов, принимавших участие в программе, имели сопутствующие заболевания: контролируемую артериальную гипертензию – 8,6%, другие сердечно-сосудистые заболевания – 1,1%, сахарный диабет – 11,4%, у 6,1% пациентов были выявлены сопутствующие заболевания желудочно-кишечного тракта. У 71,4% пациентов не было зарегистрировано сопутствующих заболеваний.
Приверженность наблюдению и лечению по программе «Весна» составила 90,7% из числа всех пациентов. Общая длительность приема препарата Редуксин® для одного пациента составляла около 6 месяцев.
Динамика ИМТ, окружности талии, массы тела, пищевого поведения
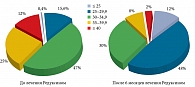
До начала лечения преобладала группа с ИМТ 30–34,9 кг/м2 (47,0%), после шести месяцев терапии препаратом Редуксин® наиболее многочисленной стала группа с ИМТ 25–29,9 кг/м2 (48%). Таким образом, «Весна» позволила снять диагноз «ожирение» у 15 276 больных (44% наблюдаемых пациентов), 2 784 больным (11,6% наблюдаемых пациентов) позволила достичь своего идеального веса, 16 659 больным (44% наблюдаемых пациентов) – добиться целевого снижения веса на 10–14% (рис. 1).
После шестимесячной терапии уменьшение окружности талии составило 10,4%, уменьшение массы тела – 14,3%, что в абсолютных цифрах составило 10,87 см и 13,7 кг соответственно. Эти данные можно интерпретировать как свидетельство снижения количества висцерального жира, а следовательно, выраженности инсулинорезистентности и гиперинсулинемии.
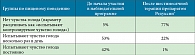
Все наблюдающиеся у врача в течение программы пациенты были условно разделены на группы по пищевому поведению. В ходе исследования зарегистрировано значительное изменение численности каждой группы (таблица).
Динамика изменения дозы препарата Редуксин®
Во время проведения наблюдательной программы для 89,7% наблюдавшихся пациентов начальной дозой стала доза 10 мг. Количество пациентов, нуждавшихся в ходе шестимесячной терапии в повышении дозы с 10 до 15 мг, составило 71,4% (21 269).
Начальная доза 15 мг была использована для применения у 2533 (7,7%) пациентов. Количество пациентов, у которых доза была понижена с 15 до 10 мг, составило 3% (920).
Количество пациентов, у которых подобранная изначально доза не нуждалась в последующей коррекции, составило 6643 (22,3%) человека.
Оценка влияния на лабораторные показатели
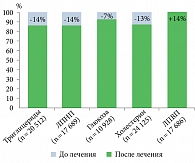
Имелось благоприятное изменение показателей липидограммы, увеличение антиатерогенных липопротеидов (липопротеидов высокой плотности, ЛПВП) на 14%, снижение триглицеридов на 14% и липопротеидов низкой плотности (ЛПНП) и общего холестерина на 13% (рис. 2).
Безопасность Редуксина
При оценке динамики показателей сердечно-сосудистой деятельности (артериальное давление и частота сердечных сокращений) было зарегистрировано снижение систолического артериального давления (САД) в среднем на 3,78 мм рт. ст., снижение диастолического артериального давления (ДАД) в среднем на 2,75 мм рт. ст., снижение частоты сердечных сокращений составило в среднем 3 удара в минуту.
Общее количество пациентов, имевших нежелательные явления, составило 921 человек (2,8%). Серьезных нежелательных явлений выявлено не было. 29% нежелательных явлений составили прочие единичные нежелательные явления, расцененные врачом как не связанные с приемом препарата Редуксин®. Среди более частых нежелательных явлений были жалобы на сухость во рту – у 10% пациентов, запоры – у 9%, головная боль – у 9%, нарушения сна – у 8% (рис. 3). Как правило, эти явления были выражены в слабой степени и уменьшались по мере продолжения приема препарата. У подавляющего большинства больных не потребовалось отмены препарата из-за нежелательных явлений.
Досрочно завершили участие в программе 281 пациент по различным причинам: из-за нежелательных явлений – 0,83%, недостаточной эффективности – 0,21%, отказа от лечения по другим причинам, например из-за высокой стоимости препарата, – 0,02%, планируемой беременности – 0,08%.
Выводы
Программа «Весна» позволила 48% пациентов избавиться от диагноза «ожирение».
Программа «Весна» продемонстрировала положительное влияние шестимесячной терапии препаратом Редуксин® на основные параметры липидного обмена и гликемического контроля.
Шестимесячный контроль потребления пищи при приеме Редуксина позволил пациентам выработать правильные привычки питания и снизить калорийность суточного рациона.
Программа «Весна» подтвердила благоприятный профиль безопасности Редуксина – частота возникновения нежелательных явлений составила 2,8%.
Заключение
Наблюдательная программа «Весна» во многом содействовала внедрению практики рациональной терапии лекарственными препаратами, содержащими сибутрамин, в России. Контроль обоснованности назначения препарата врачами, необходимость систематической оценки состояния пациента в процессе лечения способствовали профилактике целого ряда осложнений фармакотерапии ожирения (злоупотребление препаратом, необоснованное назначение и др.). Программа стала первым серьезным шагом по управлению и профилактике рисков применения лекарственных препаратов для лечения ожирения и избыточной массы тела. Обучение и постоянный контакт со специалистами здравоохранения, активный мониторинг безопасности, пострегистрационные исследования являются неотъемлемыми требованиями вывода на рынок новых лекарственных средств в США и Европе.
В текущем году компания «Промо-Мед» продолжила практику наблюдательных программ и совместно с ФГБУ «Эндокринологический научный центр» Минздрава России начала широкомасштабную Всероссийскую наблюдательную неинтервенционную программу мониторинга безопасности применения препарата Редуксин® (сибутрамин + МКЦ) для снижения веса при терапии больных с алиментарным ожирением в клинической практике («ПримаВера»). Цель программы – мониторинг эффективности и безопасности терапии препаратом Редуксин®, а также содействие внедрению рациональных подходов к терапии ожирения. Таким образом, создается прекрасная практика преемственности, или эстафетности, в проведении программ по профилактике и управлению рисками терапии препаратами сибутрамина. Важным компонентом программы «ПримаВера» является образовательный модуль, нацеленный на формирование навыков обоснованного назначения лекарственных препаратов для лечения ожирения, а также эффективного контроля состояния пациентов, получающих данную терапию. Проведение подобных программ с последующим распространением практики лечения ожирения позволит не только улучшить качество жизни больных с избыточным весом, но и предотвратить надвигающуюся на Российскую Федерацию эпидемию Diabetus mellitus.
