Энтеропатия с нарушением мембранного пищеварения
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. У 20 практически здоровых лиц и 102 пациентов с клиническими симптомами ФЗК, соответствовавшими Римскому консенсусу – IV (2016 г.), изучали активность глюкоамилазы, мальтазы, сахаразы и лактазы в слизистой оболочке тонкой кишки (СОТК), полученной из дистального отдела двенадцатиперстной кишки во время эзофагогастродуоденоскопии. Применяли методику Далквиста в модификации Триндера.
Результаты. Нормальная активность ферментов отмечалась у 11 (10,8%) больных. У 33 (32,3%) пациентов наблюдалась сниженная активность всех дисахаридаз, у 58 (56,9 %) – одного – трех ферментов. У них установлена ЭНМП. Для лечения ЭНМП применяли низкоуглеводную диету FODMAP, кишечные антисептики, регуляторы моторики и пробиотики. В отдельную группу были выделены больные, получавшие энтеропротектор Ребамипид 300 мг/сут в течение 12 недель. Данные повторных исследований активности дисахаридаз показали ее повышение в СОТК на 30–60% у пациентов, применявших ребамипид.
Заключение. Частота выявления ЭНМП у больных с симптомами ФЗК составила 89,2%. Диета FODMAP, кишечные антисептики, регуляторы моторики и пробиотики способствовали уменьшению клинических симптомов, связанных с употреблением углеводов. Первый опыт применения ребамипида продемонстрировал способность препарата повышать активность дисахаридаз в СОТК.
Материал и методы. У 20 практически здоровых лиц и 102 пациентов с клиническими симптомами ФЗК, соответствовавшими Римскому консенсусу – IV (2016 г.), изучали активность глюкоамилазы, мальтазы, сахаразы и лактазы в слизистой оболочке тонкой кишки (СОТК), полученной из дистального отдела двенадцатиперстной кишки во время эзофагогастродуоденоскопии. Применяли методику Далквиста в модификации Триндера.
Результаты. Нормальная активность ферментов отмечалась у 11 (10,8%) больных. У 33 (32,3%) пациентов наблюдалась сниженная активность всех дисахаридаз, у 58 (56,9 %) – одного – трех ферментов. У них установлена ЭНМП. Для лечения ЭНМП применяли низкоуглеводную диету FODMAP, кишечные антисептики, регуляторы моторики и пробиотики. В отдельную группу были выделены больные, получавшие энтеропротектор Ребамипид 300 мг/сут в течение 12 недель. Данные повторных исследований активности дисахаридаз показали ее повышение в СОТК на 30–60% у пациентов, применявших ребамипид.
Заключение. Частота выявления ЭНМП у больных с симптомами ФЗК составила 89,2%. Диета FODMAP, кишечные антисептики, регуляторы моторики и пробиотики способствовали уменьшению клинических симптомов, связанных с употреблением углеводов. Первый опыт применения ребамипида продемонстрировал способность препарата повышать активность дисахаридаз в СОТК.
Cовременная теория пищеварения создана выдающимся отечественным физиологом А.М. Уголевым в 1960–80-х гг. Ее суть заключается в том, что усвоение пищевых веществ реализуется не в два этапа (полостное пищеварение и всасывание), как предусматривала классическая теория, а в три: полостное пищеварение, мембранное пищеварение, всасывание. Мембранное пищеварение, открытое А.М. Уголевым в 1958 г., принципиально отличается от полостного расщепления полимеров строго направленным (а не хаотичным) расположением активных энзимных центров в апикальной мембране щеточной каймы энтероцитов [1]. В отличие от внутриклеточного мембранный гидролиз имеет неоспоримые преимущества, поскольку его скорость не лимитирована фаго- и пиноцитозом и сопряжена с транспортными системами мембраны.
Нарушение пищеварения может происходить на уровне полостного и мембранного гидролиза пищевых веществ. Причинами недостаточности полостного пищеварения являются болезни желудка (гастрогенная мальдигестия), поджелудочной железы (панкреатогенная мальдигестия) и гепатобилиарной системы (хологенная мальдигестия).
Мембранное пищеварение нарушается при заболеваниях тонкой кишки. Вследствие дистрофии и атрофии ее слизистой оболочки снижаются синтез собственно кишечных ферментов глюкоамилазы, мальтазы, лактазы, сахаразы, трегалазы и способность мембраны энтероцитов адсорбировать полостные ферменты.
Энтеропатия с нарушением мембранного пищеварения (ЭНМП) – заболевание, характеризующееся плохой переносимостью пищевых продуктов вследствие снижения ферментативной активности слизистой оболочки тонкой кишки (СОТК).
Симптомы ЭНМП (метеоризм, боли или дискомфорт в животе, нарушения стула) наблюдаются примерно у 25% населения. Широкая распространенность объясняется неблагоприятным влиянием на сложную и весьма уязвимую структуру тонкой кишки множества вредных факторов внешней среды: острых кишечных инфекций, лекарственных средств, пищевых добавок и иных веществ, поступающих в организм. ЭНМП следует отличать от пищевой аллергии.
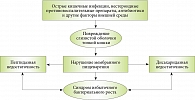
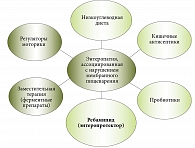
Результаты специальных исследований, проведенных в Московском клиническом научном центре (МКНЦ) им. А.С. Логинова, показали, что причиной вздутия живота (метеоризм), нарушения стула (чаще поносы), боли и/или дискомфорта в животе является вторичный (приобретенный) дефицит дисахаридаз – ферментов СОТК, обеспечивающих конечные стадии гидролиза углеводов. Нарушение кишечного пищеварения способствует развитию синдрома избыточного бактериального роста в тонкой кишке (СИБР). Как следствие – брожение и гниение пищевых веществ в полости кишечника, вызывающие метеоризм, нарушение стула и другие симптомы энтеропатии. Патогенез ЭНМП показан на рис. 1.
Для диагностики нарушений мембранного пищеварения применяют нагрузку дисахаридами с последующим определением глюкозы в крови [2], методику А.М. Уголева, Ц.Г. Масевича и Э.А. Забелинского, основанную на определении амилазы в смывах и гомогенате СОТК [3]. С помощью перфузии тощей кишки растворами углеводов мы описали характерные клинические симптомы нарушений полостного пищеварения, мембранного пищеварения и всасывания [4] .
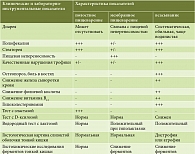
В таблице представлены дифференциально-диагностические признаки нарушений уровня ассимиляции пищевых веществ [5].
Несмотря на сходство клинических симптомов мальдигестии и мальабсорбции, имеются и некоторые отличия. Так, диарея и качественные нарушения трофики чаще наблюдаются при патологии всасывания. Пищевая непереносимость чаще имеет место при недостаточности мембранного пищеварения. При дифференциальной диагностике проводятся гистохимические исследования, позволяющие выявлять дефицит конкретных мембранных ферментов в СОТК. Однако подобные методы помогают провести только качественную оценку результатов. Для количественной оценки применяется биохимическое определение концентрации ферментов в гомогенате СОТК, предложенное А. Dahlqvist [6].
Согласно Римскому консенсусу – IV (2016 г.), клинический симптомокомплекс функциональных заболеваний кишечника (ФЗК) включает нарушения частоты и консистенции стула в сочетании с болью в животе (или в отсутствие таковой), уменьшающейся после дефекации [7]. Среди других жалоб пациентов с ФЗК преобладают повышенное газообразование, урчание и вздутие живота. Вместе с тем аналогичные клинические симптомы наблюдаются при нарушении мембранного пищеварения. Следовательно, у части больных ФЗК можно установить не синдромный, а нозологический диагноз, то есть ЭНМП.
Целью нашей работы стала оценка частоты недостаточной активности кишечных карбогидраз (лактазы, глюкоамилазы, мальтазы, сахаразы) у пациентов с клинической картиной ФЗК.
Материал и методы
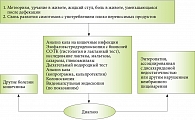
Обследовано 102 больных в возрасте от 18 до 50 лет (41 мужчина и 61 женщина) с клиническими симптомами синдрома раздраженного кишечника (n = 65), функциональной диареи (n = 33) и функционального запора (n = 4), согласно Римскому консенсусу – IV. Алгоритм обследования больных приведен на рис. 2.
Результаты инструментальных исследований, включавших рентгенологический, эндоскопический и ультразвуковой методы, не продемонстрировали патологических изменений кишечника и других органов пищеварения, что соответствовало критериям ФЗК.
Эзофагогастродуоденоскопию (ЭГДС) дополняли биопсией СОТК, полученной из залуковичного отдела двенадцатиперстной кишки. Один из фрагментов СОТК использовали для гистологического исследования, другой – для биохимического исследования активности кишечных (мембранных) карбогидраз.
Активность глюкоамилазы, мальтазы, сахаразы и лактазы исследовали в СОТК, полученной из дистального отдела двенадцатиперстной кишки во время ЭГДС. Применяли методику Далквиста [6] в модификации Триндера.
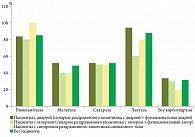
За норму принимали показатели активности карбогидраз у 20 практически здоровых лиц в возрасте 23–47 лет. Активность лактазы у них в среднем составила 42 ± 13 нг глюкозы/мг ткани × мин, активность глюкоамилазы – 509 ± 176, мальтазы – 1735 ± 446, сахаразы – 136 ± 35 нг глюкозы/мг ткани × мин.
Результаты и обсуждение
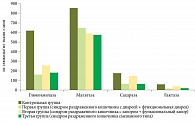
На рисунках 3 и 4 показана активность карбогидраз в СОТК у 102 пациентов с симптомами ФЗК и 20 пациентов контрольной группы.
Нормальная активность ферментов отмечалась у 11 (10,8%) больных. Активность всех исследованных ферментов оказалась сниженной у 33 (32,3%) пациентов. У 58 (56,9%) пациентов выявлены селективные снижения уровня карбогидраз.
При гистологическом исследовании биоптатов СОТК у большинства больных соотношение высоты ворсин и глубины крипт оказалось больше 3:1, а число межэпителиальных лимфоцитов не превышало 20 на 100 энтероцитов. Контуры щеточной каймы были четкими, в глубине крипт выявлено много панетовских клеток. Инфильтрация собственной пластинки лимфоцитами и плазмоцитами была слабо или умеренно выраженой. Все это позволяло исключить патогистологические признаки болезней тонкой кишки, хотя и давало в ряде случаев основание интерпретировать подобные изменения как слабовыраженный неактивный дуоденит.
Таким образом, исходя из полученных данных у 91 из 102 больных, то есть у 89,2% пациентов с симптомами ФЗК, установлена ЭНМП. Основанием для нозологического диагноза служила прямая патогенетическая связь клинических симптомов с патологией СОТК. Отсутствие патогистологических изменений СОТК при обычном микроскопическом исследовании не исключает их наличия. Ультраструктурное изучение СОТК на полутонких срезах позволило выявить отек цитоплазмы эпителиоцитов, деструкцию митохондрий и гранулярной эндоплазматической сети, отсутствие базальной мембраны, что говорило об умеренно или незначительно выраженном деструктивно-дистрофическом процессе в стенке тонкой кишки [8].
Алгоритм лечения больных представлен на рис. 5.
В Римских критериях – II и III лечебному питанию отводилась скромная роль. Пациентам с синдромом раздраженного кишечника предлагалось ограничивать потребление кофеина и жиров, усиливающих моторику и сенсорную чувствительность кишки [9, 10]. Между тем традиционно лечебному питанию пациентов с патологией кишечника всегда отводилась ведущая роль. Этому способствовала хорошо известная врачам особая «привередливость в еде» таких больных из-за непереносимости молока, овощей и фруктов, варений и джемов, содержащих легко усваиваемые углеводы. Диета с ограничением рафинированных углеводов при заболеваниях кишечника имеет давнюю историю и традиционно применяется у больных с патологией кишечника (лечебные столы Певзнера № 4–4в).
В последнее время данное направление получило новый виток развития: предложена диета с низким содержанием углеводов FODMAP (the low fermentable, oligosaccharides, disaccharides, monosaccharides and polyols diet) [11]. В рационе ограничивают олигосахариды – углеводы, состоящие из двух (дисахариды) и более (до десяти) остатков моносахаридов, связанных между собой гликозидными связями. Подобная диета оказалась эффективной и у больных ФЗК. Положительное влияние связывают с тем, что у пациентов с повышенной висцеральной чувствительностью отсутствие в рационе большого количества углеводов приводит к уменьшению процессов брожения и газообразования [11, 12]. Не умаляя значения этого патогенетического фактора в механизме формирования кишечных симптомов, следует заметить, что положительный клинический эффект FODMAP, как показали результаты нашего исследования, может быть обусловлен уменьшением нагрузки на ферментативно-транспортные комплексы, обеспечивающие работу «пищеварительно-транспортного конвейера» (по А.М. Уголеву) в условиях дефицита дисахаридаз. Не случайно в алгоритм лечения больных мы ввели диету с низким содержанием углеводов по типу FODMAP.
Медикаментозная терапия была направлена на подавление СИБР (кишечные антисептики, пробиотики) и восстановление нарушенной моторики (регуляторы моторики).
С разрешения ученого совета и локального этического комитета МКНЦ им. А.С. Логинова больным ЭНМП с их согласия назначали ребамипид 100 мг (одна таблетка) три раза в день в течение 12 недель.
На фоне применения диеты, кишечных антисептиков, регуляторов моторики и пробиотиков у пациентов снижалась выраженность клинических симптомов, связанных с употреблением углеводов. Первый опыт применения ребамипида показал его способность повышать активность дисахаридаз в СОТК. По данным повторных исследований активности дисахаридаз в СОТК, их повышение на 60–80% ассоциировано с применением ребамипида.
В многочисленных исследованиях доказано, что ребамипид обладает гастропротективными свойствами и способствует заживлению язвенных поражений желудка и тонкой кишки [13–15]. Кроме того, препарат характеризуется защитными свойствами при воздействии на другие ткани. Он используется при стоматитах, почечной патологии, повреждении печени [16]. Механизмы защитного действия ребамипида зависят от стимуляции синтеза простагландинов, подавления свободнорадикального окисления тканей, подавления накопления нейтрофилов, стимуляции экспрессии факторов роста [17–19]. Ребамипид воздействует через активацию в эпителии генов ростовых факторов и в результате прямого действия на эндотелий микрососудов. Стимуляция ребамипидом таких факторов, как TGFβ, EGF, HFG, FGF, IGF1, IL-2, способствует улучшению пролиферации эпителия [20]. Восстановление ультраструктурных нарушений может лежать в основе улучшения дисахаридазной активности эпителия тонкой кишки под влиянием ребамипида.
Заключение
ЭНМП выявлена у 89,2% больных с симптомами ФЗК на основании патогенетической связи клинических симптомов с низкой активностью мембранных ферментов СОТК. Патогенетически обоснованное лечение энтеропротектором Ребагит в течение 12 недель способствует уменьшению или полному купированию нарушений стула, боли в животе и метеоризма, связанных с употреблением углеводов. В СОТК больных увеличивается активность мембранных ферментов.
A.I. Parfyonov, N.I. Belostotsky, S.R. Dbar, O.V. Ahmadullina, S.V. Bykova, E.A. Sabelnikova, S.G. Khomeriki
A.S. Loginov Moscow Clinical Scientific and Practical Center of the Health Department of Moscow
Contact person: Asfold Ivanovich Parfenov, asfold@mail.ru
Aim – to establish the frequency of enteropathy with disorder of membrane digestion (EDMD) in patients with a clinical picture of functional bowel diseases (FBD) and the effect of rebamipide on the activity of disaccharidases.
Material and methods. In 20 healthy people and 102 patients with clinical symptoms of FBD were examined according to Rome IV criteria (2016), the activity of glucoamylase, maltase, sucrose and lactase in the small intestinal mucosa (SIM) were determined by Dahlquis – Trinder method in duodenal biopsies obtained from the distal duodenum during esophagogastroduodenoscopy.
Results. Normal activity of enzymes was established in 11 (10.8%) patients. In 33 (32.3%) patients, the activity of all disaccharidases was reduced, in 58 (56.9%) the activity of 1–3 enzymes was reduced. They have EDMD. For the treatment EDMD used a low-carbohydrate diet FODMAP diet, intestinal antiseptics, motor regulators and probiotics. In a separate group of selected patients treated with enteroprotector rebamipide at a dose 300 mg/day for 12 weeks. According to repeated studies the activity of disaccharidases in SIM discovered the increase of their activity by 30–60% in patients receiving rebamipide.
Conclusion. The frequency of detection of EVMD in patients with symptoms of FBD is 89.2%. The use of FODMAP diet, intestinal antiseptics, motor regulators and probiotics helps to reduce the clinical symptoms associated with eating products containing carbohydrates. First experience of rebamipide shows its ability to increase the activity of disaccharidases in SIM.
