«Иммунное» питание: новые возможности коррекции метаболических нарушений у больных в критических состояниях
- Аннотация
- Статья
- Ссылки
Введение
Независимо от причины, критическое состояние вызывает массивный выброс медиаторов воспаления, что приводит к развитию определенного комплекса метаболических реакций – синдрома системного воспалительного ответа. В результате у больного формируется синдром гиперметаболизма – гиперкатаболизма, сопровождающийся выраженным увеличением потребности в белково-энергетических субстратах, нарушается иммунный статус, изменяется проницаемость кишечной стенки с нарушением поступления питательных веществ. Все эти факторы увеличивают риск развития инфекционных осложнений, в том числе сепсиса, у больных в критическом состоянии.
В настоящее время активно изучаются способы коррекции метаболических нарушений и выраженности синдрома системного воспалительного ответа у больных в критическом состоянии. В качестве одного из возможных методов рассматривается использование фармаконутриентов – питательных веществ, способных оказывать специфическое влияние на течение метаболического ответа, функциональную активность клеток иммунной системы, проницаемость кишечной стенки. Опыт использования данных препаратов привел к формированию концепции «иммунного» питания. В большом количестве исследований было показано, что «иммунное» питание способствует снижению частоты инфекционных осложнений у больных в критических состояниях, сокращению длительности госпитализации, а также уменьшает себестоимость лечения [1–3]. Фармакоэкономический анализ, проведенный A. Strickland и соавт., показал среднее сокращение общей стоимости лечения в расчете на одного пациента, получавшего фармаконутриенты, на 2006 долл. США [4].
Из большого числа известных сегодня фармаконутриентов наибольший интерес вызывают глутамин, аргинин и омега-3 жирные кислоты. Несмотря на то что значительное количество исследований продемонстрировало эффективность использования данных фармаконутриентов у больных в критическом состоянии, результаты этих работ поставили ряд вопросов, нуждающихся в дальнейшем изучении. Например, было показано, что применение стандартного протокола «иммунного» питания в гетерогенной группе больных, находящихся в критическом состоянии, не привело к снижению летальности, частоты развития осложнений, в том числе инфекционных, и уменьшению длительности госпитализации [5]. Было также установлено, что существенное значение имеет путь введения различных фармаконутриентов (энтеральный или парентеральный) [6, 7]. Кроме того, важно учитывать дозозависимый эффект указанных нутриентов, поскольку использование некорректных дозировок увеличивает риск развития побочных эффектов и снижает эффективность проводимой терапии. Таким образом, эффективность «иммунного» питания зависит не только от характера основного заболевания пациента, свойств и механизма действия препарата, но и от особенностей его применения.
Глутамин
Глутамин – это наиболее часто встречающаяся в теле человека аминокислота. Общее количество глутамина в организме определяется его содержанием в составе белка. Глутамин способен синтезироваться в организме, основным источником эндогенного глутамина является мышечная ткань. Подчеркнем, что концентрация глутамина в плазме крови является прогностическим признаком исхода заболевания. В среднем концентрация глутамина в плазме крови составляет 0,6 ммоль/л, снижение данного показателя ниже 0,42 ммоль/л существенно увеличивает вероятность летального исхода у больных, находящихся в критическом состоянии [8]. В многочисленных исследованиях было установлено, что введение глутамина способствует уменьшению частоты возникновения инфекционных осложнений и летальности у больных в критическом состоянии [9, 10].
При развитии критического состояния наблюдается быстрое снижение уровня свободного глутамина [11, 12], несмотря на активный распад белков мышечной ткани и повышенный синтез этой аминокислоты [13]. Резкое повышение потребления глутамина при критическом состоянии вызвано большим количеством метаболических процессов, в которых он принимает участие. Глутамин является источником энергии, поскольку при его окислении образуется аденозинтрифосфат, а также участвует в синтезе глутатиона, являясь его предшественником, и в межорганном обмене азота [14]. Глутамин – незаменимый энергетический субстрат для клеток иммунной системы, в особенности для моноцитов и макрофагов. Уменьшение концентрации глутамина в плазме крови вызывает процесс деления этих клеток и снижение их функциональной активности [14, 15]. При снижении концентрации глутамина в культуре клеток до 0,5–0,125 ммоль/л интенсивность синтеза рибонуклеиновой кислоты уменьшается на 25%. Являясь энергетическим субстратом для энтероцитов, глутамин также способствует поддержанию целостности кишечной стенки, снижая риск развития синдрома транслокации бактерий [16].
В настоящее время опубликовано большое количество работ, посвященных оценке эффективности глутамина при парентеральном и энтеральном введении у больных, находящихся в критическом состоянии. Одно из первых исследований парентерального введения глутамина было проведено в 1997 г. R.D. Griffiths и соавт. [10]. В ходе исследования пациенты (n = 84) с тяжелым сепсисом были разделены на две группы. Первая группа получала полное парентеральное питание с добавлением глутамина, вторая – стандартное парентеральное питание. В первой группе отмечалось существенное улучшение выживаемости в ближайшие 6 месяцев после поступления в стационар (24 из 42 пациентов) по сравнению с контрольной группой (14 из 42).
В рандомизированных исследованиях изучалось также влияние дипептида аланин-глутамин на исходы заболевания у больных, находящихся в критическом состоянии. В одном из таких исследований с участием 114 больных было отмечено существенное снижение частоты инфекционных осложнений в группе больных, которым вводили глутамин, по сравнению с контролем (41,4% и 60,7% соответственно; p < 0,05) [17]. Однако отметим, что различий по показателю летальности получено не было. При этом средняя продолжительность введения препарата составляла 6–7 суток.
Влияние продолжительности введения аланин-глутамина на исход заболевания у больных в критическом состоянии изучали в отдельном исследовании [9]. Пациенты (n = 144) были разделены на две группы: введение аланин-глутамина более 5 или более 9 дней. Существенного различия в 28-дневной выживаемости выявлено не было (35 и 33 пациента соответственно). Однако 6-месячная выживаемость была существенно выше в группе больных, которым вводили аланин-глутамин более 9 дней (22/33), по сравнению с группой пациентов, получавших препарат более 5 дней (13/35) (p < 0,05). Кроме того, авторы отметили, что при ежедневном введении дипептида в дозе 0,2 г/кг массы тела или 0,35 г/кг массы тела в течение 5 дней восстановления концентрации глутамина в плазме крови до нормальных значений не происходило.
В систематическом обзоре F. Novak и соавт., включившем данные 14 исследований, было показано, что парентеральное введение глутамина способствует снижению частоты инфекционных осложнений (отношение рисков (ОР) 0,81; 95% доверительный интервал (ДИ) 0,64–1,00), длительности госпитализации больных (2,6 дня; 95% ДИ 4,5–0,7) [18]. Дальнейшие исследования, посвященные этой проблеме, подтвердили выводы, сделанные авторами обзора. Было показано, что парентеральное введение глутамина в высоких дозах (0,2–0,57 г/кг/сут) уменьшает летальность (ОР 0,67; 95% ДИ 0,48–0,92) [19].
При этом убедительных данных, свидетельствовавших об эффективности энтерального введения глутамина, не получено. Так, J.C. Hall и соавт. в крупном рандомизированном исследовании (n = 363) не выявили различий в летальности и частоте развития сепсиса у пациентов, ежедневно получавших 19 г глутамина энтерально, по сравнению с контролем (15% против 16% и 21% против 23% соответственно) [20]. Вероятнее всего, отсутствие выраженного эффекта при энтеральном введении глутамина обусловлено тем, что для обеспечения включения глутамина в метаболические процессы принципиальное значение имеет поддержание определенной концентрации препарата в плазме крови. Значительное повышение концентрации глутамина в плазме крови происходит при парентеральном способе введения препарата, но не при энтеральном, что было подтверждено в работе G.C. Meils и соавт. [21].
Таким образом, больным, находящимся в критическом состоянии, показано парентеральное введение глутамина. Для оценки эффективности энтерального введения глутамина необходимо проведение дополнительных исследований.
Аргинин
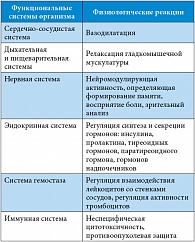
Аргинин – условно незаменимая для взрослых и незаменимая для детей аминокислота – в основном синтезируется в проксимальных почечных канальцах. Аргинин и его метаболиты (орнитин, цитруллин) принимают активное участие в большом количестве метаболических процессов. Так, аргинин играет ключевую роль в синтезе мочевины, преобразуясь под воздействием аргиназы 1 в гепатоцитах в орнитин (предшественник спермина и спермидина) и мочевину. Данные метаболиты входят в состав хроматина и стимулируют репликацию рибонуклеиновой кислоты. В результате активизируется процесс деления клеток, что способствует более быстрому заживлению ран [22, 23]. Аргинин также оказывает влияние на иммунную систему, стимулируя Т-лимфоциты (усиливает пролиферацию, продукцию интерлейкина 2, рецепторную активность) [24], повышает концентрацию инсулина и инсулиноподобного фактора роста в плазме крови [25], является предшественником глутамина [26]. Другие многочисленные эффекты аргинина связаны с тем, что он является предшественником оксида азота, вырабатываемого клетками эндотелия сосудов, макрофагами, нейтрофилами [27, 28]. Физиологическая активность оксида азота играет важную роль в функционировании различных систем организма (см. таблицу).
Важность поддержания концентрации аргинина в плазме крови в нормальных пределах подтверждена результатами многочисленных исследований. Например, в ряде работ было показано, что уменьшение концентрации аргинина и оксида азота в плазме крови у пациентов с сепсисом увеличивает риск летального исхода [29–32]. Следовательно, можно предположить, что введение аргинина с целью поддержания его нормальной концентрации в плазме крови должно способствовать улучшению результатов лечения, особенно у больных с сепсисом.
Однако данные исследований, в которых изучалось влияние экзогенного аргинина на результаты лечения больных с сепсисом, носят противоречивый характер. Две независимые группы экспертов провели анализ исследований высокой степени доказательности, посвященных «иммунному» питанию с добавлением аргинина, и сделали взаимоисключающие выводы [33–36]. D.K. Heyland и соавт. пришли к следующему заключению: введение аргинина увеличивает риск летального исхода у больных с тяжелым сепсисом и септическим шоком [33, 37], объяснив это тем, что чрезмерное образование оксида азота может приводить к прогрессированию нарушений регуляции сосудистого тонуса, в результате чего могут нарастать нарушения перфузии тканей. J.C. Montejo и соавт. аналогичных данных не получили [35–36]. Последующие исследования не внесли ясность. Был опубликован ряд работ, авторы которых, отмечая прогностическую важность поддержания нормальной концентрации аргинина в плазме крови, лишь предполагали наличие благоприятного эффекта от его введения на конечные результаты [29, 38], но при этом подчеркивали необходимость дальнейшего изучения вопроса.
В пилотных исследованиях было показано, что гемодинамические изменения при введении аргинина определяются скоростью введения и дозой данного фармаконутриента. Y.C. Luiking и соавт. у 8 больных с септическим шоком проводили инфузию аргинина, постепенно повышая скорость введения с 0,6 до 1,8 мкг/кг/мин [39]. Авторы не выявили достоверных различий в показателях среднего артериального давления по сравнению с исходными данными, но отметили увеличение сердечного выброса. Еще в одном двойном слепом рандомизированном исследовании, в котором больным проводилась постоянная 3-дневная инфузия аргинина в дозе 1,2 мкг/кг/мин, также не было определено значимых изменений гемодинамических показателей [40]. В экспериментальной работе Y. Nakajiama и соавт. введение одновременно аргинина и вазопрессина способствовало более быстрому восстановлению микроциркуляции стенки кишечника у мышей по сравнению с моноинфузией вазопрессина [41].
В настоящее время применение аргинина при лечении больных с тяжелым сепсисом и септическим шоком не рекомендуется [42] в связи с недостаточным количеством данных по этому вопросу, что говорит о необходимости проведения дополнительных исследований. Вместе с тем опубликовано большое количество работ, доказавших эффективность использования аргинина в лечении других групп больных. D.A. de Luis и соавт. показали, что использование смесей для энтерального питания, обогащенных аргинином, приводит к уменьшению длительности госпитализации и снижению частоты осложнений в области послеоперационной раны в раннем послеоперационном периоде у больных с новообразованиями головы и шеи [43, 44]. В других исследованиях было установлено, что применение смесей для энтерального питания, обогащенных аргинином, омега-3 жирными кислотами и нуклеотидами, у больных с хирургическими и травматологическими заболеваниями сопровождается снижением частоты инфекционных осложнений и длительности госпитализации [2, 35]. У больных с новообразованиями желудочно-кишечного тракта проведение «иммунного» энтерального питания в периоперационном периоде способствует уменьшению частоты осложнений (инфекционных и неинфекционных) в раннем послеоперационном периоде. При этом степень исходной белково-энергетической недостаточности не оказывает влияния на эффективность данного вида нутритивной поддержки [45]. Таким образом, больным хирургического профиля показано дополнительное введение аргинина в периоперационном периоде.
Омега-3 жирные кислоты
Интерес к омега-3 жирным кислотам впервые возник в конце 1980-х гг. после публикации работ J. Dyerberg и соавт., обнаруживших причинно-следственную связь между употреблением большого количества морепродуктов с высоким содержанием омега-3 жирных кислот и низким уровнем сердечно-сосудистых заболеваний у жителей Гренландии [46]. В дальнейшем было установлено, что омега-3 жирные кислоты обладают гиполипидемическим эффектом, оказывают гипокоагуляционное, противовоспалительное и иммуномодулирующее действие [47]. Механизм действия омега-3 жирных кислот обусловлен их влиянием на систему эйкозаноидов. Омега-3 жирные кислоты являются прямыми конкурентами арахидоновой кислоты на циклооксигеназно-липоксигеназном уровне, что приводит к изменению соотношения про/противовоспалительных медиаторов:
- снижается уровень тромбоксана А2, мощного вазоконстриктора и активатора агрегации тромбоцитов;
- уменьшается образование лейкотриена В4, индуктора воспаления, хемотаксиса и адгезии лейкоцитов;
- повышается концентрация в плазме тромбоксана А3, слабого вазоконстриктора и индуктора агрегации тромбоцитов;
- повышается уровень содержания простациклина I3, активного вазодилататора и индуктора агрегации тромбоцитов;
- повышается концентрация лейкотриена В5, слабого противовоспалительного агента и фактора хемотаксиса;
- изменяется биофизическая характеристика клеточных мембран вследствие изменения состава фосфолипидов и содержания холестерина;
- снижается концентрация провоспалительных медиаторов (фактор активации тромбоцитов, интерлейкины 1 и 6, фактор некроза опухоли альфа).
С учетом этих свойств было высказано предположение о том, что применение омега-3 жирных кислот может способствовать уменьшению воспалительной реакции у больных, находящихся в критическом состоянии, и уменьшению выраженности органной дисфункции. Проведенные в дальнейшем многочисленные исследования подтвердили клиническую эффективность омега-3 жирных кислот как у больных с тяжелым сепсисом, так и у других категорий больных, находящихся в критическом состоянии. При этом эффективность омега-3 жирных кислот не зависела от пути их введения (энтерально или парентерально).
A. Pontes-Arruda и соавт. в исследовании, включавшем 165 больных с тяжелым сепсисом и септическим шоком, показали, что применение энтеральных смесей с добавлением омега-3 жирных кислот и антиоксидантов способствовало снижению летальности на 19,4%, а также уменьшению продолжительности искусственной вентиляции легких (5,8 и 13,4 суток) по сравнению с использованием обычных энтеральных смесей [48]. C. Galban и соавт. выявили снижение частоты бактериемии и летальности у больных с тяжелым сепсисом, получавших энтеральные смеси, содержащие омега-3 жирные кислоты, по сравнению с больными, получавшими стандартные смеси для энтерального питания (5,6% против 19,5% и 3,8% против 27% соответственно) [49]. В многоцентровом проспективном рандомизированном исследовании с участием 198 пациентов с сепсисом 3-дневное введение смесей для энтерального питания, обогащенных омега-3 жирными кислотами, уменьшало частоту развития нозокомиальной инфекции и улучшало оксигенацию [50]. P. Singer и соавт. также подтвердили улучшение легочной оксигенации и уменьшение длительности искусственной вентиляции легких у больных с синдромом острого легочного повреждения, получавших в составе энтерального питания омега-3 жирные кислоты [51].
Большой интерес представляет также возможность парентерального применения омега-3 жирных кислот у больных с тяжелым сепсисом и септическим шоком. В настоящее время существует всего несколько работ, посвященных этой проблеме. Так, A.R. Heller и соавт. провели многоцентровое, проспективное исследование, в которое был включен 661 пациент, в том числе 292 пациента с сепсисом. Введение омега-3 жирных кислот в дозе 0,1–0,2 г/кг/сут привело к уменьшению летальности и длительности госпитализации. При этом у больных с сепсисом минимальная клинически значимая дозировка омега-3 жирных кислот составляла 0,23 г/кг/сут [52].
Высокоэффективным оказалось использование омега-3 жирных кислот у больных в периоперационном периоде. H. Takeuchi и соавт. сообщили о меньшей частоте возникновения инфекционных осложнений в послеоперационном периоде у больных раком пищевода, получавших в периоперационном периоде энтеральные смеси, содержащие омега-3 жирные кислоты, аргинин, нуклеотиды [53]. M. Kemen и соавт. продемонстрировали, что использование «иммунного» питания способствует более быстрой нормализации иммунного ответа у онкологических больных в послеоперационном периоде [54]. U. Giger и соавт. выявили уменьшение выраженности воспалительной реакции и частоты возникновения осложнений в послеоперационном периоде у больных, получавших смеси, обогащенные аргинином, омега-3 жирными кислотами и нуклеотидами [55]. Аналогичные результаты были получены и другими авторами [25, 56, 57].
Имеются также работы, показавшие эффективность парентерального введения омега-3 жирных кислот у больных, перенесших хирургическое вмешательство. M. Senkal и соавт. отметили достоверное повышение уровня эйкозапентаеновой и докозагексаеновой кислот и уровня фосфолипидов в плазме и эритроцитов у больных, оперированных по поводу новообразований толстой кишки, на фоне введения эмульсии омега-3 жирных кислот и отсутствие различий в концентрации арахидоновой кислоты [58]. A.R. Heller и соавт. показали более раннее восстановление функции печени и поджелудочной железы в послеоперационном периоде у онкологических больных на фоне инфузии омега-3 жирных кислот [59]. В экспериментальной работе K. Furukawa и соавт. выявлен более низкий уровень провоспалительных медиаторов у животных, перенесших торакотомию, эзофаготомию, на фоне инфузии омега-3 жирных кислот [60]. M.W. Wichmann и соавт. провели проспективное многоцентровое исследование с участием 256 больных хирургического профиля. Результаты исследования подтвердили эффективность омега-3 жирных кислот, выразившуюся в уменьшении длительности госпитализации в послеоперационном периоде [61].
Учитывая все вышесказанное, можно сделать вывод о том, что омега-3 жирные кислоты положительно влияют на течение метаболических процессов у больных, находящихся в критическом состоянии.
Заключение
«Иммунное» питание позволяет влиять на метаболические процессы у больных в критическом состоянии, тем самым корректируя течение заболевания, что выражается в уменьшении летальности и длительности госпитализации, и способствуя сокращению стоимости лечения. Однако в настоящий момент не существует стандартного набора фармаконутриентов и способов их введения, показанного всем больным, находящимся в критическом состоянии. В этой связи при выборе фармаконутриентов необходимо учитывать не только особенности основного заболевания (наличие у больного тяжелого сепсиса, септического шока), но и эффективность того или иного фармаконутриента в зависимости от способа введения. Следует помнить также о том, что такие фармаконутриенты, как глутамин и омега-3 жирные кислоты, обладают дозозависимыми эффектами. Кроме того, остается достаточно большое количество вопросов (применение аргинина у больных с тяжелым сепсисом, эффективность глутамина при энтеральном введении, оптимизация доз омега-3 жирных кислот и др.), решение которых невозможно без проведения дополнительных исследований.