Иммунотерапия больных раком шейки матки
- Аннотация
- Статья
- Ссылки
- English
Рак шейки матки – одна из самых распространенных онкогинекологических опухолей у женщин. Ежегодно в мире регистрируется более чем 569 847 новых случаев рака шейки матки, умирают свыше 311 365 женщин [1].
Около 70% случаев рака шейки матки регистрируется в развивающихся странах в местнораспространенной или метастатической форме, что вносит весомый вклад в высокую смертность от данной патологии. Пятилетняя выживаемость при локальных формах рака шейки матки, требующих либо хирургического лечения, либо химиолучевой терапии, достигает 75–85% [2–4].
К сожалению, пятилетняя выживаемость при метастатическом и рецидивирующем раке шейки матки не превышает 15%. Стандартным подходом к лечению больных с такими формами рака является платиносодержащая химиотерапия. Ее эффективность составляет около 20–26%, продолжительность жизни – 12–13 месяцев [2–9].
В исследовании GOG 240 2014 г. бевацизумаб, добавленный к химиотерапии первой линии при рецидивирующем или метастатическом раке шейки матки, продемонстрировал эффективность в 36–48% случаев. На фоне применения препарата выживаемость увеличилась до 17 месяцев [10]. В то же время результаты второй линии химиотерапии остаются неудовлетворительными.
Иммуноонкология возникла как потенциальная новая стратегия для улучшения результатов лечения пациентов со злокачественными новообразованиями. Стратегии, включающие в себя адаптивную Т-клеточную терапию и ингибирование иммунных контрольных точек, продемонстрировали многообещающие результаты у больных, резистентных к ранее проведенной терапии [11, 12].
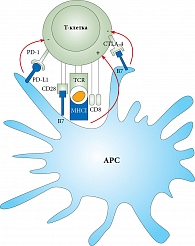
Рак шейки матки – прямое следствие инфекции, вызванной специфическим онкогенным вирусом папилломы человека (ВПЧ) 16-го и 18-го подтипов [13–15]. Большинство женщин излечиваются, но длительное персистирование вируса приводит к синтезу онкопротеинов E6 и E7, инактивирующих p53 и pRB [16]. Эти онкопротеины изменяют клеточный цикл и провоцируют возникновение и рост опухоли [16]. Т-клетки играют центральную роль в контроле вирусных инфекций и предотвращении вирус-ассоциированных опухолей. Возникновение иммунного ответа на опухолевые и вирусные антигены зависит от их антигенпрезентации дендритными клетками и образования антигенспецифических Т-клеток. Эти шаги регулируются комплексом активирующих и ингибирующих сигналов (рисунок) [17].
Т-клетки распознают инфицированные клетки и классически активируются через три четко определенных сигнала:
- взаимодействие рецепторов Т-клеток и пептидных эпитопов опухолево-ассоциированных антигенов, связанных с большим комплексом гистосовместимости антигенпрезентирующих клеток (APCs; дендритные клетки, макрофаги, клетки Лангерганса, В-клетки);
- костимуляция за счет взаимодействия между лигандами на APC и их родственных рецепторов на T-клетках;
- воспалительные цитокиновые сигналы [18].
Участие Т-клеток в ВПЧ-инфекции подтверждено результатами ряда исследований, показавшими регресс ВПЧ-индуцированных папиллом и увеличение частоты связанных с ВПЧ злокачественных новообразований при иммунодепрессии и иммунодефицитных состояниях [19, 20]. Развитие инвазивного рака при ВПЧ-инфекции зависит от приобретения иммунодепрессивных состояний (или иммунного истощения) в микроокружении опухоли, которые стимулируют уклонение опухоли от иммунного ответа.
Механизмы иммунного ингибирования
CTLA-4 – рецептор, который экспрессируется активированными Т-лимфоцитами и противодействует костимуляторному пути, вызванному CD28 (рисунок) [21]. Хотя CTLA-4 и CD28 разделяют один и тот же лиганд (CD80/CD86), CTLA-4 имеет значительно большую аффинность связывания и предпочтительно связывается с CD80/CD86, что приводит к инактивации иммунного ответа [22]. Блокирование этого механизма доказало свою терапевтическую эффективность при нескольких злокачественных новообразованиях [23]. Блокада CTLA-4 может оказывать противоопухолевое действие через усиленную T-клеточно-опосредованную цитотоксичность и усиленную пролиферацию Т-клеток и прямое ингибирующее действие на иммуносупрессор FOXP3 регуляторных Т-клеток (Tregs) [24].
PD-1 (D279), ключевой компонент иммунной регуляторной системы, экспрессируется на активированных Т-клетках и относится к семейству CD28 Т-клеточных костимуляторных рецепторов. В случае когда PD-1 связан со своими лигандами, PD-L1 и PD-L2, которые могут быть экспрессированы на опухолевых клетках, разных APCs и лимфоцитах в микроокружении опухоли, активация Т-клеток ингибируется. Хотя путь CTLA-4 – CD80/86 (B7) имеет решающее значение для инициации иммунной реакции и регулирует раннюю активацию первичных Т-клеток и Т-клеток памяти, путь PD-1/PD-L1 представляется доминирующим в эффекторной фазе иммунного ответа (рисунок) [25–27].
Установлено, что PD-L1 гиперэкспрессируется в 20–50% случаев злокачественных новообразований и может быть использован в качестве потенциальной терапевтической мишени [28]. PD-L1 можно обнаружить как на опухолевых, так и на опухоль-инфильтрирующих иммунных клетках. Уровень экспрессии коррелирует с плохим клиническим ответом [29–33]. Ингибиторы PD-L1 способны восстанавливать функцию Т-клеток, блокируя взаимодействие PD-L1 с PD-1 и CD80 на поверхности Т-клеток. Кроме того, анти-PD-L1 поддерживает взаимодействие PD-1/PD-L2. Это может быть важно для поддержания иммунного гомеостаза и потенциально профилактировать развитие аутоиммунного ответа [34]. В клиническом исследовании с участием 115 больных раком шейки матки экспрессия PD-L1 и PD-L2 отмечалась в 19 и 29% опухолей соответственно. Кроме того, PD-1 экспрессировался в более чем 50% опухоль-инфильтрирующих CD8+ T-клеток и CD4+ FOXP3+ T-клеток независимо от экспрессии опухолью PD-L1/L2.
Экспрессия PD-L1 не коррелировала с общей выживаемостью. Тем не менее анализ подгруппы выявил улучшение выживаемости у пациенток с преобладанием инфильтрирующих регуляторных T-клеток, когда опухоль была PD-L1-позитивной (p = 0,033) [35].
Напротив, в исследовании Лейденского университета безрецидивная выживаемость (p = 0,022) и специфическая выживаемость без прогрессирования (p = 0,046) у пациенток с плоскоклеточным раком шейки матки и экспрессией PD-L1 были значительно ниже, чем у больных с экспрессией PD-L1 в маргинальной зоне, то есть в зоне соприкосновения опухолевой ткани и стромы [36]. PD-L1-позитивные иммунные клетки находились в основном в окружении метастазов в лимфатических узлах [36, 37].
Лучевая терапия, иммунная система и абскопальный эффект
Традиционно считается, что ионизирующее излучение действует как иммунодепрессант и оказывает цитотоксическое антимитотическое действие на опухолевые клетки через повреждение ДНК [38, 39]. Однако R.H. Mole [40] в 1950-х гг. описал иммуномодулирующее воздействие радиации через абскопальный эффект. Данные современной литературы показывают, что излучение вызывает иммуномодулирующее действие, изменяя микроокружение опухоли и активируя воспалительный каскад. В ряде исследований продемонстрирован абскопальный эффект лучевой терапии (ЛТ) при ее добавлении к иммунотерапии. Вероятно, ЛТ индуцирует высвобождение неоантигенов, стимулирующих противоопухолевый иммунный ответ [41]. Лучевая терапия увеличивает плотность TIL (тумор-инфильтрирующих лимфоцитов), индуцируя хемокины, цитокины, изменяет в сосудистой сети опухоли молекулы адгезии, которые облегчают возвращение Т-клеток и инфильтрацию опухоли [41–43].
Лучевая терапия также влияет на миграцию дендритных клеток и перекрестную презентацию опухолевых антигенов, что приводит к активации и пролиферации Т-клеток [43–46]. Высвобождение антигена усиливается за счет активации дендритных клеток через высвобождение белков теплового шока и ускоренного созревания дендритных клеток, миграции и фагоцитоза через передачу кальретикулинового сигнала [39, 47]. Эффекторные Т-клетки соединяются с хемокинами, такими как CXCL-16, которые способны через антиангиогенные агенты нормализовать сосудистую сеть опухоли, увеличить инфильтрацию лимфоцитов, ограничить гипоксию, улучшить созревание дендритных клеток, уменьшить количество регуляторных Т-клеток и временно увеличить перфузию, что может привести к оптимальному микроокружению опухоли для максимальной эффективности ЛТ. Более того, синергетический эффект ЛТ и иммунотерапии против опухолевых клеток проявляется как локально, так и системно [48, 49].
Оптимальные результаты иммунотерапии могут быть получены при мультимодальном подходе к лечению, включающем двойной механизм действия – блокирование контрольных точек иммунного ответа и ЛТ для преодоления механизмов резистентности. По некоторым данным, ЛТ увеличивает экспрессию PD-L1, тем самым создавая мишень для ингибиторов PD-1/PD-L1 в качестве стратегии комбинированного лечения с ЛТ [41, 50, 51]. ЛT в сочетании с ингибиторами CTLA-4 продемонстрировала эффективность после прогрессирования на одних ингибиторах CTLA-4.
Клинические исследования иммунотерапии
Анти-CTLA-4-препараты
Ипилимумаб – человеческое моноклональное антитело IgG1k, специфичное для CTLA-4 на поверхности активированных Т-клеток и Tregs. Ипилимумаб изучали в I и II фазах у пациенток с рецидивами рака шейки матки. I фаза (шесть пациенток) предусматривала использование препарата в дозе 3 мг/кг в течение четырех циклов каждый 21-й день. После этого 32 пациентки получали ипилимумаб 10 мг/кг каждый 21-й день, четыре цикла, затем четыре цикла поддерживающей терапии каждые 12 недель. Первичной конечной точкой оценки эффективности служил объективный ответ [56]. Токсичность была контролируемой: диарея 3-й степени и выше зарегистрирована в четырех случаях, колит – в одном. Других видов токсичности не зафиксировано [56]. У одной из 34 пациенток отмечался частичный ответ, у десяти – стабилизация заболевания, у 23 – прогрессирование заболевания. Медиана выживаемости без прогрессирования составила 2,5 месяца (95%-ный доверительный интервал (ДИ) 2,1–3,2 месяца), медиана общей выживаемости – 8,5 месяца (95% ДИ 3,6 месяца – не достигнуто) [52]. Видимо, активность монотерапии ипилимумабом ограниченна. В целях увеличения эффективности в настоящее время проводится ряд исследований комбинации ипилимумаба и других агентов. Проводится I фаза исследования GOG 9929 по оценке безопасности и переносимости химиолучевой терапии и ипилимумаба у пациенток с местнораспространенным раком шейки матки, позитивными лимфоузлами. Сначала больные получают стандартную химиолучевую терапию, затем четыре последовательных цикла ипилимумаба каждые три недели. Первичными конечными точками оценки эффективности являются безопасность, переносимость и определение максимально переносимой дозы ипилимумаба после ЛТ расширенным полем. Вторичными конечными точками служат выживаемость без прогрессирования, выявление причин отмены препарата и исследования, включающие экспрессию PD-1 и оценку количества и характеристик Т-клеток, специфичных для ВПЧ-подтипа.
На конференции ASCO (American Society of Clinical Oncology – Американское общество клинической онкологии) в 2017 г. были представлены результаты исследования, в котором максимальная переносимая доза составила 10 мг/кг, токсичность была управляемой у 10% пациенток (2/19) и не потребовала назначения сопутствующей терапии [53]. Двенадцатимесячная общая выживаемость и выживаемость без прогрессирования достигли 90 и 81% соответственно. Кроме того, химиолучевая терапия и последовательное введение ипилимумаба увеличили экспрессию PD-1.
Анти-PD-1- и анти-PD-L1-терапия
Ингибиторы PD-1 продемонстрировали противоопухолевую активность и в настоящее время находятся в стадии клинических исследований при многих злокачественных заболеваниях [54].
В июне 2018 г. FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) разрешило к использованию пембролизумаб при раке шейки матки с экспрессией PD-L1 на основании результатов исследования KEYNOTE-158, в котором пембролизумаб назначали пациенткам с рецидивирующим или метастатическим раком шейки матки [11], и исследования KEYNOTE-028, в котором оценивали эффективность пембролизумаба у пациенток с прогрессирующими солидными опухолями и PD-L1-позитивным статусом (включая больных раком шейки матки) [55].
В KEYNOTE-158 участвовало 98 пациенток со статусом ECOG 0 или 1, которые получали пембролизумаб 200 мг внутривенно каждые три недели до 24 месяцев, или прогрессирования заболевания, или непереносимой токсичности, или смерти. PD-L1 – позитивный статус, определяемый как экспрессия PD-L1 ≥ 1%, отмечался у 83% пациенток. Токсичность была приемлемой, нежелательные явления 3–4-й степени имели место у 11% пациенток [11]. При медиане наблюдения 10,3 месяца объективный ответ наблюдался в 13% случаев, у трех пациенток зафиксирован полный ответ, у десяти – частичная регрессия опухоли, у 17 – стабилизация заболевания с контролем роста опухоли 31%. Почти у 70% пациенток (девять из 13) с объективным ответом продолжительность ответа превысила девять месяцев [11]. Ответы отмечались только у пациенток с позитивным PD-L1-статусом. Экспрессию PD-L1 определяли иммуногистохимическим методом, утвержденным в качестве диагностического метода. Несмотря на невысокую частоту достижения объективного ответа на лечение, продолжительность ответа в группе пациенток с многократно проведенным предварительным лечением весьма обнадеживающая.
В исследовании KEYNOTE-028 в когорте больных раком шейки матки (24 пациентки с распространенными стадиями и PD-L1-положительным статусом (экспрессия ≥ 1%)) получали пембролизумаб 10 мг/кг внутривенно каждые две недели до 24 месяцев [55]. Ответ оценивали каждые два месяца в течение шести месяцев и каждые три месяца по истечении указанного периода. Объективный ответ был первичной конечной точкой оценки эффективности лечения. При отсечении данных на медиане наблюдения 11 месяцев объективный ответ составил 17% в этой сильно предлеченной группе больных, частичный ответ зарегистрирован у четырех (17%) пациенток, стабилизация заболевания – у трех (13%). У пяти (21%) больных отмечались нежелательные явления 3-й степени, но ни у одной пациентки не зафиксирована токсичность 4–5-й степени.
Таким образом, пембролизумаб продемонстрировал многообещающие клинические результаты с приемлемым профилем токсичности у пациенток с общим плохим прогнозом и ограниченными терапевтическими возможностями.
В настоящее время проводятся клинические исследования, направленные на дальнейшее улучшение полученных результатов, комбинации анти-PD-1 и традиционных системных цитостатиков и ЛТ. Результаты исследования CheckMate 358 I/II фазы изучения ниволумаба при раке шейки матки были представлены на ASCO-2017 [56]. Пациентки с рецидивом или метастатическим раком шейки матки с более чем двумя предшествующими линиями терапии получали ниволумаб 240 мг внутривенно каждые две недели до прогрессирования заболевания или непереносимой токсичности [56]. Cреди 19 больных раком шейки матки общий ответ достигнут в 26,3% случаев независимо от экспрессии PD-L1 с уровнем контроля заболевания 68% [56].
Комбинации анти-PD-1- и анти-PD-L1-препаратов с разными таргетными и химиотерапевтическими препаратами
С учетом ограниченной активности ингибиторов PD-1 или PD-L1 при раке шейки матки в монорежиме проводится ряд исследований различных комбинаций как в первой линии терапии, так и в более поздних линиях.
Одно из исследований II фазы посвящено изучению атезолизумаба в сочетании с бевацизумабом у пациенток с рецидивирующим или метастатическим раком шейки матки с первичной конечной точкой оценки эффективности лечения в виде объективного ответа. Еще одно рандомизированное исследование II фазы посвящено сравнительной оценке эффективности монотерапии доксорубицином и монотерапии атезолизумабом и комбинации доксорубицина и атезолизумаба при рецидиве рака шейки матки.
В настоящее время проводится исследование III фазы GOG 3016, анти-PD-1 (REGN2810). В нем участвуют пациентки с рецидивирующим или метастатическим раком шейки матки. Исследователи сравнивают общую выживаемость между группами.
Кроме того, в ряде исследований изучают ингибиторы PD-1 и ингибиторы PD-L1 в качестве терапии первой линии при раке шейки матки. I фаза исследования PAPAYA предполагает одновременное применение пембролизумаба, ЛТ и цисплатина у больных раком шейки матки со стадиями IB–IVA.
Рекомбинантная вакцина Listeria monocytogenes
Listeria monocytogenes является бета-гемолитической, грамположительной, факультативной внутриклеточной бактерией, используемой для изучения клеточного иммунитета [57]. Listeria поражает антигенпрезентирующие клетки, вследствие чего происходит их репликация в цитоплазме хозяина через деградацию фагосомной мембраны. P. Basu и соавт. недавно опубликовали результаты II фазы исследования ADXS11-001 ± цисплатин у 109 больных раком шейки матки, которые ранее получили химиотерапию, ЛТ или химиолучевую терапию. Пациентки были рандомизированы на группы – три или четыре дозы ADXS11-001 и химиотерапии цисплатином (40 мг/м2). Медианы общей выживаемости, выживаемости без прогрессирования и объективный ответ в группах были сопоставимы. Тем не менее 12- и 18-месячные показатели общей выживаемости составили 30,9 против 38,9 и 23,6 против 25,9% соответственно. Токсичность от легкой до умеренной степени не была связана с проводимым лечением [58].
В аналогичном исследовании II фазы GOG 0265 50 пациенток с рецидивирующим или метастатическим раком шейки матки получали три дозы ADXS11-001 с 12-месячной общей выживаемостью 38% [59]. Хотя активность ADXS11-001 как отдельного агента невысока, комбинации с другими препаратами, в том числе с химиотерапией или ЛТ, могут быть оправданны.
Адаптивная Т-клеточная терапия при раке шейки матки
В исследовании S. Stevanovíc и соавт. [12] участвовали пациентки с метастазами ВПЧ-положительного рака шейки матки, ранее получавшие химиотерапию на основе платины или химиолучевую терапию. Больным назначали однократную инфузию опухоль-инфильтрирующих Т-клеток, направленных на ВПЧ E6 и E7. Из девяти пациенток у трех зафиксирован ответ (один частичный, два полных). Продолжительность полного ответа составила не менее 15 и 22 месяцев.
Выводы
Иммунотерапия является перспективным направлением в лечении больных раком шейки матки. У большинства больных заболевание вызвано ВПЧ-инфекцией высокого риска, кодирующей два определенных опухоль-специфических вирусных антигена Е6 и Е7, которые экспрессируются в каждой раковой клетке. Иммунотерапевтические варианты лечения, в том числе ингибиторы иммунных контрольных точек, рекомбинантная вакцина Listeria monocytogenes и адаптивная Т-клеточная терапия, демонстрируют многообещающие результаты. Дальнейшие исследования позволят расширить понимание роли иммунной системы в прогрессировании рака шейки матки, определить оптимальные сроки иммунотерапии и, возможно, выявить новые иммуномодулирующие мишени для реализации иммунного ответа.
S.V. Khokhlova, MD, PhD
V.I. Kulakov National Medical Research Center of Obstetrics, Gynecology and Perinatology
Contact person: Svetlana V. Khokhlova, SVKhokhloa@mail.ru
The article analyzes the results of a number of studies on the evaluation of immunotherapeutic methods in patients with cervical cancer. Shown the effectiveness of immune checkpoint inhibitors, recombinant vaccine Listeria monocytogenes and adaptive T-cell therapy.