VI Всероссийский конгресс эндокринологов с международным участием "Современные технологии в эндокринологии": Индивидуализация врачебной тактики в терапевтическом алгоритме сахарного диабета 2 типа
- Аннотация
- Статья
- Ссылки
Глобальная эпидемия сахарного диабета (СД) 2 типа обусловлена целым рядом факторов. Прежде всего, это старение населения и пандемия ожирения, вызванная снижением физической активности и повышением калорийности питания. Обязательным условием профилактики и лечения СД является изменение образа жизни, однако по причине низкой комплаентности пациентов эти предписания так и не становятся руководством к действию.
В этой связи на первый план выходит фармакотерапия пациентов с предиабетом и в начале заболевания. Учитывая, что важнейшим звеном патогенеза СД 2 типа является инсулинорезистентность, наиболее эффективной терапией на начальной стадии заболевания признаны сенситайзеры – препараты, повышающие чувствительность тканей к инсулину при наличии у пациента собственной достаточной его секреции. Согласно международным и российским рекомендациям, наряду с метформином препаратами первой линии в дебюте СД 2 типа являются тиазолидиндионы (глитазоны).
Хотя доказано, что глитазоны превосходят метформин в эффективности снижения резистентности к инсулину в мышечной и жировой тканях, применение этих препаратов пока не вошло в широкую клиническую практику. Являются ли нежелательные явления, зафиксированные в клинических исследованиях росиглитазона, класс-специфическими? Можно ли и в каких случаях назначать пиоглитазон в качестве моно- и комбинированной терапии?
Об обоснованности патогенетической терапии глитазонами, о перспективах использования производных тиазолидиндионов в российской клинической практике, а также об отечественном опыте применения фиксированной комбинации метформина и гликлазида речь шла во время симпозиума «Индивидуализация врачебной тактики в терапевтическом алгоритме сахарного диабета 2 типа», организованном компанией «АКРИХИН» в рамках VI Всероссийского эндокринологического конгресса.
Глобальная эпидемия сахарного диабета (СД) 2 типа обусловлена целым рядом факторов. Прежде всего, это старение населения и пандемия ожирения, вызванная снижением физической активности и повышением калорийности питания. Обязательным условием профилактики и лечения СД является изменение образа жизни, однако по причине низкой комплаентности пациентов эти предписания так и не становятся руководством к действию.
В этой связи на первый план выходит фармакотерапия пациентов с предиабетом и в начале заболевания. Учитывая, что важнейшим звеном патогенеза СД 2 типа является инсулинорезистентность, наиболее эффективной терапией на начальной стадии заболевания признаны сенситайзеры – препараты, повышающие чувствительность тканей к инсулину при наличии у пациента собственной достаточной его секреции. Согласно международным и российским рекомендациям, наряду с метформином препаратами первой линии в дебюте СД 2 типа являются тиазолидиндионы (глитазоны).
Хотя доказано, что глитазоны превосходят метформин в эффективности снижения резистентности к инсулину в мышечной и жировой тканях, применение этих препаратов пока не вошло в широкую клиническую практику. Являются ли нежелательные явления, зафиксированные в клинических исследованиях росиглитазона, класс-специфическими? Можно ли и в каких случаях назначать пиоглитазон в качестве моно- и комбинированной терапии?
Об обоснованности патогенетической терапии глитазонами, о перспективах использования производных тиазолидиндионов в российской клинической практике, а также об отечественном опыте применения фиксированной комбинации метформина и гликлазида речь шла во время симпозиума «Индивидуализация врачебной тактики в терапевтическом алгоритме сахарного диабета 2 типа», организованном компанией «АКРИХИН» в рамках VI Всероссийского эндокринологического конгресса.

![Рис. 1. Инсулинорезистентность при нарушенной толерантности к глюкозе (НТГ) и СД 2 типа, адаптировано по [2]](/upload/resize_cache/iblock/e59/195_350_1/e5925a79364a1f84e2ff82d47040b45e.jpg)
![Рис. 2. Инсулинорезистентный континуум, адаптировано по [3]](/upload/resize_cache/iblock/955/195_350_1/955f596d7245365da059682fbca0b989.jpg)
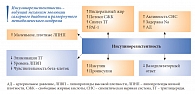
![Рис. 4. Возможные механизмы действия тиазолидиндионов на функцию бета-клеток, адаптировано по [4]](/upload/resize_cache/iblock/283/195_350_1/2832dbe0a8b0abf629d69c9417fc52f4.jpg)



В начале своего выступления д. м. н., профессор кафедры эндокринологии и диабетологии ГБОУ ДПО РМАПО Минздравсоцразвития Т.Ю. ДЕМИДОВА напомнила участникам симпозиума, что сахарный диабет (СД) 2 типа – заболевание, характеризующееся хронической гипергликемией, в основе патогенеза которого лежит снижение секреции инсулина, усиление липолиза, гиперпродукция глюкозы печенью, снижение захвата глюкозы периферическими тканями1. Одним из ключевых звеньев патогенеза СД является постепенно прогрессирующее нарушение – снижение чувствительности периферических тканей к инсулину (инсулинорезистентность). Еще в 1988 г. профессор G.M. Reaven показал, что инсулинорезистентность как общий патогенетический механизм связывает ожирение, нарушение углеводного, липидного обмена и прогрессирование сердечно-сосудистой патологии.
Изучение генетических факторов позволило установить, что инсулинорезистентность – полигенная патология, в развитии которой могут иметь значение мутации генов субстрата инсулинового рецептора (IRS-1 и IRS-2), бета-3-адренорецепторов, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (внутриклеточные транспортеры глюкозы), белков, связывающих жирные кислоты (FABR-II), и др. К факторам внешней среды относят высококалорийное питание, избыточную массу тела, недостаточную физическую активность, которая способствует развитию ожирения и снижает чувствительность скелетных мышц к инсулину.
На фоне развития инсулинорезистентности происходит стимуляция секреции инсулина, что приводит к истощению функции бета-клеток поджелудочной железы. G.M. Reaven и соавт. (1989) показали, что при неспособности бета-клеток обеспечивать гиперсекрецию инсулина наступает декомпенсация углеводного обмена, в первую очередь выражающаяся в повышении концентрации глюкозы в плазме крови натощак (рис. 1)2, затем – после нагрузки пищей (нарушение толерантности к глюкозе, НТГ), со временем развивается хроническая гипергликемия (СД 2 типа), которая, в свою очередь, оказывает глюкозотоксический, повреждающий, эффект на бета-клетки, что вызывает ухудшение их функции (рис. 2)3.
«Резистентность к инсулину – это многоликий феномен, который является ведущим механизмом эволюции сахарного диабета 2 типа и развернутого метаболического синдрома (МС)», – комментирует Татьяна Юльевна. Усвоение глюкозы нарушается не только клетками печени, но и такими инсулинзависимыми тканями, как мышечная и жировая (рис. 3). В области висцерального жирового депо накапливается жировая ткань, из которой высвобождаются свободные жирные кислоты (СЖК). Поступающие в печень СЖК активируют глюконеогенез, как следствие, индуцируется повышенная гепатическая продукция глюкозы. СЖК в системном кровотоке нарушают функцию инсулиновых рецепторов (эффект липотоксичности). Поскольку СЖК являются субстратами для синтеза триглицеридов (ТГ), в условиях инсулинорезистентности и гиперинсулинемии наблюдается гипертриглицеридемия, повышение концентрации холестерина липопротеидов низкой плотности (ХС-ЛПНП) и снижение содержания холестерина липопротеидов высокой плотности (ХС-ЛПВП).
Формирующаяся атерогенная дислипидемия является фактором риска развития сердечно-сосудистых заболеваний у больных с МС и СД 2 типа. Кроме того, при инсулинорезистентности нарушаются синтез и секреция оксида азота (NO) сосудистой стенкой. Поскольку NO не только оказывает вазодилатирующее действие, но и обладает антиатерогенными свойствами, нарушение этого механизма может способствовать как развитию артериальной гипертонии, так и атеросклероза. В свою очередь, гиперинсулинемия приводит к развитию артериальной гипертонии через увеличение реабсорбции натрия и воды почками, стимуляцию центров симпатической нервной системы и активацию Na+/H+-обмена в гладкомышечных стенках сосудов.
В лечении пациентов с инсулинорезистентностью (на стадии как НТГ, так и СД 2 типа) при сохраненной функции бета-клеток поджелудочной железы патогенетически обосновано применение тиазолидиндионов (глитазонов) – агонистов рецептора, активируемого пролифератором пероксисом (PPAR-гамма). Механизм действия препаратов этой группы направлен непосредственно на инсулинорезистентность (рис. 4)4: повышается захват глюкозы периферическими тканями (активируются ГЛЮТ-1 и ГЛЮТ-4, подавляется экспрессия фактора некроза опухоли, усиливающего инсулинорезистентность); уменьшается продукция глюкозы печенью; снижается концентрация СЖК и ТГ в плазме за счет подавления липолиза (повышается активность фосфодиэстеразы и липопротеинлипазы). Так, клиническое применение пиоглитазона показало: препарат позволяет снизить инсулинорезистентность на 27% и улучшить функцию бета-клеток на 40%.
В заключение профессор Т.Ю. Демидова подчеркнула, что возможные механизмы действия тиазолидиндионов на функцию бета-клеток, имеющие как непрямые (снижение липотоксичности, глюкозотоксичности), так и прямые эффекты (через PPAR-гамма), позволяют отдалять дебют СД 2 типа. Тиазолидиндионы уже более десяти лет считаются многообещающим классом препаратов именно для предупреждения развития диабета у лиц с инсулинорезистентностью и предиабетом. Профессор Т.Ю. Демидова выразила надежду, что «теперь, когда в арсенале эндокринолога появился качественный доступный дженерический препарат пиоглитазона Диаглитазон, наконец, удастся положить начало серьезной работе по профилактике диабета».
Профиль безопасности пиоглитазона: есть ли повод для дискуссии?
Способность тиазолидиндионов устранять инсулинорезистентность и сохранять функциональную активность бета-клеток поджелудочной железы представляет колоссальный интерес с точки зрения профилактики развития СД 2 типа и замедления его прогрессирования. Как отметил к. м. н., доцент кафедры эндокринологии Первого МГМУ им. И.М. Сеченова А.В. ЗИЛОВ, появление в 1990-х гг. первого препарата этого класса троглитазона было многообещающим в отношении перспектив использования глитазонов в профилактике сахарного диабета.
Высокая эффективность троглитазона в предупреждении развития СД 2 типа была показана в ходе исследования DPP (The Diabetes Prevention Program – Программа профилактики диабета). Однако через полтора года применения троглитазона препарат был исключен из исследования по причине гепатотоксичности5. Эффективность троглитазона в отношении профилактики развития СД 2 типа в группе лиц высокого риска была продемонстрирована T.A. Buchanan и соавт. (2002): у женщин с гестационным диабетом в анамнезе риск развития СД 2 типа на фоне терапии троглитазоном был на 55% ниже, чем у пациенток, получавших плацебо6.
Аналогичные результаты были получены в ходе исследования DREAM (Diabetes REduction Assessment with ramipril and rosiglitazone Medication – Оценка эффективности рамиприла и росиглитазона в снижении риска развития сахарного диабета): еще один препарат класса тиазолидиндионов росиглитазон на 62% эффективнее плацебо снижал риск развития СД у пациентов с нарушенной гликемией натощак и/или нарушенной толерантностью к глюкозе (НТГ)7. Еще более впечатляющие данные были получены R.A. DeFronzo и соавт. (2011), изучавшими влияние терапии пиоглитазоном на риск развития СД у лиц с НТГ, – риск развития СД 2 типа на фоне терапии пиоглитазоном был на 72% ниже, чем в группе плацебо-контроля8.
«Таким образом, был окончательно подтвержден класс-специфический эффект глитазонов в профилактике СД 2 типа, – комментирует Алексей Вадимович. – Кроме того, были получены данные исследований, в которых глитазоны, в частности пиоглитазон, в комбинации с метформином более эффективно, чем монотерапия метформином, снижали не только уровень HbA1c, но и риск гипогликемии. Все это способствовало формированию мнения о том, что тиазолидиндионы – весьма перспективный класс препаратов не только в лечении сахарного диабета, но и в профилактике его развития у лиц с нарушением углеводного и липидного обмена».
К середине 2000 г. стало ясно, что троглитазон (в силу особенностей химического строения) обладает выраженным гепатотоксическим действием, использование препарата в США было запрещено. Однако этот побочный эффект не свойственен двум другим препаратам класса – росиглитазону и пиоглитазону (оба зарегистрированы в Российской Федерации). Тем не менее эти два представителя глитазонов значительно различаются по тем плейотропным эффектам, которые они оказывают в отношении липидного спектра плазмы, сократимости сердечной мышцы, вазодилатации, артериального давления (АД), эндотелиальной функции и др. Так, было отмечено, что индекс атерогенности существенно ухудшается у пациентов, получающих росиглитазон, но значимо улучшается на фоне терапии пиоглитазоном.
Данные метаанализа 42 рандомизированных клинических исследований, в которых изучалась безопасность терапии росиглитазоном в сравнении с контрольной группой, получавшей другой сахароснижающий препарат или плацебо, дали основания говорить о повышенном риске развития инфаркта миокарда и смерти от кардиоваскулярных событий на фоне приема росиглитазона9.
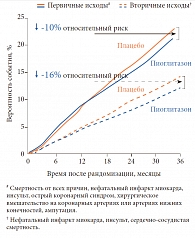
Эта работа S.E. Nissen и K. Wolski (2007) побудила клиницистов обратиться к пиоглитазону, поскольку опубликованные в 2005 г. результаты двойного слепого плацебоконтролируемого исследования PROactive (PROspective pioglitAzone Clinical Trial In macro Vascular Events – Проспективное клиническое исследование влияния пиоглитазона на риск макрососудистых осложнений) показали, что пиоглитазон снижает риск развития макрососудистых осложнений и смертность среди больных СД 2 типа10. В исследовании PROactive приняли участие 5238 больных СД 2 типа с макрососудистыми осложнениями в анамнезе, получавших до включения в исследование диетотерапию и сахароснижающую терапию другими препаратами. После рандомизации на две группы пациенты дополнительно к существующей терапии получали либо пиоглитазон (45 мг), либо плацебо.
Первичной конечной точкой был комбинированный показатель смертности от всех причин, нефатальный инфаркт миокарда, инсульт, острый коронарный синдром, хирургическое вмешательство на коронарных артериях или артериях нижних конечностей и ампутация. На фоне приема пиоглитазона в течение 3 лет наблюдалось снижение частоты осложнений сердечно-сосудистых заболеваний (ССЗ), в том числе с летальным исходом, на 10%. Отмечено также снижение смертности от сердечно-сосудистых причин, нефатального инфаркта миокарда и инсульта (вторичная конечная точка) на 16% в сравнении с плацебо (рис. 5)10.
Подтверждение положительного влияния пиоглитазона на липидный обмен (в отличие от росиглитазона) можно найти в нескольких исследованиях. Так, в работе M. Bajaj и соавт. (2003) показано, что у пациентов с СД 2 типа через 16 недель терапии пиоглитазоном (45 мг) содержание жира в ткани печени, определявшееся методом магнитнорезонансной спектроскопии, снизилось с 19,6 ± 3,6 до 10,4 ± 2,1% (p < 0,005)11. При сравнении «неглюкозных» эффектов росиглитазона и пиоглитазона было установлено, что пиоглитазон, в отличие от росиглитазона, способствует снижению уровня ТГ, повышению ХС-ЛПВП, а также демонстрирует снижение риска повторных острых инфарктов миокарда12.
Еще одним важным преимуществом пиоглитазона по сравнению с большинством сахароснижающих препаратов (особенно для пациентов, страдающих нарушением функции почек) является его положительное влияние на микроальбуминурию. Так, в ходе исследования Quartet отношение альбумин/креатинин в моче снижалось на 19% в группе пациентов с СД 2 типа, получавших пиоглитазон, и на 1% в группе терапии метформином (p = 0,002)13.
Далее А.В. Зилов более детально обрисовал профиль безопасности разрешенных к применению в России росиглитазона и пиоглитазона. К класс-специфическим побочным эффектам глитазонов докладчик отнес увеличение массы тела, задержку жидкости (отеки), риск развития/прогрессирования сердечной недостаточности, повышенный риск остеопоротических переломов. В настоящее время обсуждается вопрос правомерности ассоциирования терапии глитазонами с риском рака мочевого пузыря. К побочным эффектам, характерным исключительно для росиглитазона, но не для пиоглитазона (!), докладчик отнес неблагоприятное влияние на липидный обмен (повышение уровня ТГ, ХС-ЛПНП), риск развития инфаркта миокарда и смерти от кардиоваскулярных событий. Соответственно, пиоглитазон оказывает положительное влияние на липидный обмен (повышение ХС-ЛПВП, снижение ТГ, индекса атерогенности), имеет более высокий профиль кардиоваскулярной безопасности.
Терапевтические преимущества пиоглитазона в отношении безопасности со стороны сердечно-сосудистой системы были показаны в ходе многоцентрового, наблюдательного, ретроспективного исследования кардиоваскулярных нарушений на фоне использования глитазонов, проведенного D.J. Graham и соавт. (2010)14. Анализ медицинских карт 227 571 пациента с СД 2 типа в возрасте 65 лет и старше (средний возраст составил 74,4 года), получавших росиглитазон или пиоглитазон в течение 3 лет, подтвердил данные о том, что росиглитазон в сравнении с пиоглитазоном ассоциируется с повышенным риском острого инфаркта миокарда (относительный риск (ОР) 1,06), сердечной недостаточности (ОР 1,25), инсульта (ОР 1,27) и смерти (ОР 1,14)14.
Таким образом, при назначении тиазолидиндиона А.В. Зилов рекомендовал тщательное обследование больного с целью исключения наличия хронической сердечной недостаточности, диабетической ретинопатии (в связи с риском макулярного отека), остеопороза (особенно у женщин в постменопаузе), наличия (в том числе в анамнезе) рака мочевого пузыря или гематурии неизвестной этиологии. У пожилых пациентов терапию необходимо начинать с минимальных доз. «При выборе препарата класса тиазолидиндионов предпочтение следует отдавать пиоглитазону, – подчеркнул А.В. Зилов. – Недавно появившийся отечественный препарат пиоглитазона Диаглитазон выпускается в таблетках по 15, 30 и 45 мг пиоглитазона, что позволяет оптимизировать схемы терапии в зависимости от индивидуальных особенностей каждого пациента».
Оптимизация гликемического контроля: поиск компромиссов
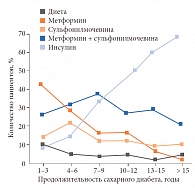
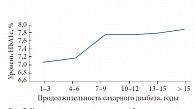
Заведующий кафедрой эндокринологии Нижегородской государственной медицинской академии, д. м. н., профессор Л.Г. СТРОНГИН ознакомил слушателей с данными о применяющихся в практике эндокринологов Нижнего Новгорода и области схемах сахароснижающей терапии (данные были получены по итогам работы передвижного федерального диагностического центра «Диамобиль») (рис. 6). Сравнительный анализ видов сахароснижающей терапии и уровня гликемического контроля (рис. 7) позволяют проследить следующую тенденцию. В течение первых пяти лет с момента диагностирования сахарного диабета удавалось поддерживать приемлемый контроль гликемии. При этом почти в 70% случаев применялась терапия метформином (42% в качестве монотерапии и 26% в составе комбинации с препаратом сульфонилмочевины), что соответствует действующим международным и российским рекомендациям.
В период 5–8 лет от начала заболевания наблюдается резкое ухудшение гликемического контроля. Анализ применяющихся у пациентов со «стажем» диабета 5–8 лет схем терапии показывает, что 5% пациентов вообще не получают медикаментозной терапии. Кроме того, 28% пациентов с продолжительностью СД 6 лет продолжают получать монотерапию метформином – по мнению Леонида Григорьевича, это слишком большой процент. Таким образом, ухудшение контроля заболевания в период 5–6 лет от его начала обусловлено тем, что, по всей видимости, не была своевременно проведена интенсификация терапии.
Профессор Л.Г. Стронгин считает, что следует преодолевать клиническую инертность и смело менять схему терапии. В качестве современного препарата выбора профессор Л.Г. Стронгин представил участникам симпозиума новый оригинальный препарат Глимекомб (единственная на рынке фиксированная комбинация метформина 500 мг и гликлазида 40 мг). Специалистам уже известны фиксированные комбинации метформина с глибенкламидом, доказавшие свою эффективность и удобство применения (два активных вещества в одной таблетке). Особо докладчик подчеркнул достоинства гликлазида как препарата сульфонилмочевины II поколения. «Сохраняя свойственный производным сульфонилмочевины высокий сахароснижающий эффект, гликлазид лишен такой класс-специфической характеристики, как риск развития гипогликемий, в том числе при нефропатии, – уточняет профессор Л.Г. Стронгин. – Кроме того, гликлазид характеризуется бета-клеточной протективностью и бета-клеточной селективностью, а также антиоксидантными свойствами».
Невысокая доза метформина, содержащаяся в составе Глимекомба, обеспечивает низкий риск развития нежелательных явлений со стороны желудочно-кишечного тракта. Препарат принимают 1–2 раза в день во время еды, дозу титруют не чаще, чем 1 таблетка в неделю. Эффективность Глимекомба изучалась в нескольких клинических исследованиях, проводившихся на территории Российской Федерации. Их положительные результаты позволили экспертам Российской ассоциации эндокринологов (РАЭ) рекомендовать широкое внедрение препарата Глимекомб в клиническую практику (информационное письмо РАЭ было опубликовано в журнале «Сахарный диабет». 2011. № 4).
Далее профессор Л.Г. Стронгин рассказал о собственном опыте применения фиксированной комбинации метформина и гликлазида в лечении больных СД 2 типа с неудовлетворительным гликемическим контролем. Эффективность и безопасность терапии Глимекомбом изучались в рамках открытого, нерандомизированного, неконтролируемого исследования («до и после») со сроком наблюдения 3 месяца. Перед началом исследования все пациенты прошли курс терапевтического обучения, а также были снабжены глюкометрами и тест-полосками для проведения самоконтроля.
Врачебный контроль осуществлялся в рамках визитов: начального, через 2 недели, через 1, 2 и 3 месяца терапии. Критериями включения в исследование являлись: установленный диагноз «сахарный диабет 2 типа», уровень HbA1c 7–10% на фоне предшествовавшей пероральной сахароснижающей терапии или HbA1c > 7,5% у ранее не получавших сахароснижающих препаратов. Применялись следующие критерии исключения: наличие показаний к инсулинотерапии, противопоказаний к применению метформина или его непереносимость, предшествующее лечение инсулином или комбинацией более двух сахароснижающих препаратов, неверифицированный диагноз СД 2 типа.
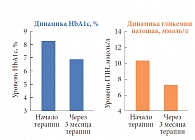
В исследовании приняли участие 23 пациента (18 женщин, 5 мужчин), средний возраст которых составил 62,6 ± 5,73 года, страдающих ожирением 1-й степени, с длительностью диабета в среднем 3,5 года и средним уровнем HbA1c 8,2%. До включения в исследование 4 участника (17%) не получали сахароснижающую терапию, 8 пациентов (34%) принимали метформин, 4 (17%) – сульфонилмочевину и 7 (30,4%) – комбинацию метформина и сульфонилмочевины. По окончании 3-месячной терапии Глимекомбом уровень HbA1c в среднем снизился на 1,3%, а уровень глюкозы плазмы натощак – до 7,4 ммоль/л (рис. 8).
«На фоне терапии Глимекомбом у 21 из 23 пациентов (91,3%) удалось достичь улучшения гликемического контроля, у 16 пациентов (69,6%) – индивидуального целевого уровня HbA1c. Самый высокий результат – среднее снижение уровня HbA1c на 31,3% – наблюдался у пациентов, ранее не получавших антидиабетической терапии. Самые низкие результаты – снижение уровня HbA1c в среднем на 9,8% – отмечались у пациентов, ранее леченных комбинацией “метформин + сульфонилмочевина”, причем у 2 из 7 пациентов не отмечено улучшения гликемического контроля (оба ранее получали комбинацию “метформин + глибенкламид”)». На старте исследования пациенты принимали в среднем 2 таблетки Глимекомба в сутки, через месяц большинству доза была увеличена и 79,3% участников исследования принимали 3 таблетки в сутки, а 26,1% – 4–5 таблеток. Спустя 3 месяца терапии суточная доза препарата составила в среднем 3 таблетки в день.
На фоне терапии Глимекомбом было отмечено незначительное статистически недостоверное снижение индекса массы тела (ИМТ), что в целом свидетельствует о метаболической нейтральности Глимекомба. У одной больной отмечался специфичный для метформина желудочно-кишечный дискомфорт, не потребовавший отмены препарата. В период наблюдения ни у одного из пациентов не наблюдались симптоматические гипогликемии, однако при анализе дневников самоконтроля у 6 пациентов были зарегистрированы гипогликемические эпизоды (уровень гликемии < 3,9 ммоль/л). Данные биохимического анализа крови не продемонстрировали динамики показателей липидного обмена, почечных и печеночных функций. Таким образом, основываясь на собственном клиническом опыте, профессор Л.Г. Стронгин рекомендовал применять Глимекомб в следующих случаях:
- для интенсификации терапии у пациентов, не достигающих компенсации СД
- на монотерапии метформином,
- на монотерапии препаратами сульфонилмочевины;
- для интенсификации терапии в составе комбинации из трех и более сахароснижающих препаратов;
- для инициации терапии у пациентов при уровне HbA1c > 7,5% и при отсутствии показаний к неотложной инсулинотерапии.
Симпозиум компании «АКРИХИН» «Индивидуализация врачебной тактики в терапевтическом алгоритме сахарного диабета 2 типа» При выборе препарата класса тиазолидиндионов предпочтение следует отдавать пиоглитазону. Он оказывает положительное влияние на липидный обмен (повышение ХС-ЛПВП, снижение ТГ, индекса атерогенности), имеет более высокий профиль кардиоваскулярной безопасности.
Подводя итоги, председатель симпозиума, директор Института диабета ФГБУ «Эндокринологический научный центр», д. м. н., член-корреспондент РАМН, профессор М.В. ШЕСТАКОВА отметила, что практикующим врачам следует смелее внедрять в свою клиническую практику современные препараты. Особо Марина Владимировна подчеркнула доступность препаратов производства отечественной компании «АКРИХИН» для российских врачей и пациентов. В отношении препарата Глимекомб профессор М.В. Шестакова выразила надежду, что компания-производитель со временем расширит линейку дозировок за счет увеличения дозы метформина, что позволит врачу варьировать лечебную тактику и в конечном счете будет способствовать более широкому применению препарата.
В этой связи на первый план выходит фармакотерапия пациентов с предиабетом и в начале заболевания. Учитывая, что важнейшим звеном патогенеза СД 2 типа является инсулинорезистентность, наиболее эффективной терапией на начальной стадии заболевания признаны сенситайзеры – препараты, повышающие чувствительность тканей к инсулину при наличии у пациента собственной достаточной его секреции. Согласно международным и российским рекомендациям, наряду с метформином препаратами первой линии в дебюте СД 2 типа являются тиазолидиндионы (глитазоны).
Хотя доказано, что глитазоны превосходят метформин в эффективности снижения резистентности к инсулину в мышечной и жировой тканях, применение этих препаратов пока не вошло в широкую клиническую практику. Являются ли нежелательные явления, зафиксированные в клинических исследованиях росиглитазона, класс-специфическими? Можно ли и в каких случаях назначать пиоглитазон в качестве моно- и комбинированной терапии?
Об обоснованности патогенетической терапии глитазонами, о перспективах использования производных тиазолидиндионов в российской клинической практике, а также об отечественном опыте применения фиксированной комбинации метформина и гликлазида речь шла во время симпозиума «Индивидуализация врачебной тактики в терапевтическом алгоритме сахарного диабета 2 типа», организованном компанией «АКРИХИН» в рамках VI Всероссийского эндокринологического конгресса.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />