количество статей
6422
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
IV Международная междисциплинарная конференция “Manage pain”: Терапия боли: быстрее, выше, сильнее
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология и психиатрия" №1
- Аннотация
- Статья
- Ссылки
На сегодняшний день в арсенале врачей имеется немало препаратов как для симптоматической, так и для патогенетической терапии боли различного генеза. К сожалению, не все лекарственные средства отвечают современным требованиям к анальгезирующей терапии, главными из которых являются максимально быстрый и как можно более выраженный обезболивающий эффект, хорошая переносимость и высокий профиль безопасности. Вопросам выбора препаратов, основанного на объективных клинических и параклинических критериях, был посвящен симпозиум, организованный при поддержке компании «Берлин Хеми/А. Менарини».

профессор Э.Ю. Соловьева

А.Н. Баринов

И.А. Строков
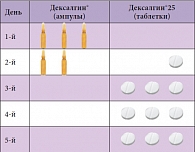
Таблица. Схема лечения острого болевого синдрома препаратом Дексалгин®
Нестероидные противовоспалительные препараты (НПВП) являются одними из наиболее часто применяемых в клинической практике лекарственных средств, при этом прием некоторых из них не оказывает ожидаемого эффекта и сопровождается развитием выраженных побочных действий. Что надо знать врачу о факторах, которые влияют на эффективность и профиль безопасности анальгетической терапии? Д.м.н., профессор кафедры неврологии ФУВ РНИМУ им. Н.И. Пирогова Элла Юрьевна СОЛОВЬЕВА подчеркнула, что необходимым условием выбора оптимального препарата и успешного лечения является уточнение патогенеза болевого синдрома. Ноцицептивная боль возникает при раздражении периферических болевых рецепторов – ноцицепторов, локализованных практически во всех органах и системах, а невропатическая боль – при повреждении различных отделов (периферического и центрального) соматосенсорной нервной системы. Однако в практике невролога, травматолога, онколога часто встречаются болевые синдромы смешанного происхождения, когда в клинической картине заболевания наблюдаются симптомы как ноцицептивной, так и невропатической боли (например, при компрессии опухолью нервного ствола, раздражении межпозвонковой грыжей спинномозгового нерва или компрессии нерва в костном или мышечном канале).
При ноцицептивной боли, которая связана с раздражением именно болевых рецепторов, любая длительная активация ноцицептора, независимо от того, какой стимул ее вызывает, формирует эндогенное воспаление. Препаратами выбора в этом случае являются НПВП. Надо сказать, что средний терапевтический эффект у различных НПВП одинаков при соответствующем режиме дозирования, однако индивидуальный ответ на них может различаться. Существуют вариации ответа даже у одного и того же больного в течение суток, что связано с циркадными колебаниями, активностью метаболических ферментов, определяющих фармакокинетику и фармакодинамику препаратов. Профессор Э.Ю. Соловьева более подробно рассмотрела причины индивидуальных различий в ответе на НПВП. Во-первых, несмотря на общие физико-химические характеристики, каждый нестероидный противовоспалительный препарат обладает уникальными особенностями. Во-вторых, ответ на НПВП может зависеть от режима дозирования, что связано с фармакокинетикой конкретного средства. В-третьих, фармакодинамические особенности препарата, его физико-химические свойства, механизм действия могут не совпадать с механизмом развития заболевания у конкретного больного.
На что необходимо обращать внимание при выборе НПВП? Прежде всего, на соотношение токсичности и эффективности препарата – так называемый терапевтический индекс, который преимущественно зависит от физико-химических свойств. Считается, что анальгетический эффект во многом обусловлен липофильностью НПВП. Жирорастворимые НПВП легко проникают в центральную нервную систему и тем самым обеспечивают бóльший центральный эффект. Однако очень часто недооцениваются побочные явления (головная боль, депрессия, умеренные нарушения когнитивной функции), которые развиваются на фоне приема таких НПВП с центральным механизмом действия, обладающих большей липофильностью. НПВП – это в основном слабые кислоты. В этой связи для эффективного проникновения в клетку очень большое значение имеет рН окружающей среды: чем среда кислее, тем выше потенциальные клеточные эффекты. Следовательно, при назначении пероральных форм необходимо учитывать, что кислотность желудочной среды существенно влияет на всасывание препарата.
Часто врачи рекомендуют сочетать прием НПВП с антацидными средствами с целью профилактики гастроинтестинальных осложнений, но такой режим приема может снизить эффект НПВП. В идеале, если у пациента нет заболеваний желудочно-кишечного тракта, НПВП должны приниматься либо за полчаса до еды, либо через два часа после еды. Среди физико-химических свойств НПВП важным является наличие нескольких изоформ. Этот феномен получил название хиральности, когда трехмерное репозиционирование дает возможность получить несколько форм одной и той же молекулы. Различают S- и R-изомеры, при этом терапевтическим эффектом обладает только S(+)-молекула. Многие из НПВП являются рацематами – смесью из S- и R-изомеров. Так, ибупрофен и фенилпрофен подвергаются инверсии неактивного R(-)-изомера в активный S(+)-изомер, этодолак и кеторолак имеют более низкую концентрацию в плазме активного S(+)-изомера и большую – неактивного R(-)-изомера.
Среди современных НПВП следует отметить препарат декскетопрофена трометамол (Дексалгин®) – новую форму лекарственного вещества с 99%-ным участием правостороннего S(+)-изомера. Способ его получения – сложная биотехнологическая реакция с применением методов генной инженерии (разделение на два изомера и последующая очистка S(+)-изомера от балласта). Трометамоловая соль улучшает химические и физические свойства декскетопрофена. Наиболее важным отличием от кетопрофена, терапевтическая дозировка которого составляет 100 мг, является то, что терапевтическая доза препарата Дексалгин®, за счет удаления балластной изомерной структуры, составляет 50 мг. Если эффективность терапевтических доз препаратов сопоставима, то профиль безопасности выше у того препарата, который назначается в более низкой дозе. Декскетопрофен проникает через гематоэнцефалический барьер, поэтому обладает как центральным (замедляет прохождение болевого импульса), так и периферическим (способствует снятию воспаления за счет угнетения выработки простагландинов, что приводит к уменьшению сенсибилизации нервных окончаний) механизмами действия. Препарат Дексалгин® очень легко растворяется в воде и быстро абсорбируется слизистой оболочкой, поэтому наряду с эффективностью он обладает еще и быстродействием.
Так, пик концентрации препарата наступает приблизительно через 30 минут (15–60 минут), а результат анальгезии пациенты отмечают уже на 15-й минуте от момента введения. При остром болевом синдроме лечение препаратом Дексалгин® начинают с инъекций в течение двух дней, далее переходя на пероральную форму (таблица). Среди физико-химических свойств, определяющих эффективность НПВП, необходимо отметить фармакокинетические особенности, связанные с абсорбцией (она происходит путем пассивной диффузии). Сопутствующие дисфункции желудочно-кишечного тракта практически не влияют на всасывание, если нет таких заболеваний, как дивертикулез кишечника, язвенный колит, болезнь Крона. Но обструкция кишечника может изменять скорость превращения неактивных R(-)-изомеров в активные S(+)-изомеры. Например, чем дольше неактивная форма ибупрофена находится в кишечнике, тем выше будет концентрация активной формы препарата в плазме. Следовательно, для ибупрофена предпочтителен прием препарата во время или сразу после еды.
Важной фармакокинетической особенностью НПВП является распределение в плазме. Более 90% НПВП активно связывается с альбумином. Не связанная с альбумином часть является активной и определяет терапевтические и токсические свойства препарата. Любые состояния, которые сопровождаются снижением уровня альбумина в плазме и возможностью связываться с ним, ведут к увеличению риска развития побочных эффектов. Высокая степень связывания с альбумином характерна для салицилатов, ибупрофена, напроксена. На сегодняшний день подтверждена зависимость выраженности нежелательных реакций от концентрации НПВП. Особенно важно это учитывать при замене одного противовоспалительного препарата на другой. Длительность паузы должна составлять не менее трех периодов полувыведения отмененного препарата. Особого внимания требует сочетанный прием НПВП и других лекарственных препаратов: кортикостероидов, непрямых антикоагулянтов, циклофосфанов, парацетамола. Риск развития осложнений со стороны желудочно-кишечного тракта при сочетанном применении НПВП с аспирином повышается в 8 раз, кортикостероидами – в 8,5 раз, парацетамолом – в 16,5 раз, при сочетанном приеме различных НПВП риск желудочно-кишечных осложнений возрастает в 18 раз.
Большинство НПВП метаболизируется в печени путем окисления и связывания. Для клинициста важна оценка длительности действия препарата. У препаратов с коротким периодом полувыведения – до 4 часов (диклофенак натрия, ибупрофен, кетопрофен, фенопрофен) – эффект от лечения должен оцениваться не ранее чем через несколько дней, а не к концу приема первой дозы, у препаратов с периодом полувыведения 4–12 часов (напроксен, сулиндак) – через неделю, а у препаратов с периодом полувыведения более 12 часов (фенилбутазон, пироксикам) – через 2–3 недели от момента назначения лекарственного препарата. Дисфункция печени может замедлить метаболизм НПВП, поэтому нестероидные средства, для которых основной метаболический путь связан с окислением в печени, должны назначаться в меньших дозах. Ибупрофен, пироксикам, теноксикам, диклофенак, сулиндак, флурбипрофен, набуметон при тяжелых поражениях паренхимы печени противопоказаны.
Большинство НПВП выводится с желчью и мочой, но некоторые из них при выделении с желчью подвергаются обратному всасыванию, вновь попадая в печень, что способствует длительной экспозиции препарата в кишечнике. Это может стать причиной длительной НПВП-индуцированной энтеропатии. Кишечнорастворимая оболочка уменьшает риск развития осложнений со стороны желудка и двенадцатиперстной кишки, в частности кровотечений, однако не является стопроцентной гарантией отсутствия гастроинтестинальных осложнений. В этой связи очень важным аспектом является селективность нестероидных противовоспалительных препаратов. Заболевания почек и снижение их функции в пожилом возрасте могут снизить клиренс НПВП у этой категории больных. Что же касается сердечно-сосудистых осложнений, представляют интерес данные метаанализа 138 рандомизированных исследований, где оценивался риск развития атеротромбоза при приеме НПВП (как селективных, так и неселективных)1. Установлено, что нежелательные явления со стороны сердечно-сосудистой системы у больных, принимающих НПВП обеих групп, следует считать специфическим эффектом, характерным для всей группы препаратов в целом.
При выборе НПВП, по словам профессора Э.Ю. Соловьевой, важно обращать внимание на препараты с независимыми от циклооксигеназы (ЦОГ) механизмами, наличие которых во многом объясняет разницу в силе анальгетического эффекта. Среди ЦОГ-независимых механизмов можно выделить ингибирование активных форм кислорода, окиси азота и интерлейкина 6, стимуляцию выработки эндогенных опиатов: эндорфина и динорфина, угнетение выработки палочкоядерных лейкоцитов и выработку тромбоцитарного фактора роста, усиление образования хряща. Одним из НПВП, обладающих ЦОГ-независимыми механизмами, является нимесулид. Современной лекарственной формой нимесулида является препарат Нимесил®. Благодаря гранулированной форме выпуска препарат быстрее всасывается и лучше растворяется, в отличие от таблетированных форм, что способствует более быстрому наступлению анальгетического эффекта. Нимесил® рекомендуется назначать по 100 мг 2 раза в сутки. Срок лечения составляет не более 15 дней, инструкция препарата обращает на это особое внимание.
В заключение профессор Э.Ю. Соловьева отметила, что перед назначением любого НПВП необходимо тщательно ознакомиться с инструкцией, оценить химико-физические свойства, включая липофильность, период полувыведения, основные пути метаболизма, степень концентрации в синовиальной жидкости, обратить внимание на феномен хиральности и наличие ЦОГ-независимых терапевтических механизмов, а также на лекарственную форму препарата.
Боль в спине: эволюция парадигмы
Основные этапы истории лечения болей в спине и новые подходы к решению этой проблемы охарактеризовал Алексей Николаевич БАРИНОВ, старший научный сотрудник отдела неврологии и клинической нейрофизиологии Первого МГМУ им. И.М. Сеченова. Для купирования болевого синдрома в разное время использовались различные методы. Гиппократ применял тракционные методы лечения заболеваний опорно-двигательного аппарата (называл это воздействие рахитотерапией). В средние века вошли в практику деривативные кровопускания (кровь выпускалась из сосудов в области напряженных участков мышц, и воздействие шло непосредственно на триггерные зоны). Наряду с кровопусканием большую популярность приобрело клизмирование. В XIX веке была научно обоснована эффективность экстракта коры ивы (салицина) для лечения острого ревматизма. Самыми распространенными из анальгетиков в конце XIX века были опий и препараты на его основе, причем применялись они как у взрослых, так и у детей, страдающих любыми болями и недомоганиями. В конце XIX века в Миссури Э.Т. Стилом была создана школа остеопатии, а в штате Айова Д. Балкером – школа хиропрактики, к этим методам лечения до сих пор активно прибегают в США.
В отечественную неврологическую науку XX века большой вклад внесли знаменитые советские врачи Я. Попелянский и В. Веселовский. Долгое время радикулит (патология корешков спинного мозга) считали воспалительным, простудным или инфекционным заболеванием, больным рекомендовался строгий постельный режим и прием антибиотиков. Установив в 1960-х гг. роль дегенеративно-дистрофических нарушений позвоночника, названных им остеохондрозом, Я. Попелянский основал новый раздел неврологии – вертеброневрологию. Больные стали получать противовоспалительные препараты, большое значение придавалось мануальной терапии. Однако и эти выводы были, в свою очередь, подвергнуты критическому переосмыслению. Было установлено отсутствие прямой связи между степенью выраженности дегенеративных изменений позвоночника и болевым синдромом: только каждый девятый пациент, имеющий дегенеративные изменения, испытывает боль. Кроме того, отсутствует корреляция выраженности болевого синдрома с размером и локализацией межпозвоночной грыжи, а также сохранность патологических изменений анатомических структур при наличии рецидивирующего течения.
В этой связи изменилась парадигма терапии боли в спине, главной целью лечения стала не коррекция дегенеративных изменений, а купирование воспалительного процесса в мышце. Существовавшая ранее концепция о том, что остеохондроз нужно лечить внутримышечным введением хондропротекторов, была признана несостоятельной. В настоящее время считается, что боль в спине может быть вызвана специфическими причинами (патология межпозвоночного диска с рефлекторными и компрессионными синдромами, метаболические нарушения (остеопороз), воспалительные процессы и опухоли). Однако в подавляющем большинстве случаев (90%) у пациента развивается неспецифическая боль в спине (код по МКБ-10 – М54.Дорсалгия). Чаще всего причинами ноцицептивных болей в спине являются миофасциальные боли и функциональные нарушения (обратимое блокирование) межпозвонкового сустава с рефлекторными синдромами. Как правило, эта боль связана с образом жизни современного человека, в частности с гиподинамией.
Стандарты лечения острой боли в спине подразумевают назначение НПВП, миорелаксантов, проведение мануальной терапии, поддержание привычной физической активности. Постельный режим, как и лечебная физкультура, при сохранении болевого синдрома не рекомендованы. От операционных вмешательств следует отказаться. Несмотря на это, более 20% пациентов с болью в спине прибегают к хирургическим методам лечения, хотя на самом деле хирургическая патология межпозвоночного диска в структуре болей в спине встречается всего в 5% случаев. Что касается выбора оптимального НПВП, А.Н. Баринов обратил внимание на фармацевтические особенности, определяющие эффективность и профиль безопасности НПВП: хиральность, полярность, размеры частиц, форма кристаллов, вспомогательные вещества, липо- и гидрофильность. Так, например, R(-)-изомер кетопрофена лишен фармакоактивности, токсичен, чаще вызывает побочные эффекты со стороны желудочно-кишечного тракта. S(+)-изомер кетопрофена – это мощный анальгетик с высокой противовоспалительной активностью и сниженной токсичностью. Например, декскетопрофен (Дексалгин®) лишен R(-)-изомера, что позволяет снизить риск возникновения побочных эффектов и достичь анальгетического эффекта с использованием меньших доз препарата, в сравнении с его рацемическим предшественником – кетопрофеном. Кроме того, Дексалгин® обладает двойным механизмом действия: центральным (блокада ЦОГ-2 и синтеза простагландинов в сенситизированных структурах головного и спинного мозга) и периферическим (блокада ЦОГ и синтеза простагландинов в очаге воспаления).
В некоторых случаях, например при фасеточном синдроме, короткого курса НПВП может быть недостаточно. Это связано с тем, что лечение фасеточного синдрома включает не только снятие боли и воспаления в суставе (путем назначения НПВП и глюкокортикостероидов, которые вводятся непосредственно в фасеточный сустав либо периартикулярно), но и предупреждение разрушения хрящевой ткани. Патогенетическое лечение подразумевает назначение хондропротекторов, которые тормозят разрушение хрящевой такни и через 2–3 месяца применения способствуют уменьшению выраженности болевого синдрома. Однако хондропротекторы показаны исключительно при фасеточном синдроме и ни в коем случае – при миофасциальном болевом синдроме. В заключение А.Н. Баринов отметил, что на примере изменения парадигмы лечения боли в спине прослеживается необходимость критического отношения к информации. Новые методы лечения, приходящие на смену старым, также могут быть подвергнуты переосмыслению, без этого дальнейшее развитие науки невозможно.
Болевой синдром при диабетической полиневропатии:эффективность патогенетической терапии
По данным, которые озвучил доцент кафедры нервных болезней Первого МГМУ им. И.М. Сеченова Игорь Алексеевич СТРОКОВ, к 2030 г., по прогнозу Всемирной организации здравоохранения, каждый 10-й человек будет страдать сахарным диабетом. Следовательно, важно знать, как предупреждать и лечить не только основное заболевание (сахарный диабет), но и его осложнения. Одним из наиболее тяжелых и распространенных осложнений сахарного диабета является диабетическая полиневропатия, которой страдают более 50% больных сахарным диабетом. Так, при длительности течения заболевания более 10 лет уже 40% пациентов имеют симптомную диабетическую полиневропатию. Считается, что болевой синдром наблюдается приблизительно у 25–30% больных с диабетической полиневропатией, при этом в 95% случаев он развивается на фоне дистальной симметричной сенсорно-моторной полиневропатии. Как правило, боль при диабетической полиневропатии локализуется в нижних конечностях, носит жгучий, стреляющий характер, но при этом имеет невысокую среднюю интенсивность: по визуальной аналоговой шкале она варьирует от 4 до 7 см.
Каковы основные методы лечения невропатической боли, в том числе и боли при диабетической полиневропатии? Первый путь – это воздействие на периферические механизмы с целью блокады натриевых каналов (лидокаин, карбамазепин, топирамат, ламотриджин и др.). Второй путь – уменьшение центральной сенситизации (габапентин и прегабалин). Третий – снижение болевой чувствительности путем активации нисходящих антиноцицептивных сигналов и угнетения передаточных нейронов спиноталамического тракта (амитриптилин, опиоиды, трамадол). Появляются и новые подходы к лечению боли, которые находятся на стадии клинических и экспериментальных исследований (возможности применения ацетил-L-карнитина, лакосамида – антиконвульсанта, который преимущественно действует на натриевые/кальциевые каналы, пластыря с капсаицином, хирургическая декомпрессия нервов, стимуляция спинного мозга, внутрикостная блокада).
И.А. Строков предложил рассмотреть возможность воздействия на патогенетические механизмы болевой диабетической полиневропатии. М. Brownlee изложил основные положения о биохимических и молекулярных основах развития диабетической полиневропатии. Окислительный стресс вызывает повреждение митохондриальной ДНК, в ответ на повреждение ДНК активизируются специальные регенеративные полимеразы (PARP), что приводит к блокаде обмена глюкозы и накоплению промежуточных продуктов обмена. Накопление промежуточных продуктов обмена глюкозы, в свою очередь, вызывает образование большого количества конечных продуктов избыточного гликирования (advanced glicated end products, AGEs). В процесс вовлекаются эндотелиальные и нервные клетки, в результате чего формируется патология сосудов микроциркуляторного русла и периферических нервов. Таким образом, метаболические нарушения приводят к нарушениям микроциркуляции, которые начинают играть самостоятельную роль в патогенезе заболевания. Учитывая вышесказанное, препараты, влияющие на окислительный стресс, способны значительно уменьшить болевые ощущения.
Наиболее широко для патогенетического лечения диабетической полиневропатии применяется альфа-липоевая кислота, которая является мощным антиоксидантом и, кроме этого, улучшает эндоневральный кровоток и транспорт глюкозы. В экспериментах показано, что альфа-липоевая кислота не только уменьшает проявления окислительного стресса, то есть влияет на сосудистый компонент, но и стимулирует синтез фактора роста нервов и угнетает образование конечных продуктов гликирования. И.А. Строков подчеркнул, что альфа-липоевая кислота включена в Европейские рекомендации как «единственное патогенетическое средство лечения диабетической полиневропатии с доказанной в 9 рандомизированных контролируемых исследованиях эффективностью» (уровень доказательности – класс А)2. Одним из самых продаваемых в нашей стране препаратов альфа-липоевой кислоты (и, следовательно, препаратом, в отношении которого у врачей накоплен наибольший опыт) является Берлитион®.
Экспериментальные работы F. Low (1998) показали, что альфа-липоевая кислота увеличивает скорость проведения электрического импульса по нерву и влияет на эндоневральный кровоток. В исследовании ORPIL (ORal PILot Study), в котором пациенты с сахарным диабетом 2 типа получали альфа-липоевую кислоту в дозе 1800 мг/сут, было установлено достоверное улучшение эндоневральной функции после 3 недель лечения3. Результаты исследования ORPIL позволили сделать вывод о том, что клиническая эффективность 1800 мг альфа-липоевой кислоты при пероральном приеме аналогична эффекту внутривенного введения 600 мг. Полученные результаты коррелируют с данными о том, что уровень содержания альфа-липоевой кислоты в плазме при этих двух формах приема одинаков. Позже в исследовании SYDNEY II (Symptomatic Diabetic Neuropathy Study) было установлено оптимальное соотношение безопасности и эффективности пероральной дозы альфа-липоевой кислоты в 600 мг (увеличение дозы не приводило к повышению эффективности терапии)4.
В ходе исследования SYDNEY была доказана достоверная эффективность альфа-липоевой кислоты при внутривенном введении в отношении всех сенсорных феноменов (стреляющая боль, жжение, парестезии, онемение)5. После лечения наблюдалось значимое (p < 0,001) улучшение по шкале Total Symptom Score (TSS). Помимо быстрого улучшения сенсорных симптомов наблюдалась редукция процессов дегенерации нервных волокон. D. Ziegler и соавт. провели метаанализ 4 исследований с внутривенным введением альфа-липоевой кислоты в дозе 600 мг пациентам с диабетической полиневропатией6. Выявлен достоверно лучший эффект альфа-липоевой кислоты в отношении всех сенсорных феноменов в сравнении с плацебо (p < 0,05). Среди отдельных симптомов в наибольшей степени уменьшалось жжение. Исследование 2010 г. подтвердило, что внутривенное введение альфа-липоевой кислоты за короткий период приводит к уменьшению болевого синдрома при диабетической полиневропатии7.
Все это подтверждает возможность и необходимость применения альфа-липоевой кислоты с целью уменьшения сенсорных феноменов, в том числе и болевых. И.А. Строков подчеркнул необходимость комплексного лечения диабетической полиневропатии: с одной стороны, симптоматическая терапия для уменьшения интенсивности боли; с другой – патогенетическая терапия, которая восстанавливает функциональное состояние нерва, способствуя стабильному длительному эффекту.
Заключение
В рамках симпозиума были рассмотрены вопросы выбора оптимальной терапии при боли в спине и диабетической полиневропатии. Отмечалось, что стратегия терапии должна основываться на патогенезе болевого синдрома. Ноцицептивная боль возникает при раздражении периферических болевых рецепторов – ноцицепторов, а невропатическая боль – при повреждении различных отделов периферической и центральной соматосенсорной нервной системы. Чаще всего причинами ноцицептивных болей в спине являются миофасциальные боли и функциональные нарушения (обратимое блокирование) межпозвонкового сустава с рефлекторными синдромами. При ноцицептивной боли, которая связана с раздражением болевых рецепторов, препаратами первой линии терапии являются НПВП. При выборе НПВП следует оценивать физико-химические свойства, включая липофильность, период полувыведения, основные пути метаболизма, следует обратить внимание на феномен хиральности, а также на наличие ЦОГ-независимых терапевтических механизмов и лекарственную форму препарата.
Было отмечено, что декскетопрофена трометамол (препарат Дексалгин®) – правовращающийся S-энантиомер кетопрофена – позволяет достичь анальгетического эффекта с использованием меньших доз в сравнении с кетопрофеном, на фоне снижения риска возникновения побочных эффектов. Декскетопрофен проникает через гематоэнцефалический барьер, поэтому обладает и центральным (блокада ЦОГ-2 и синтеза простагландинов в сенситизированных структурах головного и спинного мозга), и периферическим (блокада ЦОГ и синтеза простагландинов в очаге воспаления) механизмами действия. Одним из типичных примеров невропатической боли является боль при диабетической полиневропатии, основными методами лечения которой являются симптоматическая и патогенетическая терапия. Симптоматическая терапия подразумевает назначение средств с целью уменьшения интенсивности боли, а патогенетическая терапия преследует цель восстановить функциональное состояние нерва, способствуя стабильному длительному эффекту. Единственными патогенетическими средствами для лечения диабетической полиневропатии признаны препараты альфа-липоевой кислоты (например, препарат Берлитион®). Альфа-липоевая кислота является мощным антиоксидантом и, кроме этого, улучшает эндоневральный кровоток и транспорт глюкозы, стимулирует синтез фактора роста нерва и угнетает образование конечных продуктов избыточного гликирования.
1. Kearney P.M., Baigent C., Godwin J. et al. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials // BMJ. 2006. Vol. 332. № 7553. P. 1302–1308.
2. Tesfayes S., Boulton A.J., Dyck P.J. et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments // Diabetes Care. 2010. Vol. 33. № 10. P. 2285–2293.
3. Ruhnau K.J., Meissner H.P., Finn J.R. et al. Effects of 3-week oral treatment with the antioxidant thioctic acid (alpha-lipoic acid) in symptomatic diabetic polyneuropathy // Diabet. Med. 1999. Vol. 16. № 12. P. 1040–1043.
4. Ziegler D., Ametov A., Barinov A. et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial // Diabetes Care. 2006. Vol. 29. № 11. P. 2365–2370.
5. Аметов А.С., Лаврова И.Н., Строков И.А. и др. Альфа-липоевая кислота в лечении симптомной диабетической полиневропатии: symptomatic diabetic neuropathy (SYDNEY) trial // Фарматека. 2004. Т. 11. № 88. С. 69–73.
6. Ziegler D., Nowak H., Kempler P. et al. Treatment of symptomatic diabetic polyneuropathy with antioxidant alpha-lipoic acid: a meta-analysis // Diabet. Med. 2004. Vol. 21. № 2. P. 114–121.
7. Mijnhout G.S., Alkhalaf A., Kleefstra N. et al. Alpha-lipoic acid: a new treatment for neuropathic pain in patients with diabetes? // Neth. J. Med. 2010. Vol. 68. № 4. P. 158–162.
Новости на тему
02.08.2022 01:00:00
СТАТЬИ по теме
09.04.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
