Карцинома Меркеля: современные возможности терапии
- Аннотация
- Статья
- Ссылки
- English
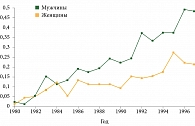
Согласно классификации Всемирной организации здравоохранения карцинома Меркеля (КМ) – редкая злокачественная первичная опухоль кожи с эпителиальной и нейроэндокринной дифференцировкой [1]. Исходя из современных эпидемиологических данных США и некоторых стран Европы, заболеваемость КМ продолжает увеличиваться. По данным базы SEER (Surveillance, Epidemiology and End Results database), заболеваемость в 2006 г. составила 0,6 случая на 100 000 (0,15 случая на 100 000 в 1986 г.) (рис. 1) с преобладанием мужчин (60%). Ежегодно в США регистрируется около 1500 новых случаев КМ [2]. Эпидемиологических данных по Российской Федерации нет.
Несмотря на рост заболеваемости в мире, КМ остается редкой болезнью, что позволяет относить ее к так называемым орфанным заболеваниям.
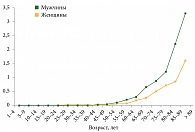
Одним из факторов риска развития КМ, скорее всего влияющих на рост заболеваемости, является возраст старше 65 лет (рис. 2). Средний возраст большинства пациентов (71,6%) на момент постановки диагноза – 69–70 лет [3]. При этом наблюдается 5–10-кратное увеличение заболеваемости среди пациентов старше 70 лет по сравнению с пациентами в возрасте до 60 лет.
Факторы риска
Увеличение риска развития КМ связывают с длительным пребыванием на солнце, воздействием ультрафиолетовых лучей. Подтверждение тому – частая локализация КМ на открытых, наиболее подверженных воздействию солнечных лучей участках кожи (голова и шея, конечности).
На увеличение риска развития КМ влияет и состояние иммуносупрессии. Так, КМ среди больных СПИДом наблюдается в 2,3 раза чаще, чем в обычной популяции, в пять раз чаще среди пациентов после трансплантации органа. 15,7-кратное увеличение риска КМ имеет место у пациентов с B-клеточными неоплазиями. В 50% случаев возраст таких пациентов менее 50 лет.
Пациенты, которые получают лечение метоксаленом и РUVA (фотохимиотерапия) по поводу псориаза, характеризуются 100-кратным увеличением риска КМ. Известно несколько клинических случаев спонтанной регрессии КМ после нормализации состояния иммунной системы [4, 5]. Кроме того, в литературе описаны случаи спонтанной регрессии опухоли, как правило у лиц женского пола.
В январе 2008 г. Н. Feng и соавт. представили доказательства возможного вирусного онкогенеза. Авторы исследовали образцы опухоли КМ и обнаружили новый полиомавирус, который был назван полиомавирусом клеток Меркеля [6].
После открытия L. Gross в 1953 г. мышиного полиомавируса было высказано предположение, что полиомавирусы способны вызывать развитие рака у человека [7]. Полиомавирусы могли вызывать развитие опухоли у животных, но это не означало их участие в канцерогенезе опухолей человека. Полиомавирусы часто вызывают латентные инфекции без манифестации болезни, но, например, на фоне иммуносупрессии способны провоцировать развитие опухоли.
Клинические проявления
Как правило, КМ представлена в виде единичного, безболезненного, однородного, неизъязвленного, красно-фиолетового узла. Вместе с тем иногда может наблюдаться изъязвление опухолевого образования, а также мультифокальное распространение заболевания [8].
Локализация
В 50% случаев КМ локализуется в области головы и шеи, в 40% – на коже конечностей, в 10% – на коже туловища и половых органов [8]. На момент постановки диагноза у 15% пациентов уже имеются метастазы в лимфатических узлах, а у 50–70% пациентов они реализуются в более поздние сроки.
Наиболее часто КМ метастазирует в кожу (28%) и регионарные лимфатические узлы (27%), реже – в печень (13%), легкие (10%), кости (10%), головной мозг (6%) [9].
В литературе описаны редкие локализации метастатического процесса: яичко, сердце, поджелудочная железа, желудок, конъюнктива глаза, радужка, костный мозг [9–12].
КМ относится к опухолям, тактику лечения которых должна определять мультидисциплинарная команда специалистов, состоящая из хирургов, радиотерапевтов и онкологов [13].
Хирургическое лечение
Основным вариантом лечения первичной опухоли в отсутствие отдаленного метастазирования считается хирургический. Из-за высокой частоты местных рецидивов рекомендуется делать разрез, отступая 1–3 см от видимых краев опухоли. Традиционно рекомендуется делать отступ 2–3 см в пределах неизмененных тканей. Однако в ряде работ приводится незначительное число местных рецидивов при отступе в пределах 1,1 см [14–16]. Согласно рекомендациям NCCN (National Comprehensive Cancer Network – Национальная всеобщая онкологическая сеть) 2016 г. (version 1. 2016) целесообразно делать отступ в пределах неизмененных тканей на 1–2 см. При наличии метастатического поражения лимфатических узлов выполняется лимфоаденэктомия. В отсутствие клинических и инструментальных данных о метастатическом поражении регионарных лимфатических узлов показано выполнение биопсии сторожевого лимфоузла. Это позволяет выявить микрометастазы в регионарных лимфоузлах у 25% пациентов.
При невозможности выполнения хирургического иссечения опухоли рекомендуется подведение дозы ионизирующего излучения 60–66 Гр. Для создания адекватного дозного распределения используются тканеэквивалентные болюсы. При наличии клинически измененных лимфатических узлов и невозможности выполнения лимфодиссекции целесообразно проведение лучевой терапии на вовлеченный лимфоколлектор в дозе 60–66 Гр.
Адъювантное лечение
КМ чувствительна к лучевой терапии. В рекомендациях NCCN лучевая терапия рекомендована в качестве адъювантной терапии для улучшения местного и регионарного контроля роста опухоли. K. Lewis и соавт. описали значительное снижение частоты локорегионарных рецидивов (относительный риск (ОР) 0,27) и отдаленных метастазов (ОР 0,34) при проведении лучевой терапии как на ложе удаленной опухоли, так и на зоны регионарного метастазирования после радикального хирургического лечения.
T. Jouary и соавт. в 2012 г. опубликовали данные многоцентрового исследования о пользе адъювантной лучевой терапии на ложе удаленной опухоли после широкого иссечения и проведении профилактического облучения на зоны лимфооттока у 83 больных КМ I cтадии. При медиане наблюдения 58 месяцев выявлено значительное снижение частоты регионарных рецидивов в группе больных с проведенным профилактическим облучением (n = 39) по сравнению с контрольной группой (n = 44) – 0 и 16,7% соответственно (р = 0,007) [17].
Рекомендуемая доза послеоперационной лучевой терапии – 50–56 Гр с подведением дозы методом классического фракционирования. При наличии опухолевых клеток в краях резекции дозу целесообразно увеличивать до 60–66 Гр. В целях профилактики в отсутствие пораженных лимфатических узлов показано лучевое воздействие на регионарный коллектор в дозе 46–50 Гр. При проведении регионарной лимфодиссекции, наличии значительного числа пораженных лимфатических узлов, экстракапсулярном распространении опухоли доза облучения увеличивается до 50–60 Гр [18].
Рутинное использование адъювантной химиотерапии не рекомендовано. Исследования, посвященные адъювантной химиотерапии, показали увеличение количества осложнений, а также летальности, обусловленной лечением, без преимуществ в выживаемости [19].
Адъювантная химиотерапия может быть использована только у пациентов с факторами высокого риска прогрессирования заболевания: молодой возраст, состояние иммуносупрессии, метастазы в регионарных лимфатических узлах.
Режимы химиотерапии предусматривают использование препаратов платины (цисплатин или карбоплатин) и этопозида. Одновременная химиолучевая терапия может применяться в адъювантном режиме, но статистически значимых преимуществ в выживаемости при ее использовании не получено. При этом наиболее частым осложнением одновременной химиолучевой терапии являются кожные реакции – 60% и нейтропения – 40% [20–22].
Лечение метастатической болезни
Морфологическая картина КМ схожа с таковой при мелкоклеточном раке легкого (МРЛ). Не случайно в лекарственном лечении этой болезни используются схемы, применяемые при МРЛ. Это режимы с включением антрациклинов, антиметаболитов, циклофосфамида, этопозида и производных платины. Использование данных схем часто сопряжено с высокой токсичностью. Ремиссии непродолжительны, что не приводит к значительному увеличению выживаемости. Поэтому химиотерапия часто используется в качестве паллиативной терапии у пациентов с метастатической болезнью. Из-за высокой степени токсичности большинства препаратов назначение химиотерапии должно рассматриваться в каждом случае индивидуально (особенно у пожилых пациентов).
Предпринимаются попытки использования других лекарственных препаратов. Проводилось исследование II фазы по оценке клинической эффективности иматиниба при распространенной КМ (Southwest Oncology Group Study, 2009), но набор пациентов был прекращен из-за отсутствия эффекта [23]. Вероятно, отсутствие эффективности иматиниба было обусловлено некорректным набором пациентов в исследование. На примере гастроинтестинальных стромальных опухолей показано, что иматиниб работает при наличии в опухоли мутации в гене KIT, которая не была определена в рамках данного исследования.
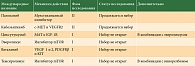
В литературе описаны единичные случаи успешного применения пазопаниба (Вотриент – мультитаргетный киназный ингибитор) при КМ [24]. Эффективность других таргетных препаратов при КМ, в том числе препаратов, зарегистрированных для лечения низкодифференцированных нейроэндокринных опухолей, в настоящее время изучается (в основном I–II фазы исследований) (таблица).
При местно-распространенной или метастатической стадии КМ для уменьшения размеров образования или симптомов болезни успешно применяется лучевая терапия. Если выполнение хирургического иссечения опухоли не представляется возможным, рекомендуется подведение дозы ионизирующего излучения 60–66 Гр. С паллиативной целью лучевую терапию проводят разовой дозой 3 Гр 10–12 фракций.
По данным литературы, химиотерапия, молекулярно-таргетные препараты не показали высокой эффективности в терапии метастатической болезни. Назрела необходимость создания реестра больных КМ, а также проведения многоцентровых клинических исследований по лечению этого редкого заболевания.
С учетом орфанности заболевания выполнение масштабных клинических исследований затруднено. Не случайно в литературе часто встречаются описание клинических случаев, ретроспективные анализы баз данных или результаты небольших по численности клинических исследований.
Клинический случай
Рассмотрим результаты клинического наблюдения за пациенткой К. 76 лет с третьим рецидивом КМ, которая была успешно излечена с использованием химиолучевой терапии.
В 2011 г. пациентка впервые отметила появление на коже правой щеки образование по типу атеромы, которое лечила самостоятельно антибактериальными мазями. Имел место быстрый рост образования – в течение четырех месяцев более чем в 7–10 раз. После обращения к хирургу в июне 2011 г. выполнено иссечение образования. Заключение гистологического исследования: карцинома Меркеля. В декабре 2011 г. появилось образование в проекции послеоперационного рубца. Больная обратилась к врачу. В связи с небольшими размерами уплотнения рекомендовано наблюдение. После увеличения размеров образования в июне 2012 г. выполнено его иссечение. В ноябре 2012 г. – повторное иссечение рецидива. В декабре 2012 г. появилось уплотнение в околоушной области справа. Пациентка обратилась в РОНЦ им. Н.Н. Блохина. После цитологического исследования пунктата из околоушной области справа сделано заключение: рак из клеток Меркеля. При выполнении иммуногистохимического исследования выявлена экспрессия СК20, хромогранина А, Ki67 – 40%, SSTR 2+, MCPyV 1+, р53 2+.
Учитывая рецидивирующее течение опухоли, короткие периоды ремиссии, локализацию опухоли (околоушная слюнная железа), возраст больной, низкую степень дифференцировки опухоли, специалисты по итогам мультидисциплинарного консилиума рекомендовали проведение химиолучевого лечения с индукционной химиотерапией. С 30 января по 31 мая 2013 г. больной К. выполнено шесть курсов полихимиотерапии по схеме: этопозид 100 мг/м2 с первого по третий день внутривенно, карбоплатин AUC 5 внутривенно в первый день.
С 17 апреля по 13 июня 2013 г. пациентке проведен курс 3D-конформной дистанционной лучевой терапии. Предлучевая подготовка включала разметку зоны интереса на компьютерном томографе и 3D-планирование лучевой терапии в планирующей системе Eclipse. Лучевая терапия проводилась на аппарате Clinac 2300 C/D на мягкие ткани правой щеки ежедневно, пять раз в неделю, с использованием фотонов энергией 6 MeV, разовая очаговая доза (РОД) – 2,5 Гр, суммарная очаговая доза (СОД) – 50 Гр (55 иГр), на шейно-надподключичную зону справа ежедневно, пять раз в неделю, энергия фотонов – 6 MeV, РОД – 2,5 Гр, СОД – 40 Гр (45 иГр).
Для достижения однородности дозы ионизирующего излучения и ее увеличения в коже и мягких тканях правой щеки использовали тканеэквивалентный болюс.
Лечение пациентка перенесла удовлетворительно. Лучевые реакции: мукозит слизистой оболочки полости рта 2-й степени по шкале RTOG/EORTC; гиперемия кожи зон облучения 1-й степени по шкале RTOG/EORTC [25]. При обследовании через месяц терапии у пациентки достигнут полный регресс опухоли. Очередное контрольное обследование выполнено в марте 2016 г. (33 месяца после завершения лечения). Признаков прогрессирования болезни не зафиксировано.
Перспективы. Иммуноонкологическая терапия
Наилучшие результаты были получены при использовании иммуноонкологической терапии (анти-PD1 и анти-PD-L1). В 2015 г. появились первые данные об успешном использовании анти-PD1-препарата (пембролизумаб) в рамках многоцентрового исследования II фазы. Эти результаты были дополнены и обновлены в 2016 г. [26].
В исследование было включено 26 пациентов с метастатической или местно-распространенной неоперабельной КМ, которые ранее не получали системной терапии. Пембролизумаб вводили в дозе 2 мг/кг каждые три недели внутривенно. Частота объективного ответа среди 25 пациентов, прошедших по крайней мере одно контрольное обследование на фоне терапии, составила 56% (95%-ный доверительный интервал (ДИ) 35–76) (у четырех пациентов достигнут полный ответ, у десяти – частичный). При медиане наблюдения 33 недели (7–53) рецидивы наблюдались у двух (14%) пациентов из 14 с ответом на терапию. Продолжительность ответа варьировалась от 2,2 до 9,7 месяца. Показатель выживаемости без прогрессирования в течение шести месяцев составил 67% (95% ДИ 49–86). Из 26 пациентов 17 (65%) имели полиомавирус-позитивный статус опухоли. Частота объективного ответа среди пациентов с полиомавирус-позитивным статусом опухоли составила 62% (десять из 16 пациентов) и 44% среди пациентов с полиомавирус-негативным статусом опухоли (четверо из девяти). Нежелательные явления 3–4-й степени наблюдались у 15% пациентов. Таким образом, авторы сделали вывод о возможности использования пембролизумаба в качестве терапии первой линии у пациентов с метастатической или местно-распространенной неоперабельной опухолью.
На ASCO 2016 г. также были представлены обновленные результаты изучения анти-PD-L1-препарата (авелумаб) в качестве терапии второй и последующей линий после прогрессирования заболевания на фоне предшествующей стандартной химиотерапии [27]. Внутривенные инфузии авелумаба в дозе 10 мг/кг вводили каждые две недели. Из 88 пациентов, включенных в исследование, 40% получили две и более предшествующие линии химиотерапии (26 пациентов – две линии, десять – три и более). Частота объективного ответа достигла 31,8% (у восьми (9,1%) пациентов полный ответ, у 20 (22,7%) – частичный). Медиана продолжительности ответа не достигнута (95% ДИ 8,3 месяца – оценить невозможно). При этом у 23 (82,1%) из 28 пациентов сохранялся ответ на фоне терапии на момент проведения анализа. Медиана времени до ответа – шесть недель. Показатель выживаемости без прогрессирования в течение шести месяцев составил 40% (95% ДИ 29–50), общей выживаемости – 69% (95% ДИ 58–78). Исследователи пришли к заключению, что авелумаб эффективен у пациентов неблагоприятной группы – рефрактерной к стандартной химиотерапии.
***
К сожалению, на сегодняшний день анти-PD-1- и анти-PD-L1-препараты не зарегистрированы в России. Впервые в нашей стране планируется проведение на базе нашего центра (отделение биотерапии) клинического исследования препарата авелумаб у пациентов с метастатической или местно-распространенной неоперабельной КМ.
K.V. Orlova, N.F. Oryol, O.P. Trofimova, N.P. Kostina, L.V. Demidov
N.N. Blokhin Russian Cancer Research Center
Contact person: Kristina Vyacheslavovna Orlova, krisman03@gmail.com
Merkel cell carcinoma is an aggressive skin cancer that is linked to exposure to ultraviolet light and the Merkel-cell polyomavirus. The diagnosis is made by histopathology, and immunohistochemical staining. Advanced Merkel-cell carcinoma often responds to chemotherapy, however, responses are usually short. Clearly, additional studies are needed to continue to improve the care of patients with MCC.
