Концепция универсальности в лечении болевого синдрома: теория и практика. XII ежегодная конференция «Вейновские чтения». Сателлитный симпозиум компании «Сандоз»
- Аннотация
- Статья
- Ссылки
«А.М. Вейн, академик РАМН, лауреат Государственной премии СССР, был одним из первых, кто начал заниматься проблемой боли», – открывая симпозиум, отметил д.м.н., профессор Первого МГМУ им. И.М. Сеченова, председатель совета экспертов Ассоциации междисциплинарной медицины Андрей Борисович ДАНИЛОВ. Именно под руководством академика А.М. Вейна было начато изучение психологических, социальных факторов в патогенезе острой и хронической боли. А.М. Вейн первым стал говорить о необходимости комплексного лечения пациентов с болевым синдромом.
В рамках симпозиума были рассмотрены медикаментозные и немедикаментозные методы лечения, обсуждались преимущества ступенчатой терапии болевого синдрома, критерии выбора обезболивающих средств.
«А.М. Вейн, академик РАМН, лауреат Государственной премии СССР, был одним из первых, кто начал заниматься проблемой боли», – открывая симпозиум, отметил д.м.н., профессор Первого МГМУ им. И.М. Сеченова, председатель совета экспертов Ассоциации междисциплинарной медицины Андрей Борисович ДАНИЛОВ. Именно под руководством академика А.М. Вейна было начато изучение психологических, социальных факторов в патогенезе острой и хронической боли. А.М. Вейн первым стал говорить о необходимости комплексного лечения пациентов с болевым синдромом.
В рамках симпозиума были рассмотрены медикаментозные и немедикаментозные методы лечения, обсуждались преимущества ступенчатой терапии болевого синдрома, критерии выбора обезболивающих средств.





Ступенчатая терапия боли: быстрота и безопасность
Приоритетными в лечении боли по-прежнему считаются медикаментозные методы, среди которых выделяют системную и локальную терапию. Комбинируя локальные и системные лекарственные средства, можно, сохраняя эффективность, уменьшить дозу системных препаратов и тем самым предотвратить развитие целого ряда побочных эффектов.
Стратегия выбора анальгетической терапии предполагает назначение группы препаратов в зависимости от силы боли, нежелательных лекарственных реакций, длительности болевого синдрома и механизмов, участвующих в патогенезе боли. Предложенная Всемирной организацией здравоохранения трехступенчатая схема лечения боли предусматривает применение простых анальгетиков, нестероидных противовоспалительных препаратов (НПВП), адъювантных средств, слабых опиоидов, трамадола, наркотических анальгетиков.
НПВП по праву считаются одной из самых популярных групп медикаментов для лечения болевого синдрома в рутинной клинической практике. Ежегодно более 30 млн человек в мире принимают НПВП, причем 40% из них люди старше 60 лет. На фармрынке представлено более 25 международных непатентованных наименований НПВП и свыше 1000 лекарственных форм, среди которых много дженериков.
Основной механизм действия НПВП связан с ингибированием фермента циклооксигеназы (ЦОГ) и торможением образования из арахидоновой кислоты простагландинов. Известны две изоформы ЦОГ. ЦОГ-1 экспрессируется в большинстве клеток и регулирует продукцию простагландинов, участвующих в обеспечении нормальной функциональной активности клеток. Именно блокада ЦОГ-1 обусловливает целый ряд побочных нежелательных реакций со стороны желудочно-кишечного тракта (ЖКТ), которые возникают при использовании неселективных НПВП. С помощью фермента ЦОГ-2, который в норме отсутствует в большинстве тканей, но образуется в случае тканевого повреждения, синтезируются простагландины в воспаленных тканях, с их наличием связывают процессы воспаления. Следует отметить, что все НПВП (селективные и неселективные) являются ингибиторами ЦОГ-2. Селективные НПВП в терапевтической дозе действуют только на ЦОГ-2, а неселективные блокируют и ЦОГ-2, и ЦОГ-1.
Метаанализ, включивший 65 рандомизированных клинических исследований с участием 11 237 пациентов, показал, что НПВП достоверно эффективнее плацебо уменьшают болевой синдром1. Было продемонстрировано отсутствие различий в эффективности обезболивающего действия разных НПВП, а также получены четкие доказательства равнозначной эффективности селективных и неселективных НПВП. В этой связи основным и важнейшим критерием выбора НПВП является его безопасность для конкретного больного2.
Применение НПВП может сопровождаться развитием таких двух основных групп нежелательных явлений, как гастроинтестинальные и сердечно-сосудистые катастрофы. Риски развития нежелательных явлений со стороны ЖКТ и сердечно-сосудистой системы имеют три градации – низкий, умеренный/высокий, очень высокий – и их развитие зависит от селективности НПВП в отношении ЦОГ-1 или ЦОГ-2. Установлено: чем выше селективность НПВП к ЦОГ-1, тем чаще отмечаются нежелательные явления со стороны ЖКТ, чем выше селективность НПВП к ЦОГ-2, тем чаще отмечается возникновение сердечно-сосудистых осложнений. В декабре 2014 г. в Москве состоялся Междисциплинарный совет экспертов «Рациональное использование НПВП в клинической практике», по итогам которого были разработаны рекомендации по выбору НПВП в зависимости от степени риска развития нежелательных явлений (таблица).
Согласно рекомендациям совета экспертов, тем пациентам, у которых отсутствуют желудочно-кишечные факторы риска и имеет место низкий кардиоваскулярный риск, можно назначать любые НПВП. При умеренном/высоком кардиоваскулярном риске и отсутствии риска для ЖКТ необходимо использовать неселективные НПВП (например, напроксен или кетопрофен). НПВП не рекомендованы пациентам с очень высоким кардиоваскулярным риском, в таких случаях показаны альтернативные обезболивающие средства. Если у пациента есть риск желудочно-кишечных осложнений, то неселективные НПВП, которые блокируют оба фермента ЦОГ, следует применять в сочетании с ингибиторами протонной помпы, что позволяет достоверно снижать риск развития диспепсии и язв ЖКТ.
Далее профессор Е.Г. Филатова привела типичный клинический пример. Пациент Н., 54 года. Пришел на прием к неврологу с жалобами на резкую боль в спине с иррадиацией в левую ягодичную область, возникшую после резкого движения (поскользнулся на льду).
При осмотре: положение вынужденное, из-за боли ограничены активные движения; сколиоз, напряжение длинных мышц спины и положительные пробы на растяжение левой грушевидной мышцы; симптом Ласега 45°, возникает боль в ягодице и по задней поверхности левого бедра до колена.
Диагноз: дорсалгия, обусловленная мышечно-тоническим синдромом.
Какая терапия показана этому пациенту? Прежде всего НПВП и адъювантные средства – миорелаксанты. Профессор Е.Г. Филатова предостерегла от назначения при выраженной острой боли двух или более разных молекул (препаратов) НПВП одновременно или даже последовательно. Эффективность подобной комбинации не доказана, и в ряде случаев отмечается снижение концентрации препаратов НПВП в крови и ослабление эффекта, возникает опасность развития нежелательных реакций, прежде всего со стороны ЖКТ. Рекомендуется выбрать один препарат (одну молекулу) из группы НПВП с учетом клинической ситуации, исходя из фармакологических особенностей препарата, оценивая факторы риска нежелательных явлений.
Принимая во внимание выраженность боли, можно прибегнуть к ступенчатой терапии, которая подразумевает использование одного препарата (одной молекулы), имеющего несколько лекарственных форм, как для инициации, так и для продолжения лечения. Чтобы ускорить наступление обезболивающего эффекта, в первые два-три дня препарат вводится парентерально, затем переходят на энтеральный прием препарата, а при уменьшении болевого синдрома можно использовать его местные формы наружно.
Профессор Е.Г. Филатова предложила следующую схему ступенчатой терапии острой боли: препарат Кетонал® внутримышечно 100–200 мг в сутки на протяжении первых двух-трех дней с переходом на таблетированные формы препарата Кетонал® по 100 мг один-два раза в сутки в течение пяти – семи дней либо на капсулы пролонгированного действия Кетонал® ДУО по 150 мг в сутки до полного купирования болевого синдрома.
При ограниченной возможности амбулаторного приема препарат Кетонал® (кетопрофен) вводится внутримышечно 100 мг однократно утром в сочетании с вечерним пероральным приемом таблеток, покрытых пленочной оболочкой, Кетонал® 100 мг в течение двух-трех дней. Далее рекомендовано продолжение терапии таблетированными формами препарата Кетонал® в дозе 100 мг один-два раза в сутки (максимальная доза препарата не должна превышать 200 мг) в течение пяти – семи дней до полного купирования болевого синдрома либо использование пролонгированных форм препарата для однократного применения один раз в сутки, например Кетонал® ДУО в капсулах по 150 мг в сутки, при необходимости в сочетании с локальным применением в виде крема или геля Кетонал®.
При невыраженном болевом синдроме можно начать терапию с капсул Кетонал® ДУО один раз в сутки – удобной формы 24-часового действия, которая позволяет купировать боль легкой или умеренной интенсивности в течение суток.
Для того чтобы защитить больного от НПВП-ассоциированных осложнений, при выборе препарата следует тщательно оценивать факторы риска развития гастропатий и сердечно-сосудистых катастроф. Важно принимать во внимание возраст пациента, язвенный анамнез, возможность приема НПВП длительно или в высоких дозах, прием двух и более препаратов, например сопутствующую терапию антикоагулянтами и глюкокортикостероидами.
В популяционном исследовании риска развития нежелательных явлений ЖКТ на фоне приема НПВП («случай – контроль» в общей популяции), проведенном в Финляндии, изучались причины осложнений со стороны ЖКТ, зарегистрированных у 91 191 пациента на фоне приема различных НПВП (в том числе кетопрофена, диклофенака, нимесулида, эторикоксиба)3. В контрольную группу вошли 41 480 человек. В исследовании, в частности, было показано, что наименьшее число серьезных ЖКТ-осложнений (кровотечение, язвы, перфорации) имели пациенты, принимавшие кетопрофен.
Прием любого НПВП может приводить к повышению артериального давления, особенно у пациентов с гипертонической болезнью, получающих антигипертензивные средства. Поэтому необходимо информировать пациентов о потенциальных кардиоваскулярных побочных эффектах НПВП, мониторировать уровень артериального давления на протяжении приема НПВП и выбирать наиболее безопасные в отношении кардиоваскулярных катастроф препараты.
В аналогичном масштабном популяционном исследовании («случай – контроль» в общей популяции) также оценивался риск развития впервые возникшего инфаркта миокарда на фоне приема различных НПВП4. Данные исследования продемонстрировали, что кетопрофен обладает наиболее благоприятным профилем безопасности по сравнению с диклофенаком, нимесулидом и эторикоксибом.
Завершая выступление, профессор Е.Г. Филатова перечислила основные правила применения препарата Кетонал®. Кетонал® назначают индивидуально, исходя из фармакологических особенностей, с учетом клинической ситуации и оценки факторов риска нежелательных лекарственных явлений. Кетонал® (кетопрофен) может использоваться при умеренном и высоком риске желудочно-кишечных и сердечно-сосудистых осложнений в сочетании с ингибиторами протонной помпы. При острой сильной боли предпочтительна ступенчатая терапия препаратом Кетонал®. При необходимости усиления клинического эффекта целесообразно дополнение приема препарата Кетонал® адъювантными средствами.
Клинико-диагностические подходы в лечении болевого синдрома в неврологии: от простого к сложному
Согласно теории специфичности, вошедшей в учебники по топической диагностике заболеваний нервной системы, боль есть самостоятельный феномен, имеющий собственный сенсорный аппарат. По теории интенсивности, боль – это следствие избыточного ощущения тепла, осязания, света, звуков, запахов, которые приводят к активации множественных рецепторов, формированию конвергенции и усилению болевых проявлений. Эти две теории легли в основу теории «болевых ворот», которую предложил в 1965 г. профессор R. Melzack.
В системе афферентного входа в спинном мозге действует механизм контроля прохождения ноцицептивной импульсации с периферии. Такой контроль осуществляется тормозными нейронами желатинозной субстанции, которые активируются импульсацией с периферии по толстым волокнам, а также нисходящими влияниями со стороны супраспинальных отделов, в том числе коры головного мозга. Этот контроль представляет собой, образно говоря, «ворота», которые регулируют поток ноцицептивной импульсации.
Основное научно-медицинское значение теории «входных ворот» заключалось в признании спинного и головного мозга активной системой, фильтрующей, отбирающей и воздействующей на входные сенсорные сигналы. Таким образом, эта теория утвердила центральную нервную систему ведущим звеном в болевых процессах.
Клинически с помощью теории «болевых ворот» удалось объяснить эффекты таких альтернативных методов лечения боли, как механическое растирание кожи и использование раздражающих мазей, чрескожная электронейростимуляция, вибрационная стимуляция. Важно и то, что эта теория дала толчок быстрому развитию учения о боли. «В целом профессор R. Melzack заложил основу для многоуровневого подхода к лечению болевого синдрома, при котором мы имеем возможность использовать различные методы психотерапии, когнитивно-поведенческой терапии, средства для локального применения, трициклические антидепрессанты, противосудорожные средства на различных этапах лечения боли», – уточнил докладчик.
В настоящее время многочисленными исследованиями доказана эффективность использования НПВП, мышечных релаксантов, поведенческой терапии, рефлексотерапии, кинезиотерапии при боли в спине.
Следует подчеркнуть несколько важных моментов, указанных в российских клинических рекомендациях по рациональному применению НПВП в клинической практике. Во-первых, все НПВП в адекватных дозах имеют равный анальгетический эффект. Во-вторых, инъекционная и таблетированная формы НПВП обладают равнозначным по силе обезболивающим эффектом. Однако использование инъекционных форм и водорастворимых НПВП имеет преимущество по скорости наступления обезболивающего эффекта. В-третьих, локальные формы НПВП обладают доказанной анальгетической и противовоспалительной активностью.
Выбор НПВП для купирования болевого синдрома должен осуществляться индивидуально. Немаловажную роль играет комплаентность. Широкая линейка лекарственных форм препарата Кетонал® позволяет не только эффективно и безопасно справиться с болью, но и повысить приверженность пациента лечению. Так, если в остром периоде для быстроты анальгетического эффекта пациент использует парентеральные формы препарата Кетонал® для внутривенного или внутримышечного введения, то высока вероятность, что он перейдет на пероральные формы препарата или будет применять Кетонал® местно в виде крема или геля.
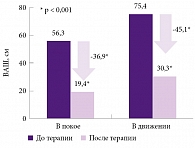
Способность препарата Кетонал® быстро и результативно осуществлять контроль над болью и воспалением была подтверждена в многочисленных исследованиях. В открытом исследовании оценивались эффективность и безопасность препарата Кетонал® ДУО в лечении дорсалгии5. В течение семи дней 349 больных дорсалгией получали препарат в дозе 150 мг в сутки. Результаты продемонстрировали достоверное (р < 0,001) снижение болевого синдрома у пациентов в покое (-36,9 мм) и в движении (-45,1 мм) по визуальной аналоговой шкале (рис. 1).
Уже доказана целесообразность использования локальной терапии НПВП для купирования боли. Эффективность НПВП для местного применения зависит от размера молекулы, который не должен превышать 500 г/ммоль. Тот факт, что молекула кетопрофена обладает наименьшим размером (254,3 г/моль) по сравнению с диклофенаком (296,2 г/моль) и пироксикамом (331,4 г/моль), позволяет с научной точки зрения рекомендовать Кетонал® крем для локальной терапии болевого синдрома.
Получены новые данные о кардиобезопасности кетопрофена у больных ревматоидным артритом на фоне приема НПВП, ингибирующих ЦОГ-2. В популяционном исследовании по типу «случай – контроль» на протяжении 12 лет наблюдались 17 320 пациентов с ревматоидным артритом6. Относительный риск развития осложнений со стороны сердечно-сосудистой системы в группе пациентов, страдавших ревматоидным артритом, был ниже, чем в группе контроля. Это позволяет с позиции доказательной медицины достаточно эффективно и безопасно использовать кетопрофен, в том числе длительно.
Уже доказана эффективность мышечных релаксантов при болях в нижней части спины. Обретает популярность кинезиотерапия, которая признана эффективной при соблюдении условия – не менее восьми тренировок за 12 недель в группе до десяти человек. Подтверждается эффективность мануальной терапии, включающей спинальную манипуляцию курсом не более восьми сеансов в срок до 12 недель.
Далее профессор А.П. Рачин остановился на частных аспектах терапии боли в спине. Специалисты могут столкнуться с определенными трудностями в лечении категории пациентов, страдающих гиперлордозом шейного отдела позвоночника (синдром «выдвинутой шеи»). В поясничной области у этих пациентов отмечается выраженная слабость паравертебральных мышц. Такие пациенты не смогут активно выполнять некоторые комплексы лечебной физкультуры, поэтому им в качестве терапевтических методов рекомендуется назначать лечебную физкультуру с биологической обратной связью, что способствует более быстрому восстановлению работы паравертебральных мышц.
В клинической практике все чаще наблюдаются случаи кифоза грудного отдела позвоночника у пожилых людей. Таким пациентам могут помочь специальные упражнения, использование методики «ношение рюкзака», кинезиотейпирование.
При сколиозе шейного отдела позвоночника, в зависимости от оценки угла Cobb, проводится консервативное или хирургическое лечение. Исследования показали, что при s-образном сколиотическом изменении позвоночника локально происходит напряжение паравертебральных мышц. Проведение магнитно-терапевтических местных локальных воздействий в этой области уменьшает выраженность болевых синдромов. По мнению докладчика, методики физиотерапии будущего – это структурно-резонансная терапия, воздействие магнитными волнами, которые совпадают с частотами тканей.
Пациентам со спинальным стенозом могут помочь остеопатические методики, гидрокинезиотерапия, лечебная физкультура с использованием биологической обратной связи.
Существенно снизить выраженность болевого синдрома у пациентов с нестабильностью шейного отдела позвоночника могут такие альтернативные методы, как мануальная терапия, лечебная физкультура с биологической обратной связью.
Соблюдение гигиены поз и движений позволяет не только уменьшить выраженность болевого синдрома, но и предупредить возникновение рецидивов.
«От того, насколько правильно мы подберем медикаментозные и немедикаментозные терапевтические методы, зависят прогноз и успех лечения пациентов с болевым синдромом», – отметил профессор А.П. Рачин в заключение.
Универсальность клинико-фармакологических свойств НПВП – основа эффективной и безопасной терапии боли
С этой точки зрения наибольший интерес представляет производное пропионовой кислоты кетопрофен, который в 1971 г. был признан молекулой года. Химическое строение молекулы во многом обусловливает следующие фармакокинетические параметры кетопрофена:
- энтеральная биодоступность – 90%;
- трансдермальная биодоступность – 5%;
- период полувыведения – 2,1 ± 1,2 часа;
- связь с альбумином плазмы – 99%;
- объем распределения – 0,1–0,2 л/кг.
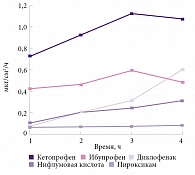
Химические свойства кетопрофена определяют универсальность его действия. Сравнительно небольшая молекулярная масса (254, 280 г/моль) позволяет кетопрофену легче проникать через барьеры как между клетками, так и трансцеллюлярно7. Кетопрофен при местном применении8 продемонстрировал самую высокую скорость проникновения через кожу в течение четырех часов после нанесения по сравнению с диклофенаком, ибупрофеном, пироксикамом, нифлумовой кислотой (рис. 2). Метаанализ эффективности местных форм НПВП показал более выраженный обезболивающий локальный эффект кетопрофена по сравнению с ибупрофеном, пироксикамом и индометацином9.
Другим важным свойством молекулы кетопрофена является достаточно высокий уровень липофильности. По данным исследований, кетопрофен быстрее других НПВП достигает максимальной концентрации действующего вещества в плазме. На догоспитальном этапе было продемонстрировано, что выраженный клинический анальгетический эффект после внутримышечного введения 100–200 мг раствора кетопрофена развивается через 8–12 минут10. В ряде исследований оценивался анальгетический дозозависимый эффект кетопрофена при острой боли у стоматологических пациентов. Было показано преимущество кетопрофена по сравнению с другими НПВП в купировании болевого синдрома, наиболее значимое – в дозе 100 мг9. Согласно полученным данным, 50%-ного порога облегчения болевого синдрома на фоне кетопрофена в дозе 100 мг достигли 72% пациентов, в то время как на фоне диклофенака 100 мг – 68%, ибупрофена 400 мг – 56%, целекоксиба 200 мг и 400 мг – 40 и 36% соответственно.
Помимо высокой эффективности, согласно исследованиям, кетопрофен демонстрирует хорошую гастроинтестинальную переносимость, особенно по сравнению с кеторолаком и теноксикамом11. Доказано, что кетопрофен наиболее безопасен в отношении риска развития инфаркта миокарда по сравнению не только c селективными ингибиторами ЦОГ-2, но и неселективными НПВП12.
Кетонал® (кетопрофен) имеет все необходимые формы выпуска для лечения различных видов острой и хронической боли. Такая лекарственная форма, как Кетонал® ДУО, позволяет быстро и надолго купировать боль. Кетонал® ДУО выпускается в виде капсул с модифицированным высвобождением, которые содержат два вида пеллет: белые – быстродействующая фракция (60% от общего количества), высвобождает кетопрофен в желудке; желтые – длительнодействующая фракция (40% от общего количества), высвобождает препарат в кишечнике. Микросферы быстродействующей фракции в условиях кислой среды желудка растворяются, кетопрофен начинает быстро всасываться, достигая необходимых концентраций, попадает в центральную нервную систему и обеспечивает быстрое обезболивание. Длительнодействующая фракция медленно всасывается в слабой щелочной среде тонкого кишечника, позволяя контролировать воспаление и оказывая обезболивающий эффект на протяжении суток.
М.В. Пчелинцев констатировал, что наличие различных лекарственных форм препарата Кетонал® определяет возможность использования препарата как при острой, так и при хронической боли.
Заключение
Кетонал® – универсальный и эффективный препарат группы НПВП имеет парентеральные, пероральные, местные формы выпуска, что позволяет использовать его для проведения ступенчатой терапии различных болевых синдромов.
