Лечение сосудистых когнитивных нарушений
- Аннотация
- Статья
- Ссылки
- English
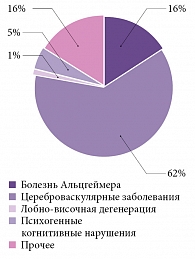

Цереброваскулярные заболевания являются одной из наиболее частых причин умеренных (недементных) когнитивных расстройств в пожилом возрасте, значительно опережая по частоте встречаемости все другие нозологические формы (рисунок). По данным специализированного амбулаторного приема пациентов с когнитивными расстройствами на базе клиники нервных болезней им. А.Я. Кожевникова в г. Москве, сосудистые поражения – это вторая по частоте после болезни Альцгеймера причина деменции в российской популяции [1].
Патогенез сосудистых когнитивных нарушений
Не подлежит сомнению, что терапия сосудистых когнитивных нарушений должна быть патогенетически обоснованной. Взгляды на механизмы формирования нарушений высших психических функций на фоне цереброваскулярных заболеваний в последние годы существенно изменились. Ранее доминировало представление о ведущей роли механических препятствий кровотоку вследствие атеросклеротического или иного поражения церебральных сосудов. Предполагалось, что прогрессирующий стенозирующий процесс может вызывать хроническую ишемию и гипоксию головного мозга, следствием которых в начале заболевания становятся преходящие, а затем стойкие нарушения памяти, внимания и других когнитивных функций. Подобные взгляды привели к широкому использованию в клинической практике вазодилатирующих препаратов.
Однако эффективность сосудорасширяющей терапии при когнитивных расстройствах в пожилом возрасте оказалась весьма скромной. Даже гемодинамически значимый атеросклероз, который встречается относительно редко, едва ли сопровождается явлениями хронической ишемии из-за возможностей коллатерального кровотока. Недостаточность коллатерального кровотока при патологии крупных церебральных сосудов скорее может стать причиной острого нарушения мозгового кровообращения с клиникой инсульта, чем хронической церебральной ишемии.
В то же время в основе хронической цереброваскулярной патологии обычно лежит патология мелких церебральных сосудов – микроангиопатия. У пожилых (60–75 лет) она чаще всего развивается как осложнение артериальной гипертензии и сахарного диабета, а у лиц старческого возраста (после 75 лет) нередко бывает также следствием сенильной амилоидной ангиопатии.
Клинико-морфологические и клинико-нейровизуализационные сопоставления у пациентов с сосудистыми когнитивными нарушениями свидетельствуют, что в их основе лежат такие последствия микроангиопатии, как «немые» инфаркты головного мозга, обычно небольшого размера (до 15 мм в диаметре), микрокровоизлияния и диффузные изменения белого вещества (лейкоареоз). Непосредственной причиной формирования указанных изменений является эндотелиальная дисфункция, которая приводит к преобладанию вазоконстрикторных реакций, шунтированию крови в обход капиллярного русла, повышению проницаемости стенки микрососудов и нарушению гематоэнцефалического барьера [2–5].
Исходя из вышесказанного, к приоритетным направлениям ведения пациентов с сосудистыми когнитивными нарушениями относятся профилактика острых нарушений мозгового кровообращения, коррекция эндотелиальной дисфункции, осуществление нейропротекции и стимуляция церебральных репаративных процессов.
Лечение базисного сосудистого заболевания
Чтобы не допустить прогрессирования сосудистых когнитивных нарушений, в первую очередь необходимо добиться максимально возможного контроля над базисным сосудистым заболеванием. С этой целью по соответствующим показаниям проводится антигипертензивная, антитромбоцитарная или антикоагулянтная и гиполипидемическая терапия.
Артериальная гипертензия является одним из наиболее сильных и независимых факторов риска острых нарушений мозгового кровообращения, которые при артериальной гипертензии развиваются как с клиникой инсульта, так и по типу «немых» инфарктов головного мозга. Причем преимущественное поражение сосудов небольшого калибра характеризуется многократным преобладанием «немых» инфарктов над инсультами [6]. Клиническим выражением повторных «немых» инфарктов обычно становится прогрессирующее сосудистое поражение головного мозга с когнитивными нарушениями [2, 6]. Таким образом, чтобы остановить прогрессирование сосудистых когнитивных нарушений, необходимо предотвратить повторное развитие «немых» инфарктов, что невозможно без нормализации артериального давления. Целевые показатели артериального давления – менее 140/85 мм рт. ст., независимо от возраста. Исключение из этого правила составляют пациенты с гемодинамически значимым стенозом церебральных артерий. У таких пациентов полная нормализация артериального давления может увеличивать риск ишемического инсульта в бассейне стенозированного сосуда по гемодинамическому механизму [7].
Следует отметить, что темпы достижения целевых показателей артериального давления у пациентов с хронической недостаточностью мозгового кровообращения должны быть индивидуальными. Длительная артериальная гипертензия приводит к изменению нормальной реактивности церебральных сосудов. В норме понижение артериального давления ведет к компенсаторному расширению церебральных сосудов, что поддерживает постоянство мозгового кровотока. Срыв указанного механизма ауторегуляции мозгового кровотока при быстрой нормализации артериального давления может вызвать несистемное головокружение, липотимические состояния и обмороки. При появлении указанных симптомов необходимо замедлить темпы наращивания антигипертензивной терапии вплоть до восстановления нормального самочувствия. Универсальных рекомендаций по темпам достижения целевых показателей артериального давления не существует: в зависимости от индивидуальной переносимости этот процесс может занять от одного до шести месяцев. Предпочтительно использовать антигипертензивные препараты с длительным периодом полувыведения, так как они не увеличивают такого крайне негативного для головного мозга показателя, как суточная вариабельность артериального давления [7].
Результаты многочисленных международных наблюдательных и интервенционных исследований влияния антигипертензивной терапии на когнитивные функции оказались противоречивыми. В некоторых работах профилактический эффект терапии и в отношении деменции был показан [8–14], в то время как в других он не достигал статистической значимости [15–21]. Вероятно, основными причинами указанных расхождений были различия по возрасту начала и продолжительности проведения антигипертензивной терапии. В целом прослеживалась определенная статистическая закономерность: чем моложе были пациенты в начале наблюдения и чем длительнее антигипертензивная терапия, тем существеннее и достовернее снижался риск развития деменции. Таким образом, для профилактики прогрессирования хронической сосудистой мозговой недостаточности оптимальны максимально раннее начало терапии, ее непрерывность и последовательность. В то же время риск деменции, вероятно, мало зависит от используемого фармакологического класса антигипертензивных препаратов [8–21].
В настоящее время общепризнано, что применение препаратов из группы статинов достоверно уменьшает риск повторных ишемических инсультов. Это связано не только с гиполипидемическим эффектом, но и с эндотелиопротективным свойством препаратов, которое способствует стабилизации атеросклеротической бляшки. Можно обоснованно предположить, что профилактический эффект статинов не ограничен симптомным ишемическим инсультом, но актуален также и у пациентов с «немыми» инфарктами. Последние, как уже говорилось выше, представляют собой один из главных патологических механизмов формирования сосудистых когнитивных нарушений.
Однако на сегодняшний день способность терапии статинами влиять на темпы прогрессирования сосудистых когнитивных расстройств остается не до конца изученной. В исследовании PROSPER не было зафиксировано какого-либо существенного изменения темпа прогрессирования когнитивных расстройств при приеме статинов по сравнению с плацебо [22]. Недостатком работы было использование краткой шкалы оценки психического статуса в качестве основного критерия эффективности. Как известно, данная шкала не отражает выраженность когнитивных симптомов лобной дисфункции, которые превалируют в клинической картине сосудистых когнитивных нарушений. Поэтому отсутствие динамики по данной шкале не исключает возможности наличия положительных изменений, характерных именно для цереброваскулярной патологии когнитивных симптомов.
Остается открытым вопрос о целевых показателях липидного профиля у пациентов с сосудистыми когнитивными нарушениями. Такой показатель определен при наличии инсульта в анамнезе: следует стремиться к поддержанию уровня липопротеинов низкой плотности менее 1,8 ммоль/л [23]. Вопрос, следует ли распространить эту рекомендацию на пациентов без инсульта, но с «немыми» инфарктами головного мозга и когнитивными нарушениями, нуждается в дальнейших исследованиях.
Наконец, важнейшим направлением профилактики повторного инсульта является антитромбоцитарная или антикоагулянтная терапия. Последняя предпочтительна при кардиоэмболическом варианте ишемического инсульта. До сегодняшнего дня влияние этих двух видов терапии на темп прогрессирования сосудистых когнитивных расстройств остается недостаточно изученным. Согласно общепринятым рекомендациям, антикоагулянтная терапия противопоказана пациентам с деменцией из-за высокого риска случайной передозировки лекарственных препаратов и развития геморрагических осложнений. Влияние ацетилсалициловой кислоты (АСК) анализировалось в исследовании «Аспирин в лечении бессимптомного атеросклероза». Авторы в течение пяти лет наблюдали 3350 пациентов в возрасте от 50 до 75 лет. Однако по окончании срока наблюдения отсутствовали достоверные различия по когнитивным показателям между группой АСК (100 мг/сут) и плацебо [24]. Другие антитромбоцитарные препараты (комбинация АСК и дипиридамола медленного высвобождения, клопидогрел) также не показали каких-либо преимуществ перед плацебо в отношении темпов прогрессирования когнитивных расстройств [25]. Однако, как и в исследовании PROSPER, влияние антитромбоцитарных препаратов на когнитивные функции оценивалось с помощью краткой шкалы оценки психического статуса. Как уже указывалось выше, эта методика имеет весьма ограниченную диагностическую значимость при сосудистых когнитивных нарушениях.
С нашей точки зрения, главным методологическим ограничением всех исследований по влиянию базисной терапии на когнитивные функции было отсутствие дифференциальной диагностики деменций. Артериальная гипертензия и другие сердечно-сосудистые заболевания относятся сегодня к факторам риска болезни Альцгеймера. Тем не менее профилактический эффект терапии базисного сосудистого заболевания в отношении сосудистой деменции теоретически должен быть более значительным, чем в отношении болезни Альцгеймера. В цитируемых международных исследованиях базисной терапии сосудистого заболевания этиология новых случаев слабоумия не анализировалась. Поэтому представляется целесообразным проведение дальнейших исследований с раздельным анализом влияния проводимой терапии на риск возникновения сосудистой деменции и манифестацию болезни Альцгеймера.
Нейрометаболическая терапия
Патогенетически обоснована при сосудистых когнитивных нарушениях нейрометаболическая терапия. Она проводится с целью обеспечения нейропротекции в условиях хронической церебральной ишемии и/или повторных эпизодов острых нарушений мозгового кровообращения с клиникой инсульта или по типу «немых» инфарктов, а также с целью активации репаративных процессов головного мозга. Нейрометаболические препараты, наиболее часто используемые в отечественной неврологической практике, приведены в таблице.
Высокоэффективным нейрометаболическим препаратом, который обладает комплексным нейропротективным и нейрорепаративным эффектом, активно используется у пациентов как с инсультом в остром и восстановительном периодах, так и при хронической недостаточности мозгового кровообращения, является цитиколин (Цераксон®). Будучи предшественником фосфатидилхолина, препарат служит одним из ключевых метаболитов, который участвует в синтезе структурных фосфолипидов клеточных, в том числе и нейрональных, мембран, обеспечивая репарацию последних при ишемическом повреждении. Активация синтеза фосфатидилхолина на фоне поступления экзогенного цитиколина оказывает нейропротективный и репаративный эффект, потому что способствует ресинтезу поврежденной клеточной мембраны, участвует в функциональной перестройке нервной ткани, образовании новых дендритов и в синаптогенезе. Будучи также предшественником ацетилхолина, цитиколин активизирует церебральную ацетилхолинергическую систему. Ацетилхолин, как известно, играет ключевую роль в процессах устойчивости внимания и запоминании новой информации. Кроме того, в эксперименте было показано, что на фоне использования цитиколина повышается активность и в других нейротрансмиттерных системах, в том числе дофамин- и серотонинергической. Указанные нейромедиаторы участвуют в познавательной деятельности и регуляции эмоций. Цитиколин также препятствует развитию эксайтотоксичности, блокируя вызванный ишемией выброс глутамата, играющего ведущую роль в деструкции нейрональных мембран. Цитиколин, с одной стороны, увеличивает обратный захват глутамата, снижая его синаптическую концентрацию при острой ишемии, с другой стороны, в фазе восстановления, наоборот, увеличивает его концентрацию, способствуя улучшению когнитивных функций у пациентов. Таким образом, цитиколин модулирует работу этой нейротрансмиттерной системы [26–32].
Эффективность Цераксона у пациентов с сосудистыми когнитивными нарушениями оценивалась в 14 двойных слепых рандомизированных плацебоконтролируемых исследованиях, в которых принимало участие более 800 пациентов. Препарат назначался в дозе 1000 мг (12 исследований) или 600 мг (два исследования) в сутки или постоянно на протяжении нескольких месяцев, или повторными прерывистыми курсами продолжительностью не менее трех недель. Цераксон® вводился внутривенно (пять исследований), внутримышечно (пять исследований) или перорально (три исследования). Было показано, что на фоне использования Цераксона отмечались статистически достоверное и клинически значимое улучшение памяти, других когнитивных функций и положительная динамика в эмоционально-поведенческой сфере. При этом частота возникновения нежелательных явлений не отличалась существенно от плацебо [33–36].
Исходя из механизма действия Цераксона, его положительный эффект в отношении когнитивных функций специфичен не только для сосудистой патологии головного мозга. Активация церебральных нейротрансмиттерных систем оказывает благоприятное воздействие на познавательную деятельность также у пациентов с нейродегенеративной патологией, такой как болезнь Альцгеймера. Действительно, к настоящему времени накоплен положительный опыт использования Цераксона при болезни Альцгеймера. Препарат в дозе 1000 мг/сут в течение одного – трех месяцев принимали пациенты с болезнью Альцгеймера с синдромом легкой или умеренной деменции. На фоне терапии пациенты стали лучше ориентироваться во времени и пространстве, наблюдались положительная динамика когнитивных функций в целом (суммарный балл по краткой шкале оценки психического статуса) и увеличение церебральной перфузии. Влияние терапии на церебральную гемодинамику, вероятно, было связано с повышением функциональной активности коры головного мозга [37–39].
Следует отметить распространенные трудности дифференциального диагноза сосудистых и нейродегенеративных когнитивных нарушений, связанные с большим числом коморбидных состояний. Так, у пациентов с хронической цереброваскулярной недостаточностью во многих случаях отмечаются дополнительные признаки сопутствующего нейродегенеративного процесса. По нашим данным, около 40% пациентов с диагнозом «дисциркуляторная энцефалопатия» имели гиппокампальный тип нарушений памяти, характерный для болезни Альцгеймера [40]. Поэтому положительное влияние Цераксона как на сосудистые, так и на нейродегенеративные когнитивные нарушения является важным практическим преимуществом данного препарата.
Особенно важно подчеркнуть целесообразность применения Цераксона у пациентов с синдромом умеренных когнитивных нарушений, не достигающих выраженности деменции. В настоящее время в мире отсутствует общепринятый протокол ведения больных с подобными расстройствами. Крупные рандомизированные исследования эффективности ингибиторов ацетилхолинэстеразы закончились неудачей, вероятно, из-за методологических проблем, таких как некорректность отбора пациентов и использование не вполне адекватных критериев эффективности [41–43]. На практике у пациентов с умеренными когнитивными нарушениями эмпирически используются различные ноотропные и метаболические лекарственные средства. Однако приоритет следует отдавать препаратам с широким спектром эффективности, включающим как сосудистый, так и нейродегенеративный процесс. Это обусловлено тем, что на стадии умеренных когнитивных нарушений точный дифференциальный диагноз между этими двумя состояниями в широкой клинической практике едва ли возможен. Другой важный принцип – это использование препаратов с нейропротективными свойствами, поскольку умеренные когнитивные нарушения в большинстве случаев прогрессируют с высоким риском развития деменции в ближайшем будущем. Цераксон® соответствует обоим вышеуказанным требованиям, так как обладает полимодальным нейропротективным механизмом действия.
Так, в исследовании P. Spiers и соавт. Цераксон® назначался 95 пожилым людям без какого-либо установленного неврологического диагноза. Препарат способствовал наступлению клинического улучшения у пациентов с изначально более низкими когнитивными показателями [44]. Эти данные дают основание для широкого использования Цераксона у пациентов с синдромом умеренных когнитивных нарушений различной этиологии.
Немедикаментозная коррекция сосудистых когнитивных расстройств
Последние годы большое внимание уделяется роли немедикаментозных подходов в ведении пациентов с недементными когнитивными нарушениями различной этиологии, в том числе сосудистой. К перспективным немедикаментозным методикам международное неврологическое сообщество относит оптимизацию питания, систематические физические упражнения и когнитивную коррекцию.
Предполагается, что увеличение в рационе содержания природных антиоксидантов, таких как витамины С и Е, может способствовать снижению риска повторных сосудистых событий и уменьшению темпа прогрессирования когнитивных расстройств. Обычно рекомендуется так называемая средиземноморская диета, которая включает ежедневное употребление твердых сортов зерновых культур, овощей и фруктов, оливкового масла и молочных продуктов. Диета предусматривает употребление не реже одного раза в неделю морепродуктов и/или птицы. Мясо разрешается не чаще нескольких раз в месяц [45, 46].
Общепринятой рекомендацией для профилактики прогрессирования когнитивных расстройств являются систематические (не реже двух раз в неделю) аэробные физические упражнения. Такие нагрузки способствуют увеличению синтеза эндогенных нейротрофических факторов, которые активизируют церебральные репаративные процессы. Кроме того, систематические физические упражнения несомненно оказывают благоприятное воздействие на базисное сосудистое заболевание, способствуют уменьшению индекса массы тела. Повышенный индекс массы тела, как известно, также считается фактором риска развития деменции [47–49].
Когнитивная коррекция, применяемая у пациентов с сосудистыми когнитивными нарушениями, может быть следующей:
-
когнитивное стимулирование: групповая творческая активность (совместные интеллектуальные игры, самодеятельность, активное социальное общение и др.). Считается наиболее эффективной методикой;
-
когнитивный тренинг: выявление с помощью психологических методов исследования наиболее пострадавших когнитивных функций и «тренировка» их с помощью специальных упражнений;
-
когнитивная реабилитация: выработка индивидуализированных стратегий преодоления имеющегося когнитивного дефекта за счет относительно сохранных когнитивных функций.
Эффективность немедикаментозных методов в сочетании с терапией базисного сосудистого заболевания изучалась недавно в рамках крупного проспективного исследования профилактики когнитивных нарушений и инвалидизации FINGER. 1260 пожилых пациентов без деменции, но с высоким риском ее развития в ближайшем будущем были случайным образом рандомизированы на две группы. В первой (n = 631) активно использовались указанные выше немедикаментозные методики. Вторая (n = 629) выступила в качестве группы сравнения. Пациенты наблюдались на протяжении шести месяцев. В результате пациенты первой группы достоверно превосходили группу сравнения по показателям темпа познавательной деятельности и управляющих функций (планирование и контроль). В сфере памяти положительная динамика была менее выражена и различия между группами не достигали статистической значимости. Отталкиваясь от параметров, по которым была достигнута достоверная разница, можно предположить, что немедикаментозные методы в большей степени влияют на сосудистые когнитивные нарушения.
Заключение
Следует подчеркнуть, что отсутствие общепринятого протокола ведения сосудистых когнитивных нарушений, не достигающих выраженности деменции, не может служить основанием для пассивности врача. Контроль базисного сосудистого заболевания, сочетание немедикаментозных методов и нейрометаболической терапии позволяют улучшить качество жизни пациентов и их родственников, а также, вероятно, снизить риск прогрессирования когнитивных расстройств.
V.V. Zakharov, N.V. Vakhnina
Sechenov First Moscow State Medical University
Contact person: Vladimir Vladimirovich Zakharov, zakharovenator@gmail.com
Here, we discuss pathogenesis and treatment of vascular cognitive impairments. Prevention of acute cerebrovascular accidents, correction of endothelial dysfunction, neuroprotection and stimulation of reparative processes are among prioritized approaches for managing patients with vascular cognitive impairments. By controlling main vascular disease, combining neurometabolic therapy together with non-medicated approaches allow to improve quality of life of patients and their relatives as well as lower risk of progressing cognitive impairment.
