Мутации рецептора эпидермального фактора роста (EGFR) как показатель эффективности ингибиторов тирозинкиназ у больных немелкоклеточным раком легкого (НМРЛ)*
- Аннотация
- Статья
- Ссылки
Изучены эффективность низкомолекулярных ингибиторов тирозинкиназ – эрлотиниба и гефитиниба – в лечении больных распространенным НМРЛ с мутациями в генах EGFR и KRAS в опухоли, проведена сравнительная оценка непосредственной эффективности и отдаленных результатов лечения эрлотинибом и гефитинибом у пациентов в зависимости от наличия мутаций.
Показано, что наличие мутаций гена EGFR является важным молекулярным маркером эффективности лечения этими таргетными препаратами. Кроме того, по результатам большинства исследований при анализе групп пациентов был выявлен ряд факторов, которые тоже могут служить маркерами эффективности терапии ингибиторами тирозинкиназ.
К ним, в первую очередь, относят гистологический тип рака легкого (аденокарцинома или бронхиоло-альвеолярный рак), монголоидную расу, женский пол, отсутствие или минимальное курение в анамнезе.
Изучены эффективность низкомолекулярных ингибиторов тирозинкиназ – эрлотиниба и гефитиниба – в лечении больных распространенным НМРЛ с мутациями в генах EGFR и KRAS в опухоли, проведена сравнительная оценка непосредственной эффективности и отдаленных результатов лечения эрлотинибом и гефитинибом у пациентов в зависимости от наличия мутаций.
Показано, что наличие мутаций гена EGFR является важным молекулярным маркером эффективности лечения этими таргетными препаратами. Кроме того, по результатам большинства исследований при анализе групп пациентов был выявлен ряд факторов, которые тоже могут служить маркерами эффективности терапии ингибиторами тирозинкиназ.
К ним, в первую очередь, относят гистологический тип рака легкого (аденокарцинома или бронхиоло-альвеолярный рак), монголоидную расу, женский пол, отсутствие или минимальное курение в анамнезе.

С начала XX века рак легкого является самым распространенным онкологическим заболеванием в мире. В Российской Федерации рак легкого стоит на первом месте по частоте заболевания у мужчин и на девятом месте у женщин [1]. Немелкоклеточный рак легкого (НМРЛ) составляет примерно 85% всех случаев рака легкого [2]. Среди НМРЛ наиболее часто встречаются аденокарцинома и плоскоклеточный рак легкого (30–45 и 25–40% соответственно).
Для рака легкого характерна аутокринная активация сигнальных каскадов. Основные пути передачи митогенного сигнала в клетке – RAS/MAPK или PI3K/AKT сигнальные каскады. В большинстве случаев рака легкого наблюдается повышенная экспрессия рецептора эпидермального фактора роста (epidermal growth factor receptor – EGFR), обладающего тирозинкиназной активностью. Активация EGFR при раке легкого происходит вследствие мутаций, наиболее важными из которых являются делеции либо точечные замены аминокислот в тирозинкиназном домене белка. Одним из классов таргетных препаратов, подавляющих активность рецептора EGFR, являются низкомолекулярные ингибиторы тирозинкиназ, блокирующие АТФ-связывающий домен EGFR и тем самым ингибирующие передачу сигнала от этого рецептора. К этому классу препаратов относятся гефитиниб (Иресса, ZD1839, gefitinib) и эрлотиниб (Тарцева, OSI-774, erlotinib), одобренные для лечения диссеминированного НМРЛ [3].
Эти таргетные препараты проявляют высокий клинический эффект преимущественно по отношению к тем опухолям, которые содержат мутацию в киназном домене рецептора, кодируемом 18–21-м экзонами гена EGFR. Эти мутации обнаруживают более чем в 30% случаев НМРЛ в странах Восточной Азии, но лишь в 10% опухолей у пациентов других рас и национальностей [4]. Поэтому мутации EGFR являются прогностическим маркером чувствительности НМРЛ, и в первую очередь аденокарцином, к таргетной терапии гефитинибом и эрлотинибом. Необходимо отметить, что при раке легкого независимо от EGFR часто имеет место активация RAS/MAPK пути за счет мутации гена KRAS. Известно, что мутации KRAS не препятствуют действию ингибиторов EGFR гефитиниба и эрлотиниба, но снижают эффективность терапии [5]. Таким образом, определение мутаций EGFR и KRAS является необходимым тестом при отборе больных для назначения таргетной терапии. Целью работы явилось определение частоты и спектра мутаций в генах EGFR и KRAS, а также оценка эффективности эрлотиниба и гефитиниба в лечении больных распространенным НМРЛ с мутациями EGFR и KRAS в опухоли.
Материалы и методы исследования
В исследование включены 114 больных НМРЛ, проходивших лечение в ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН. Анализ мутаций проводили в лаборатории онкогеномики НИИ канцерогенеза «РОНЦ им. Н.Н. Блохина» РАМН методом полимеразной цепной реакции (ПЦР) с последующим секвенированием. Мутации в 18–21-м экзонах гена EGFR и во 2-м экзоне гена KRAS определяли в ДНК из опухолевых клеток рака легкого, полученных путем микродиссекции архивных парафиновых срезов операционного или биопсийного материала.
Лечение больных и оценку эффективности эрлотиниба и гефитиниба проводили в отделении химиотерапии ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН. В исследование включены 38 больных неоперабельным или рецидивным НМРЛ, подтвержденным цитологически или морфологически, у которых отмечалось прогрессирование на первой и/или второй линиях стандартных режимов химиотерапии. Исключение составляли пациенты с тяжелой сопутствующей патологией, имеющие противопоказания для проведения традиционного лекарственного лечения. Таким больным ингибиторы тирозинкиназ назначали в качестве терапии первой линии. Для статистической обработки данных использовался пакет программ STATISTICA® 6.0.
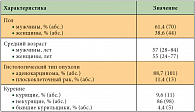
Характеристики больных НМРЛ, прошедших генетическое тестирование, обобщены в таблице 1. Среди больных НМРЛ превалировали мужчины (61,4%), чаще НМРЛ обнаруживали у больных в возрасте 50–70 лет, однако 4,7% больных НМРЛ были моложе 30 лет. Большинство исследованных опухолей гистологически были представлены аденокарциномой легкого (88,7%, 101/114), остальные – плоскоклеточным раком. Подавляющее большинство больных были некурящими (86%) или бывшими курильщиками (4,4%).
Результаты
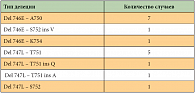
Анализ мутаций в 18–21-м экзонах гена EGFR выявил мутации у 28 больных НМРЛ (24,6%, 28/114), причем все случаи рака легкого с мутациями EGFR являлись аденокарциномами (27,7%, 28/101). Мутации выявлены в 19-м (17 случаев) и 21-м экзонах (11 случаев) гена EGFR. Типы мутаций в 19-м экзоне EGFR представлены в таблице 2. В трех случаях НМРЛ делеции сопровождались заменой нуклеотидов в прилегающей области 19-го экзона гена EGFR, приводящей к замене аминокислотных остатков в белке EGFR. В одной аденокарциноме легкого была выявлена крупная делеция 9 аминокислот Del 746E – K754.
Все обнаруженные мутации в 19-м экзоне (16,8%, 17/101) являлись делециями, затрагивающими кодоны 747LREA750 в АТФ-связывающей петле тирозинкиназного домена, что приводит к изменению позиции аминокислот в АТФ-связывающей петле и конститутивной активации рецептора EGFR. Мутации в 21-м экзоне EGFR были обнаружены в ДНК из 11 препаратов аденокарцином (10,9%, 11/101), все мутации оказались точечными заменами Leu858Arg. Эта мутация изменяет конформацию активационной петли тирозинкиназного домена и так же, как и делеции в 19-м экзоне, служит причиной конститутивной активации рецептора EGFR. Причем в одном случае замена Leu858Arg выявлена в том же образце, что и делеция в 19-м экзоне EGFR.
Доля мутаций в 19-м экзоне гена EGFR составляет 60,7% (17/28) мутаций, а точечных замен Leu858Arg в 21-м экзоне – 39,3% (11/28). В 18-м и 20-м экзонах EGFR мутации не обнаружены. Все мутации в 19-м и 21-м экзонах выявлены в аденокарциномах у некурящих больных (один из них бывший курильщик). Мутации в гене EGFR чаще встречались у женщин (36,4%, 16/44), чем у мужчин (17,1%, 12/70), (р = 0,02). В 13 случаях плоскоклеточного рака легкого мутации не обнаружены.
Мутации гена KRAS выявлены в 13,2% (15/114) случаев НМРЛ – 14 аденокарциномах и одном плоскоклеточном раке легкого. При этом в 4 случаях мутации KRAS были выявлены в образцах, в которых ранее были обнаружены мутации EGFR (в 2 случаях – делеция в 19-м экзоне и в 2 случаях – точечная замена в 21-м экзоне). Все мутации представляли собой точечные замены глицина в 12-м кодоне гена KRAS: Gly12Asp (53,4%, 8/15), Gly12Cys (13,3%, 2/15), Gly12Ala (13,3%, 2/15), Gly12Val (13,3%, 2/15), Gly12Ser (6,7%, 1/15). Оценка эффективности лечения ингибиторами тирозинкиназ проведена у 38 (33,3%) из 114 пациентов НМРЛ. Демографические и клинические характеристики этих больных обобщены в таблице 3.
Мутации гена EGFR выявлены у 12 из 38 больных НМРЛ (31,6%). У всех 12 больных с мутациями EGFR была аденокарцинома легкого. Хотя в исследуемой группе мужчин было больше (60,5%), мутации чаще встречались у женщин (58%, 7/15), чем у мужчин (42%, 5/23). Делеции в 19-м экзоне (чаще L747-T750) EGFR выявлены у 9 из 38 больных (23,7%) (табл. 3), точечная мутация в 21-м экзоне (Leu858Arg) EGFR – у 3 из 38 больных (7,9%).
Одиннадцать из 12 больных (92%) были некурящими, один (8%) – бывший курильщик. В дальнейшем эти пациенты были объединены в одну группу некурящих больных. Среди 38 проанализированных случаев мутация в 2-м экзоне KRAS (миссенс-мутация Gly12) обнаружена у 4 пациентов (10,5%): из них у 3 пациентов с аденокарциномой и у 1 пациента с плоскоклеточным раком легкого. У одного больного с аденокарциномой выявлена делеция в 19-м экзоне EGFR и мутация во 2-м экзоне KRAS.
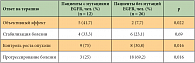
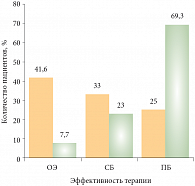
У трех из четырех больных, у которых была обнаружена мутация KRAS, отмечено прогрессирование заболевания на фоне лечения ингибиторами EGFR. Один больной с сочетанной мутацией EGFR и KRAS лечился с частичным эффектом. Эффективность лечения ингибиторами тирозинкиназ оценена у 12 пациентов с мутациями EGFR и у 26 пациентов без мутаций (табл. 4). Всего были зарегистрированы 1 полная ремиссия (8%) и 4 частичные ремиссии (34%). У 4 больных (33%) отмечена стабилизация болезни. Таким образом, общая эффективность лечения (полные и частичные ремиссии) составила 42%, контроль роста опухоли – 75%. Прогрессирование болезни на фоне лечения наблюдалось у 3 больных (25%).
У 26 пациентов с отсутствием мутаций EGFR также была оценена эффективность лечения. Объективный эффект отмечен у 7,7% больных. Стабилизация болезни зарегистрирована у 23,1% больных, прогрессирование – у 69,2%. Контроль роста опухоли отмечался у 30,8% больных. При статистическом анализе значимыми оказались различия между больными с мутантным EGFR, с одной стороны, и немутантным EGFR – с другой. При сравнительной оценке различий в этих группах объективный эффект (p = 0,022), контроль роста опухоли (p = 0,016) и прогрессирование болезни (p = 0,016) являются статистически значимыми (рис.).
Медиана времени до прогрессирования у пациентов с мутациями EGFR, получавших лечение, составила 13,8 месяца, тогда как у больных с отсутствием таковых прогрессирование болезни наступало раньше – 2,7 месяца. Данные различия имеют тенденцию к статистической значимости (p = 0,05). Больные с мутацией EGFR жили дольше – 21,3 месяца, в то время как медиана общей выживаемости у больных без мутаций составила 6,8 месяца. Однако различия были статистически не значимы (p = 0,5).
Обсуждение результатов
При молекулярно-генетическом тестировании 114 больных НМРЛ активирующие мутации EGFR обнаружены у 24,6% (28/114) больных. Все опухоли легкого c мутациями EGFR представляли собой аденокарциномы. Частота мутаций составила 27,7%. Частота встречаемости соматических мутаций гена EGFR, описанная в клинических испытаниях, варьируется и, как правило, зависит от стран, в которых проводятся исследования, от расовой принадлежности пациентов и анамнеза курения. У представителей белой расы стран Европы и Северной Америки частота мутаций гена EGFR составляет 10–16% [6, 7]. В странах Азии эта цифра достигает 76% [8]. В немногочисленных работах, проведенных в России, частота мутаций превышает 20% [9, 10].
У всех 28 пациентов НМРЛ с мутациями EGFR гистологический тип опухоли был представлен аденокарциномой; 27 больных (95%) были некурящими, а один (5%) – бывший курильщик. Таким образом, полученные результаты совпадают с данными других авторов: наиболее частыми являются мутации в гене EGFR в аденокарциномах и у некурящих людей [11, 12]. Мутации гена KRAS выявлены в 13,2% (15/114) случаев НМРЛ, причем в 4 аденокарциномах из 28 (14,3%) мутации были выявлены в тех же образцах ДНК, в которых обнаружены мутации EGFR (в 2 случаях – делеция в 19-м экзоне и в 2 случаях – точечная замена в 21-м экзоне).
По данным литературы, сочетанные мутации генов EGFR и KRAS очень редки, а эффективность ингибиторов тирозинкиназ у таких больных высока [13]. Частота мутации гена KRAS в аденокарциномах легкого гораздо выше у больных из Европы (17–41%), чем из стран Азии (2–17%) [14–18]. Наличие в опухоли только мутации гена KRAS, как правило, сопровождается отсутствием чувствительности к ингибиторам EGFR. В большинстве исследований при анализе групп пациентов выявлен ряд факторов, которые могут служить маркерами эффективности терапии ингибиторами тирозинкиназ. К ним, в первую очередь, относят гистологический тип рака легкого (аденокарцинома или бронхиоло-альвеолярный рак), монголоидную расу, женский пол, отсутствие или минимальное курение в анамнезе. Независимым признаком, чаще всего выявляемым у вышеуказанных групп пациентов, является наличие мутации гена EGFR [18–20].
В плацебоконтролируемом исследовании BR.21 с применением эрлотиниба при подгрупповом многофакторном анализе статистически значимое влияние на выживаемость без прогрессирования и общую выживаемость имел только статус курения. Другие вышеперечисленные клинические факторы не влияли на отдаленные результаты лечения. Однако все они позитивно влияли на эффективность лечения эрлотинибом по сравнению с плацебо [19]. В аналогичном исследовании ISEL с использованием гефитиниба также наблюдалось увеличение эффективности лечения у некурящих больных с аденокарциномой, женщин и представителей монголоидной расы, однако достоверно дольше жили некурящие больные (p = 0,012) и пациенты азиатской расы (p = 0,01) [20].
Заключение
В настоящей работе выполнена сравнительная оценка непосредственной эффективности и отдаленных результатов лечения эрлотинибом и гефитинибом у пациентов в зависимости от наличия мутаций EGFR. Следует заметить, что эффективность лечения больных с мутациями EGFR составила 41,7%. Более низкими оказались результаты плацебоконтролируемых исследований ISEL и BR.21, где при ретроспективном анализе результатов частота объективного ответа на препараты у пациентов с мутациями составила 37,5 и 27% соответственно [20, 21]. По другим данным, эффект от терапии ингибиторами тирозинкиназ пациентов с мутациями EGFR наблюдается минимум в половине случаев [19]. Эффективность лечения у пациентов с отсутствием мутаций EGFR, напротив, была ожидаема и составила 7,7%. Стабилизация болезни зарегистрирована в 23% случаев. Таким образом, полученные нами результаты в целом соответствуют данным других исследователей: у больных с мутациями EGFR выявлены лучшие показатели эффективности лечения ингибиторами EGFR. При сравнительной оценке в группах были найдены статистически значимые различия в объективном ответе и отмечена тенденция к улучшению отдаленных результатов лечения эрлотинибом и гефитинибом пациентов с распространенным НМРЛ, имеющих в опухоли активирующие мутации EGFR.
Это позволяет сделать вывод, что мутации гена EGFR являются важным молекулярным маркером эффективности лечения ингибиторами тирозинкиназ. Проведение молекулярно-генетического скрининга позволит повысить частоту выявления мутаций EGFR, что особенно оправданно у пациентов с повышенной частотой встречаемости данных мутаций (женщин, некурящих, имеющих аденокарциному легкого). Полученные нами данные дают основание предполагать, что дальнейшие генетические исследования и поиск новых молекулярных маркеров для выявления групп, чувствительных к новым таргетным препаратам, позволят продолжить индивидуализацию терапии с целью достижения максимального эффекта.
Показано, что наличие мутаций гена EGFR является важным молекулярным маркером эффективности лечения этими таргетными препаратами. Кроме того, по результатам большинства исследований при анализе групп пациентов был выявлен ряд факторов, которые тоже могут служить маркерами эффективности терапии ингибиторами тирозинкиназ. К ним, в первую очередь, относят гистологический тип рака легкого (аденокарцинома или бронхиоло-альвеолярный рак), монголоидную расу, женский пол, отсутствие или минимальное курение в анамнезе.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />