Мышечная спастичность у пациентов с органическим поражением головного мозга как фактор снижения реабилитационного потенциала
- Аннотация
- Статья
- Ссылки
- English




Введение
Мышечная спастичность – один из основных факторов, снижающих эффективность реабилитации пациентов с тяжелыми инвалидизирующими заболеваниями [1–3]. Расстройства движений при органических поражениях головного мозга нередко связаны с повышенным мышечным тонусом, вследствие чего выполнение простых движений вызывает затруднения, снижается уровень повседневной активности, ухудшается качество жизни [1, 2]. Кроме того, у пациентов со спастичностью выше риск падений и соответственно переломов, у них часто возникают контрактуры, деформации конечностей, болевые синдромы, пролежни, расстройства функций тазовых органов, тромбофлебиты и другие осложнения.
Спастичность рассматривается как двигательное расстройство, характеризующееся повышением сопротивления мышц пассивному растяжению, которое возникает в результате поражения верхнего мотонейрона и кортикоспинального тракта. Повреждение кортикоспинального пути и коры головного мозга часто приводит к вялым парезам и параличам с низким мышечным тонусом [3]. В то же время поражение базальных ганглиев нередко вызывает значительное повышение мышечного тонуса, чему способствует не только нарушение тормозящего воздействия супраспинальных отделов на спинальные мотонейроны [1], но и изменения в самих мышцах. Среди них – уменьшение мышечной силы, снижение реакции мышц на растяжение, расстройство быстрого расслабления и сократительной способности мышц, увеличение латентного периода их активации и др. [4].
Методы профилактики и лечения спастичности
Для профилактики спастичности и борьбы с ней используют различные физические, физиотерапевтические и медикаментозные методы.
С целью профилактики спастичности или уменьшения повышенного мышечного тонуса целесообразно использовать облегчающую методику лечебной физической культуры (ЛФК), основанную на влиянии чувствительных стимулов на главные рефлексы, которые изменились на фоне структурного повреждения головного мозга. Ключевые принципы данной методики:
- учет взаимоотношения между чувствительностью и движением, с одной стороны, и базисной рефлекторной активностью, с другой;
- использование различных поз для облегчения рефлекторной активности и соответственно движений;
- двигательное обучение (повторение движений и частая стимуляция);
- лечение организма как единого целого;
- тесный контакт между врачом и методистом ЛФК, а также врачом и пациентом.
Можно рекомендовать такие разновидности облегчающей методики, как проприоцептивное нейромышечное проторение (Proprioceptive Neuromuscular Facilitation – PNF) [5], концепция Бобат [6] и концепция Бруннстрема [7].
- PNF базируется на знаниях принципов биомеханики тела и нейрофизиологии и позволяет в значительной степени улучшить функциональное состояние двигательных центров за счет усиления сигнала реагирующих на растяжение или сжатие проприоцепторов, заложенных в мышцах, суставах и связках. В основе PNF лежат следующие механизмы:
- использование сложных движений (сочетание элементов ротации и диагональных двигательных паттернов);
- стимуляция мышечной активности посредством проприоцептивных ручных техник и вербальных и/или визуальных команд;
- широкое использование мышечного синергизма с целью максимальной стимуляции слабых мышечных групп.
С помощью определенных манипуляций, воздействуя на проприорецепторы, можно стимулировать, инициировать или облегчать выполнение того или иного движения. Кроме того, можно корректировать направление, силу и объем движения. Методика PNF позволяет сформировать и, что крайне важно, закрепить движения на более высоких уровнях центральной нервной системы. Это в свою очередь способствует образованию новых правильных статических и динамических двигательных стереотипов и соответственно увеличению объема движений и повышению уровня двигательной активности.
Концепция Бобат базируется на нейрофизиологии и представляет собой целостную комплексную терапию, направленную на подавление патологических двигательных моделей и стимулирование правильных физиологических движений. При проведении занятий по этой концепции происходит стимуляция процессов нейропластичности головного мозга и его способности к реорганизации, когда здоровые участки головного мозга берут на себя функции пострадавших зон.
В основе концепции Бобат лежат мануальное обращение и понимание естественного движения, а также оптимизация двигательных функций через улучшение отдельных движений и постурального контроля. Его центральный механизм включает нормальный постуральный тонус, нормальную реципрокную иннервацию, нормальный механизм сенсомоторной обратной связи, постуральные реакции, реакции равновесия и нормальные биомеханические свойства мышц.
Известны три базовых принципа концепции Бобат.
- Ингибиция – торможение патологических движений, положений тела и рефлексов, которые препятствуют развитию нормальных движений.
- Фасилитация (облегчение выполнения правильных физиологичных движений) – сенсомоторный процесс обучения. Фасилитация облегчает взаимодействие между пациентом и терапевтом, что способствует выполнению больным правильных движений.
- Стимуляция с помощью тактильных и кинестетических стимулов, которая облегчает выработку правильного восприятия и ощущения пациентом физиологичных движений и нормального положения тела в пространстве.
Принципы лечебного обращения, используемые при терапии, основанной на концепции Бобат:
- перенос веса;
- медленные растяжки, направленные от проксимальных отделов к дистальным;
- выбор оптимальной скорости движения с целью нормализации мышечного тонуса;
- правильное позиционирование;
- миофасциальный релизинг.
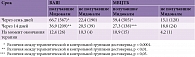
В таблицах 1 и 2 представлены цели реабилитации при различных видах постинсультной спастичности мышц верхней и нижней конечности. Особенности проведения ЛФК при постинсультной спастичности зависят от времени, прошедшего с момента развития заболевания, степени выраженности пареза мышц и мышечного тонуса. В первые дни после инсульта применяют пассивные движения и постуральную коррекцию – комплекс мероприятий, направленных на обеспечение правильной укладки пациента в кровати, чтобы потенциально склонные к повышению тонуса мышцы находились по возможности в расслабленном положении, а точки прикрепления мышц-антагонистов – в максимально приближенном положении. При этом укладка и фиксация конечностей должны быть непродолжительными.
Для снижения мышечного тонуса и спастичности мышц пациенты должны выполнять некоторые упражнения самостоятельно. При этом они должны следовать ряду рекомендаций [8]:
- выполнять самостоятельные упражнения в комплексе с другими методами реабилитации;
- выбирать одежду, которая не ограничивает движения;
- выбирать удобную обувь с нескользящей подошвой (кроссовки, высокие кеды);
- выполнять упражнения в медленном темпе;
- контролировать дыхание, не задерживая и не форсируя его;
- прекращать лечебную гимнастику при появлении дискомфортных и/или болевых ощущений во время выполнения упражнений.
Отметим некоторые особенности проведения ЛФК при спастических парезах:
- при повышении мышечного тонуса (в случае если мышечный тонус становится выше исходного) занятия немедленно останавливают;
- сочетанные движения в двух и более суставах применяются только после достижения пациентом полных независимых движений в каждом суставе по отдельности, чтобы не допустить появления содружественных движений;
- объем движений увеличивают постепенно по мере повышения силы мышц (от незначительной амплитуды до полного объема);
- при утомлении пациента после нескольких повторов одного упражнения выдерживают паузу в течение трех – пяти минут, во время которой пациент принимает положение сидя или лежа;
- осуществляется контроль дыхания (обеспечение ровного дыхания, избегание задержки дыхания, одышки);
- обеспечивается достаточно ранний переход от занятий ЛФК к эрготерапии.
Кроме того, важно дать рекомендации пациенту и его родственникам относительно нежелательных мероприятий при повышении мышечного тонуса [9]:
- поднимание согнутой в локтевом суставе и отведенной верхней конечности;
- прикрепление к верхней конечности плоской лангеты;
- занятия с гантелями и другими спортивными снарядами пораженной рукой;
- сжатие в кисти эспандера и других предметов в случае невозможности полного раскрытия кисти и полного разведения пальцев;
- тренировка мелкой моторики рук (захват мелких предметов);
- удержание в пораженной руке ходунков/многоопорной трости.
Статистически значимый эффект демонстрирует включение в общую схему реабилитации пациентов с повышенным мышечным тонусом медикаментозного лечения. Среди лекарственных средств с целью нормализации мышечного тонуса применяются баклофен [10, 11], дантролен (в России не зарегистрирован) [12], толперизон (Мидокалм) [13–16], тизанидин [1, 10], а также препараты ботулинического токсина А [1, 9, 13]. Несмотря на достаточно обширный список предлагаемых лекарственных средств, среди исследователей и клиницистов нет единого мнения по поводу наибольшей эффективности, продолжительности действия, распространенности и выраженности нежелательных явлений какого-либо из них.
Безусловно, к выбору лекарственного средства для борьбы с мышечной спастичностью у пациентов, перенесших органическое поражение головного мозга, необходимо подходить дифференцированно. Так, при назначении того или иного миорелаксанта следует учитывать выраженность и распространенность спастичности, давность перенесенного заболевания, сопутствующие патологические состояния, ответ пациента на уже используемые методы борьбы с повышенным мышечным тонусом. Существенный момент при выборе миорелаксанта – продолжительность действия препарата, и не последнюю роль играет его стоимость.
Цель и задача исследования
Перечисленные обстоятельства послужили стимулом для проведения исследования с целью повышения эффективности реабилитации пациентов, имеющих мышечную спастичность в результате органического поражения головного мозга. Задача исследования – оценка эффективности и безопасности использования Мидокалма (толперизона) в реабилитации данной категории пациентов.
Мидокалм – мышечный релаксант центрального действия, проявляет мембраностабилизирующее свойства и оказывает дозозависимое влияние на транспорт натрия через мембрану нейронов [16]. Кроме того, Мидокалм ингибирует синтез нейротрансмиттеров, блокируя вольтаж-зависимые кальциевые каналы [17], ослабляет активность спинальных путей, которые участвуют в формировании повышенного мышечного тонуса, и уменьшает патологическую активность ретикулярной формации ствола головного мозга [18].
Материал и методы
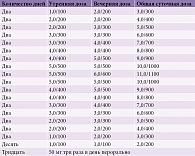
Анализу подвергнуты результаты лечения 1700 пациентов (936 женщин и 764 мужчин), перенесших ишемический инсульт. Средний возраст составил 63,4 года (от 30 до 84 лет). Пациенты были разделены на две группы по 850 человек, стандартизированные по различным показателям: возраст, пол, срок заболевания, тяжесть состояния, степень выраженности неврологических и психоэмоциональных нарушений, уровень бытовой адаптации, качество жизни, а также проводимые методы физической, физиотерапевтической, нейропсихологической, психотерапевтической и медикаментозной реабилитации (принцип matched-controlled) (табл. 3). Терапия, которую получали пациенты в процессе реабилитации, отличалась применением (группа 1) и неприменением (группа 2) Мидокалма. Пациентам группы 1 Мидокалм назначался спустя два – шесть месяцев после инсульта. Схема применения и дозы Мидокалма варьировались в зависимости от индивидуальной реакции на действие препарата (состояния мышечного тонуса и появления нежелательных последствий терапии) (табл. 4).
Анализ результатов лечения проводился по следующим параметрам: выраженность мышечного тонуса, спастичности и болевого синдрома, восстановление неврологических функций, уровень социально-бытовой адаптации, психоэмоциональное состояние и качество жизни пациентов.
Степень выраженности спастичности оценивалась с помощью шкалы Ашворта [11]. Кроме того, для определения влияния препарата на силу мышц пациентов просили пройти по ровной горизонтальной поверхности, после чего измеряли расстояние, которое пациенты были способны преодолеть за две минуты. Состояние мышечного тонуса анализировалось дважды: непосредственно и через шесть месяцев после окончания исследования. Выраженность болевого синдрома оценивалась три раза: через семь, 14 дней после начала исследования и по окончании исследования.
Поскольку оценка выраженности болевого синдрома носит достаточно субъективный характер, для объективизации результатов исследования были использованы две шкалы оценки боли: Визуальная аналоговая шкала Хаскиссона (ВАШ) [19] и Многомерный вербально-цветовой тест боли (МВЦТБ) [20]. В качестве диагностического средства в МВЦТБ используются как вербальные, так и невербальные символы, прежде всего цвет. МВЦТБ позволяет проводить дифференциальную диагностику психогенного болевого синдрома, который нередко встречается среди рассматриваемой категории пациентов и может несколько искажать объективные результаты исследования относительно оценки выраженности болевого синдрома.
Нарушение и восстановление неврологических функций определялись при помощи индекса Бартел [21], шкалы Линдмарка [22] и Скандинавской шкалы [23]. По индексу Бартел оценивали двигательные функции и бытовую адаптацию, по шкале Линдмарка – функции движения и чувствительности, по Скандинавской шкале – двигательные, речевые функции, ориентацию во времени, пространстве и собственной личности. Вычислялось среднее арифметическое количество баллов, набранное по всем трем перечисленным шкалам. Степень восстановления определялась следующим образом: отсутствие восстановления –менее 30% баллов от максимального количества, минимальное восстановление – 30–49%, удовлетворительное – 50–74%, достаточное – 75–94%, полное восстановление – более 94%.
Для оценки уровня бытовой и социальной адаптации (использование туалета, умывание, принятие ванны, одевание, прием и приготовление пищи, вождение автомобиля, сексуальная активность) применяли шкалу самооценки бытовых возможностей повседневной жизни Мертон и Саттон: отсутствие бытовой адаптации – 0 баллов, минимальная адаптация – 1–29 баллов, удовлетворительная – 30–45 баллов, достаточная – 46–58 баллов, полная бытовая адаптация – 59 баллов [24].
Психоэмоциональное состояние оценивалось с помощью шкалы депрессии Бека [25] и шкалы самооценки депрессии Уэйкфилда [26], на основании которых в процентном отношении рассчитывалось среднее значение распространенности депрессии в каждой группе.
Качество жизни пациентов определялось с помощью Профиля влияния болезни (Sickness Impact Profile – SIP) [27]:
- 0 баллов – отсутствие нарушений качества жизни;
- 1–10 баллов – минимальные нарушения;
- 11–25 баллов – легкие нарушения;
- 26–40 баллов – умеренные нарушения;
- 41–55 баллов – выраженные нарушения;
- более 55 баллов – грубые нарушения.
Кроме того, были проанализированы нежелательные явления и частота их возникновения как в группе пациентов, получавших Мидокалм, так и в контрольной группе.
Критерии включения пациентов в настоящее исследование:
- диагноз – инфаркт головного мозга, подтвержденный при проведении компьютерной или магнитно-резонансной томографии;
- степень спастичности (3 или 4 балла по шкале Ашворта);
- выраженность болевого синдрома – сильная и очень сильная боль (5–9 баллов по ВАШ);
- расстояние, проходимое пациентом в течение двух минут (до 10 м);
- степень нарушения неврологических функций (количество баллов по индексу Бартел, шкале Линдмарка и Скандинавской шкале – не более 24% от максимального количества баллов);
- степень социально-бытовой дизадаптации:
- количество баллов по шкале Мертон и Саттон – не более 24% от максимального количества баллов;
- зависимость при выполнении и/или невозможность осуществления основных социально-бытовых навыков;
- психоэмоциональное состояние (наличие выявленной с помощью опросника Бека и шкалы Уэйкфилда депрессии средней и тяжелой степени выраженности);
- качество жизни (более 55 баллов по SIP).
Анализ результатов исследования проводился с помощью пакетов программы SPSS 13.0. Для сравнения качественных признаков и процентных соотношений применяли критерий независимости качественных (категориальных) признаков χ², точный критерий Фишера, а также коэффициент неопределенности (J). Наличие зависимости между изучаемыми признаками признавалось, если доверительный уровень составлял р < 0,05. При частоте изучаемого события менее пяти наблюдений в одной из ячеек таблицы использование критерия χ2 признавалось некорректным и требовало применения точного критерия Фишера.
Результаты и их обсуждение
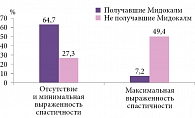
Согласно результатам исследования, Мидокалм статистически значимо по сравнению с контрольной группой снижал мышечный тонус пациентов после инсульта (р < 0,0001, J = 51,3%). Так, у пациентов, принимавших Мидокалм, минимальная выраженность спастичности и ее отсутствие (0 и 1 балл по шкале Ашворта) отмечались в 64,7% случаев, а максимальная выраженность спастичности (3 и 4 балла по шкале Ашворта) – в 7,2% случаев (в группе больных, не получавших данный препарат, аналогичные показатели составили 27,3 и 49,4% соответственно) (рис. 1).
Важно, что, согласно оценке состояния мышечного тонуса, положительный эффект применения Мидокалма наблюдался и после окончания исследования. Так, у 82,6% пациентов, получавших Мидокалм и имевших выраженный положительный эффект непосредственно после окончания исследования (минимальная выраженность спастичности и ее отсутствие: 0 и 1 балл по шкале Ашворта), результат сохранился и через шесть месяцев после окончания терапии. Это выгодно отличает Мидокалм от некоторых других миорелаксантов, в том числе от препаратов ботулинического токсина А.
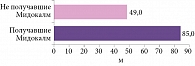
Наибольшее расстояние, которое пациенты были способны преодолеть по горизонтальной ровной поверхности за две минуты, также отмечалось в группе препарата Мидокалм: средняя максимальная дистанция на момент окончания исследования составила 85 м (рис. 2).
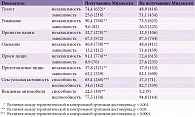
Результаты исследования свидетельствуют об эффективности Мидокалма относительно уменьшения или купирования болевого синдрома. При этом максимальная эффективность Мидокалма в данном отношении проявлялась в течение первой недели терапии. Через неделю после начала терапии 66,7% пациентов, получавших Мидокалм, отметили купирование или значительное уменьшение выраженности болевого синдрома по ВАШ (отсутствие боли или ее минимальная и умеренная выраженность), в контрольной группе аналогичный показатель составил 22,4% (р < 0,0001). По МВЦТБ данные показатели (отсутствие боли, очень слабая/слабая боль) соответственно равнялись 59,4 и 15,1% (р < 0,0001) (табл. 5).
В течение второй недели исследования число пациентов, у которых болевой синдром купировался или значительно уменьшился, также было статистически значимо выше в группе Мидокалма, нежели в контрольной группе, однако данные различия выражены в меньшей степени. Спустя 14 дней от момента начала исследования купирование или значительное уменьшение выраженности болевого синдрома по ВАШ (отсутствие боли или ее минимальная и умеренная выраженность) отметили еще 36,9% больных в группе Мидокалма и 20,5% больных в контрольной группе (р < 0,01). По МВЦТБ данные показатели (отсутствие боли, очень слабая и слабая боль) составили 27,3 и 18,8% соответственно (р < 0,05) (см. табл. 3).
Различия в числе пациентов, у которых болевой синдром купировался или уменьшился в значительной степени в течение третьей и последующих недель исследования, и вовсе не имеют статистической значимости. Таким образом, результаты исследования свидетельствуют о возможности применения Мидокалма как достаточно эффективного экстренного анальгетического средства у пациентов с повышенным мышечным тонусом и болевым синдромом после перенесенного инсульта.
В таблице 6 представлены результаты исследования влияния Мидокалма на восстановление неврологических функций после инсульта. Препарат статистически значимо улучшал функциональное состояние пациентов после инсульта (р < 0,0001, J = 52,6%). Так, в группе пациентов, получавших Мидокалм, достаточная и полная степень восстановления неврологических функций наблюдалась у 72,3% больных, а в контрольной группе – у 34,3%.
Еще большее положительное влияние Мидокалм оказал на уровень бытовой адаптации пациентов после инсульта. Так, в группе пациентов, которым назначался данный препарат, достаточная и полная степень бытовой адаптации отмечалась в 86,4% случаев, а в группе не получавших данный препарат – в 42,9% случаев, различия статистически значимы (р < 0,0001, J = 54,8%) (см. табл. 4).
Как показали результаты исследования, Мидокалм статистически значимо влиял на достижение пациентами независимости при выполнении основных бытовых и социальных навыков (табл. 7). Так, 74,7% пациентов, получавших Мидокалм, приобрели независимость при использовании туалета (48,9% в группе сравнения, р < 0,001), 90,3% – при умывании (73,5% в группе сравнения, р < 0,05), 32,7% – при принятии ванны (12,5% в группе сравнения, р < 0,05), 86,8% – при одевании (в 48,4% в группе сравнения, р < 0,0001), 91,1% – при приеме пищи (72,3% в группе сравнения, р < 0,05), 37,8% – при приготовлении пищи (17,9% в группе сравнения, р < 0,05).
Согласно результатам исследования, прием Мидокалма сыграл существенную роль в нормализации сексуальной жизни пациентов, перенесших инсульт (до начала заболевания по 410 человек в каждой группе вели регулярную половую жизнь). Так, в группе Мидокалма 65,4% больных, сексуально активных до развития инсульта, вернулись к регулярным сексуальным контактам (17,4% в группе сравнения, р < 0,0001) (см. табл. 7). Кроме того, применение Мидокалма способствовало возвращению навыка вождения автомобиля (до начала заболевания по 173 человек в каждой группе самостоятельно управляли автомобилем). Автомобилем стали управлять 22,8% пациентов, получавших Мидокалм, и только 5,4% пациентов в группе сравнения (р < 0,05) (см. табл. 7).
Использование Мидокалма статистически значимо влияло на нормализацию психоэмоционального состояния пациентов после инсульта. Так, среди пациентов, принимавших данный препарат, депрессия отсутствовала у 72,1%, ее легкая степень наблюдалась у 49,1%, а тяжелая – у 11,6%. В группе больных, не получавших Мидокалм, аналогичные показатели составили 50,7, 34,7 и 28,7% соответственно. Таким образом, применение Мидокалма достоверно улучшало психоэмоциональное состояние постинсультных пациентов (р < 0,05).
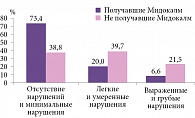
И, наконец, еще один ключевой показатель – качество жизни пациентов, улучшение которого является конечной целью любого метода восстановительного лечения. Согласно данным SIP, уровень качества жизни пациентов, принимавших Мидокалм, статистически значимо выше, чем у больных, не получавших данный препарат: 73,4 и 38,8% соответственно (р < 0,0001). Напротив, выраженные и грубые нарушения качества жизни отмечали 6,6% пациентов в группе Мидокалма и 21,5% в контрольной группе (р < 0,05) (рис. 3).
Необходимо подчеркнуть, что использование Мидокалма статистически значимо улучшало и физические, и психосоциальные, и бытовые составляющие качества жизни (табл. 8). Так, в группе пациентов, получавших Мидокалм, отсутствие и минимальная выраженность нарушений физических аспектов качества жизни (уход за телом, перемещение, функциональная мобильность) наблюдались у 77,6% больных, в контрольной группе – у 34,2% (р < 0,0001). Выраженные и грубые нарушения регистрировались у 5,1 и 26,4% соответственно (р < 0,05).
Отсутствие и минимальная выраженность нарушений психосоциальных аспектов качества жизни (эмоциональность, социальное взаимодействие, инициативность, энергичность поведения, общение) отмечались у 63,3% пациентов, получавших Мидокалм, и 44,1% больных контрольной группы (р < 0,001). Выраженные и грубые нарушения выявлялись у 8,6 и 18,1% соответственно (р < 0,05).
В группе пациентов, принимавших Мидокалм, отсутствие и минимальная выраженность нарушений бытовых аспектов качества жизни (работа, сон, отдых, досуг, питание, ведение домашнего хозяйства) регистрировались в 79,3% случаев, в контрольной группе – в 38,1% (р < 0,0001). Выраженные и грубые нарушения отмечались у 6,2 и 20,1% пациентов соответственно (р < 0,05).
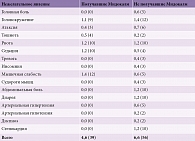
Нежелательные явления чаще возникали в контрольной группе, чем в основной: 56 (6,6%) и 39 (4,6%) пациентов соответственно (табл. 9). В случае применения Мидокалма побочные эффекты (головокружение, атаксия, тошнота, рвота, седация, мышечная слабость) не приводили к отмене лечения, после корректировки дозы препарата состояние пациентов нормализовалось, и исследование благополучно продолжилось.
Выводы
Адекватное ведение пациентов с тяжелыми инвалидизирующими заболеваниями, имеющими мышечную спастичность, – важная составляющая комплексной реабилитации, которая требует соблюдения мультидисциплинарного принципа и определенных правил.
Купирование или по крайней мере уменьшение выраженности боли и спастичности после инсульта – важное условие повышения степени восстановления функций пациентов, уровня их социально-бытовой адаптации и улучшения качества жизни, что является конечной целью реабилитационного лечения.
Результаты проведенного исследования свидетельствуют о необходимости назначения миорелаксантов, в частности Мидокалма, в рамках комплексного ведения постинсультных пациентов для улучшения состояния их мышечного тонуса, купирования болевого синдрома, повышения степени восстановления неврологических функций, уровня бытовой и социальной адаптации, нормализации психоэмоционального состояния, а также улучшения качества жизни. Согласно результатам настоящего исследования, Мидокалм эффективно решает перечисленные задачи. Значимым аргументом в пользу применения Мидокалма при реабилитации данной категории пациентов является длительное сохранение эффекта (как минимум в течение шести месяцев). Полученные результаты согласуются с данными других авторов, свидетельствующих об эффективности Мидокалма в терапии постинсультной спастичности [13–16].
Учитывая определенное разнообразие лекарственных препаратов, предлагаемых для реабилитации постинсультных больных с повышенным мышечным тонусом, и отсутствие единодушного мнения исследователей и клиницистов в отношении их эффективности и целесообразности применения, дальнейшие исследования в этой области представляются весьма интересными и крайне полезными.
V.V. Kovalchuk, I.B. Zuyeva, K.V. Nesterin, Zh. Uap Talgatuly
City Hospital No 38 named after N.A. Semashko, Saint Petersburg
City Clinical Hospital No 1, Cheboksary
Semey State Medical University, Kazakhstan
Contact person: Vitaly Vladimirovich Kovalchuk, vikoval67@mail.ru
The article describes the features of multidisciplinary management of patients with muscle spasticity, which has undergone organic brain damage. The main types of spasticity and rehabilitation goals for each of them. The physical and medical methods of rehabilitation of this category of patients, as well as the features of various methods of therapeutic physical culture are being analyzed in details: proprioceptive neuromuscular facilitation and the Bobath concept. The results of the study involving 1700 patients with increased muscle tone after stroke are presented. The patients were divided into two standardized groups: those who received and those who did not receive Mydocalm (tolperisone). The severity of muscle tone was determined by the Ashworth Scale, pain by the Visual Analog Scale of Huskisson and Multidimensional Verbal-Color Pain Test, the degree of recovery of neurological functions by the Barthel Index, the Lindmark Scale and the Scandinavian Stroke Scale, the level of household adaptation by the Merton and Sutton Self-Assessment Scale, psycho-emotional state according to Beck Depression Inventory and Wakefield Self-Assessment of Depression Inventory, quality of life-according by Sickness Impact Profile. Mydocalm contributed to the normalization of muscle tone, relief of pain syndrome, increase the degree of neurological functions restoration, social and household adaptation, normalization of the psycho-emotional state of patients after stroke, as well as improving the quality of their lives. In addition, the results of the study indicated good tolerability of Mydocalm and long-term (for at least six months) preservation of the effect.
