Новейшие исследования гормональной терапии распространенного РМЖ. Пришло ли время пересмотреть стандарты? III Петербургский международный онкологический форум «Белые ночи». Сателлитный симпозиум компании «АстраЗенека»
- Аннотация
- Статья
- Ссылки
На симпозиуме, организованном в рамках III Петербургского международного онкологического форума «Белые ночи» (23 июня 2017 г.), ведущие российские специалисты-онкологи обсудили актуальные вопросы лечения гормон-рецептор-позитивного рака молочной железы. По мнению экспертов, внедрение новых препаратов, относящихся к классу стероидных антиэстрогенов, ингибирующих пролиферативные эффекты эстрогенов на чувствительные к ним ткани, позволяет индивидуализировать тактику лечения больных метастатическим раком молочной железы, отдаляет сроки прогрессирования заболевания и способствует увеличению общей выживаемости.
На симпозиуме, организованном в рамках III Петербургского международного онкологического форума «Белые ночи» (23 июня 2017 г.), ведущие российские специалисты-онкологи обсудили актуальные вопросы лечения гормон-рецептор-позитивного рака молочной железы. По мнению экспертов, внедрение новых препаратов, относящихся к классу стероидных антиэстрогенов, ингибирующих пролиферативные эффекты эстрогенов на чувствительные к ним ткани, позволяет индивидуализировать тактику лечения больных метастатическим раком молочной железы, отдаляет сроки прогрессирования заболевания и способствует увеличению общей выживаемости.




Прошлое и настоящее гормональной терапии распространенного рака молочной железы
Заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова, профессор кафедры онкологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, д.м.н. Татьяна Юрьевна СЕМИГЛАЗОВА в начале выступления отметила, что рак молочной железы (РМЖ) – социально значимое заболевание, занимающее ведущее место в структуре онкологической заболеваемости и смертности в мире. При этом 2/3 карцином молочной железы сохраняют зависимость от гормональной стимуляции. Рост опухоли стимулируется собственными эстрогенами. Среди многообразия видов РМЖ гормонозависимый подтип характеризуется более благоприятным течением и ответом на специфическую гормонотерапию. Даже при наличии висцеральных метастазов терапией выбора при гормонозависимом РМЖ остается гормональная. Химиотерапия применяется при быстро прогрессирующих формах РМЖ, сопровождающихся висцеральным кризом, в том числе развившимся во время предшествующих линий гормонотерапии, а также в гормонорезистентных случаях. Докладчик подчеркнула, что сохранение качества жизни при РМЖ – одна из важнейших задач терапии1.
История гормонотерапии РМЖ насчитывает свыше 100 лет. За этот период было предложено множество методов гормонотерапии – от лучевой кастрации, применения андрогенов до использования антиэстрогенов, ингибиторов ароматазы и антипрогестинов. Особое место в истории гормонотерапии занимает открытие в 1962 г. E. Jensen эстроген-рецепторов (estrogen receptor, ER) в тканях-мишенях. Установленные впоследствии механизм активации ER и его роль в формировании пролиферативного сигнала позволили использовать определение количества ER для прогнозирования гормоночувствительности2.
Наиболее успешным считается лечение РМЖ с использованием антиэстрогенов и ингибиторов ароматазы. После первых попыток терапии РМЖ эстрогенами и андрогенами возникла гипотеза блокады ER в клетках с помощью антиэстрогенов. Антиэстрогены конкурентно связываются с внутриклеточными ER, препятствуют димеризации рецепторов и тем самым тормозят эстроген-опосредованную стимуляцию синтеза ДНК и репликацию клеток. С утверждения в 1977 г. Агентством по контролю над качеством лекарственных препаратов и пищевых продуктов (Food and Drug Administration) тамоксифена, результаты эффективности которого впервые представил М. Cole в 1971 г., началась новая эра в лечении распространенного РМЖ. Минимальная по сравнению с прогестинами и другими препаратами токсичность определила выбор в пользу тамоксифена. Однако эффективность всех таргетных препаратов, в частности тамоксифена, зависит от повышенной экспрессии молекулярной мишени.
Наряду с тамоксифеном вторым значимым компонентом терапии больных гормон-рецептор-позитивным РМЖ являются ингибиторы ароматазы третьего поколения. В ряде рандомизированных исследований эти препараты сравнивали с мегестрола ацетатом в первой и второй линиях гормонотерапии у пациенток в постменопаузе с распространенным РМЖ. Ингибиторы ароматазы показали статистически значимое преимущество перед мегестрола ацетатом в отношении эффективности и переносимости3.
Новый этап в лечении больных гормонозависимым РМЖ начался с момента внедрения чистых антиэстрогенов. Представитель этой группы фулвестрант относится к стероидным антиэстрогенам, производным эстрадиола. В отличие от тамоксифена он обеспечивает более полное ингибирование транскрипции эстрогензависимых генов и не обладает агонистической активностью4. Кроме того, удобный прием препарата позволяет пациентам поддерживать приверженность терапии на должном уровне: в клинической практике используется доза 500 мг один раз в месяц внутримышечно с нагрузочной дозой 500 мг в 14-й день первого месяца.
Изучению эффективности и безопасности фулвестранта посвящен ряд исследований. Так, в ранних клинических исследованиях III фазы (0020/0021) оценивали эффективность фулвестранта (Фазлодекс®) в сниженной дозе 250 мг ежемесячно и ингибитора ароматазы третьего поколения (анастрозола) у постменопаузальных пациенток с ER-положительным метастатическим РМЖ, прогрессирующим на фоне адъювантной гормональной терапии или гормональной терапии первой линии. 428 больных принимали фулвестрант 250 мг, 423 – анастрозол. Как показали результаты, фулвестрант в дозе 250 мг в месяц не уступал анастрозолу по времени до прогрессирования заболевания5, 6.
Результаты международного двойного слепого исследования CONFIRM (III фаза) в параллельных группах подтвердили предположения о повышении эффективности при увеличении дозы и послужили основанием для регистрации препарата фулвестрант в дозе 500 мг. В исследовании участвовали женщины в постменопаузе с ER-положительным статусом после адъювантной гормонотерапии или гормонотерапии первой линии тамоксифеном либо ингибиторами ароматазы. Препарат в дозе 500 мг не только вызывал значимое уменьшение риска прогрессирования заболевания, но практически не влиял на частоту возникновения нежелательных явлений и не приводил к изменению качества жизни пациенток7.
Отсутствие перекрестной резистентности и различный механизм действия фулвестранта, тамоксифена и нестероидных ингибиторов ароматазы (анастрозола, летрозола) создают уникальную возможность для широкого применения чистых антиэстрогенов у больных РМЖ. Установлено, что пациентки, отвечающие на терапию фулвестрантом, сохраняют чувствительность к последующей эндокринотерапии.
Таким образом, Фазлодекс® является наиболее предпочтительной опцией в монотерапии больных гормонозависимым РМЖ. При этом внутримышечное введение препарата один раз в месяц позволяет лучше контролировать лечение. Благоприятный профиль безопасности и переносимость Фазлодекса позволяют больным РМЖ сохранять приемлемое качество жизни, что наряду с увеличением продолжительности жизни является одной из основных целей терапии.
Гормональная терапия первой линии. Результаты исследования III фазы FALCON
Заместитель директора по лечебной работе, главный врач Института хирургии им. А.В. Вишневского, д.м.н., профессор Мария Михайловна КОНСТАНТИНОВА представила опубликованные в 2016 г. результаты исследования FALCON (III фаза). Предпосылками к его проведению послужили данные исследования FIRST (II фаза), в котором оценивали эффективность и безопасность фулвестранта 500 мг и анастрозола 1 мг в первой линии терапии больных метастатическим HER2-положительным РМЖ в менопаузе. Пациентки контрольной группы получали анастрозол 1 мг внутрь ежедневно, пациентки экспериментальной группы – фулвестрант 500 мг внутримышечно в 1-й, 14-й и 28-й день лечения, затем ежемесячно. Лечение проводили до прогрессирования заболевания или развития непереносимой токсичности. Первичной конечной точкой исследования была частота клинического эффекта, вторичными – медиана выживаемости без прогрессирования (ВБП), длительность объективного ответа и безопасность8.
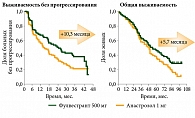
В группе фулвестранта медиана ВБП составила 23,4 месяца, в группе анастрозола – 13,1 месяца, медиана общей выживаемости (ОВ) – 54,1 и 48,4 месяца соответственно (рис. 1).
Максимальный клинический эффект от использования фулвестранта в первой линии терапии гормонозависимого РМЖ наблюдался у пациенток без висцеральных метастазов. Эти данные послужили основанием для проведения исследования FALCON (III фаза) – крупного международного многоцентрового исследования с участием 462 больных РМЖ из Северной и Южной Америки, Европы, Азии и Африки (средний возраст – 62–64 года). Перед исследователями стояла задача подтвердить результаты исследования FIRST. Чтобы установить превосходство фулвестранта перед анастрозолом в терапии первой линии при ER+/HER2-негативном метастатическом РМЖ у женщин в менопаузе, ранее не получавших эндокринной терапии, из группы анастрозола исключили больных, ранее применявших ингибиторы ароматазы в адъювантном режиме.
Первичной конечной точкой исследования была ВБП, вторичными – ОВ, продолжительность объективного ответа, ожидаемая продолжительность клинически значимого эффекта, качество жизни, безопасность.
Больных рандомизировали на две группы, одна из которых (n = 230) получала фулвестрант (500 мг внутримышечно в 1-й, 14-й, 28-й день, с последующим введением каждые 28 дней), другая (n = 232) – анастрозол (1 мг ежедневно, длительно). Не исключалось и назначение химиотерапии.
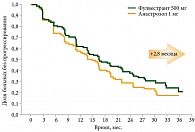
Критериями включения были постменопауза, местнораспространенный или метастатический РМЖ, гистологическое подтверждение ER+/HER2-негативного рака, функциональный статус 0–2, более одного измеряемого или неизмеряемого очага, а также не более одной линии химиотерапии. Критерии исключения: эндокринная терапия РМЖ в анамнезе, системная заместительная гормонотерапия с использованием эстрогенов менее чем за шесть месяцев до рандомизации, наличие угрожающих или висцеральных метастазов, лучевая терапия менее чем за 28 дней до начала исследования. В обеих группах отмечалась достаточно высокая частота больных с висцеральными поражениями (в группе фулвестранта – 135, группе анастрозола – 119). Медиана ВБП в группе фулвестранта составляла 16,6 месяца, в группе анастрозола – 13,8 месяца (p = 0,0488). Риск прогрессирования на фоне терапии фулвестрантом был на 20% ниже, чем при использовании анастрозола (рис. 2).
При подгрупповом анализе показатель ВБП у больных, к началу лечения не имевших метастатического поражения печени и легких, достигал 22,3 и 13,8 месяца соответственно.
Результаты исследования показали статистически и клинически значимое преимущество фулвестранта перед анастрозолом в группе больных РМЖ без висцеральных метастазов. Риск прогрессирования в группе фулвестранта был на 41% ниже, чем в группе анастрозола.
Кроме того, анализ показателей ожидаемой ОВ пациенток без висцеральных метастазов (31% событий) в группе фулвестранта продемонстрировал тенденцию к снижению риска смерти.
Качество жизни пациенток в группах было сопоставимым. Профиль нежелательных явлений на фоне применения фулвестранта и анастрозола соответствовал известным данным о профиле безопасности этих препаратов. Различий между группами в отношении частоты серьезных нежелательных явлений и отмены терапии из-за развития нежелательных эффектов не выявлено. Среди нежелательных явлений чаще встречались артралгия (16,7% – в группе фулвестранта, 10,3% – в группе анастрозола) и приливы (11,4 и 10,3% соответственно).
В заключение профессор М.М. Константинова подчеркнула, что к 2016 г. получены новые данные об эффективности фулвестранта в первой линии терапии пациенток в менопаузе с ER+/HER2-негативным метастатическим РМЖ, ранее не получавших гормонотерапии. В исследовании FALCON (III фаза) эффективность фулвестранта 500 мг в первой линии терапии в отношении ВБП и ОВ превосходила таковую анастрозола. Фулвестрант характеризуется низкой токсичностью, хорошей переносимостью и не снижает качество жизни больных. Преимущество фулвестранта 500 мг наиболее выражено у пациенток с невисцеральными метастазами.
Таким образом, данные последних исследований подтверждают эффективность фулвестранта у больных без висцеральных метастазов в ранних линиях эндокринной терапии. Для достижения максимального эффекта целесообразно назначение фулвестранта как наиболее эффективного препарата первой линии9.
Предпосылки к различиям в эффективности препаратов гормональной терапии
По словам заведующего отделом биологии опухолевого роста Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова, д.м.н., профессора кафедры онкологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, руководителя кафедры медицинской генетики Санкт-Петербургского государственного педиатрического медицинского университета, члена-корреспондента РАН Евгения Наумовича ИМЯНИТОВА, эстрогены стимулируют пролиферацию эпителия молочной железы, воздействуя на рецепторы. Первым селективным модулятором ER стал препарат тамоксифен, а также его аналоги. Препараты, относящиеся к селективным модуляторам, инактивируют ER посредством связывания. Однако, согласно результатам клинических исследований эффективности тамоксифена, связывание с рецептором не всегда приводит к инактивации ER-каскада. Например, в популяции больных РМЖ, у которых обнаружена активация онкогена HER2, тамоксифен неэффективен. Кроме того, в ходе лабораторных экспериментов наблюдалось парадоксальное увеличение активности ER. В результате последующего широкомасштабного внедрения тамоксифена в клиническую практику удалось установить ограничения по его применению, что стимулировало разработку новых антиэстрогенных препаратов.
Согласно данным исследований, ингибитор секреции гонадотропинов гозерелин эффективен только до менопаузы, поскольку воздействует исключительно на продукцию эстрогенов в яичниках10. Больные РМЖ, у которых отсутствует эффект от терапии тамоксифеном и гозерелином, нуждаются в новых, более эффективных антиэстрогенных препаратах.
Ингибиторы ароматазы были разработаны для предотвращения синтеза эндогенных эстрогенов у женщин в пост- и пременопаузальном периоде со сниженной овариальной функцией. Ингибиторы ароматазы третьего поколения (анастрозол, летрозол, эксеместан) оказывают сопоставимое клиническое действие и превосходят по эффективности тамоксифен в эндокринотерапии у женщин в постменопаузальном периоде с гормонозависимым РМЖ. В ряде случаев независимо от применяемых антиэстрогенных препаратов злокачественные опухоли молочной железы становятся рефрактерными к торможению действия эстрогена. Главной причиной гормональной резистентности клеток РМЖ считается функциональная инактивация гена ER.
Установлено также, что эстрогенная депривация приводит к селекции клеток, содержащих сенситизирующую мутацию в ER11.
Иными словами, применение тамоксифена не всегда сопровождается эффективным угнетением ER-каскада, присутствует также парадоксальный активирующий эффект ER. При наличии активированной киназы препарат способствует фосфорилированию рецепторов. Именно поэтому тамоксифен неэффективен в лечении HER2-позитивного РМЖ. Препарат вызывает активацию пролиферативного каскада. В свою очередь под действием ингибиторов ароматазы возможна эстрогеннезависимая активация ER.
Современные подходы к эндокринотерапии гормонозависимого РМЖ рассматривают сигнальный каскад эстрогенов как мишень. При этом максимальную противоопухолевую эффективность демонстрируют препараты, воздействующие на ER, а не на механизмы их активации.
Фулвестрант – препарат для инактивации пролиферативного каскада, вызванного ER. В основе его действия лежит полный блок активации, димеризации и транслокации рецепторов в ядро клетки, расщепление рецепторов в лизосомах12.
В то время как механизм действия тамоксифена основан на антагонизме с ER, фулвестрант оказывает прямое разрушающее воздействие на ER. Тамоксифен действительно препятствует эстрогензависимой активации рецепторов, но в ответ на стимуляцию киназы рецептора провоцирует эту активацию. Ингибиторы ароматазы не влияют на киназную активацию рецепторов. В отличие от ингибиторов ароматазы фулвестрант подавляет как эстрогензависимую, так и эстрогеннезависимую активацию ER. Соответственно тамоксифен и ингибиторы ароматазы эффективны только в отношении отдельных компонентов сигнального каскада ER.
Результаты исследований продемонстрировали распространенность и клиническую значимость ESR1-мутаций у больных метастатическим РМЖ. Доказано, что мутация ESR1 – один из механизмов формирования эндокринной резистентности. Фулвестрант в комбинации с палбоциклибом разрушает ER независимо от наличия мутации13.
Профессор Е.Н. Имянитов отметил, что в отличие от других способов эндокринной терапии фулвестрант полностью блокирует активацию ER, их димеризацию и перенос в ядро клетки, тем самым подавляет все ER-опосредованные сигналы.
В клинических исследованиях эффективность фулвестранта превышала таковую других антагонистов каскада ER.
11 мая 2017 г. фулвестрант зарегистрирован на территории Российской Федерации в качестве первой линии эндокринной терапии распространенного РМЖ.
Пришло ли время изменить парадигму гормональной терапии рака молочной железы?
Ведущий научный сотрудник отделения клинической фармакологии и химиотерапии Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина, д.м.н. Марина Борисовна СТЕНИНА обратила внимание аудитории на то, что РМЖ занимает в России первое место в структуре заболеваемости и смертности от злокачественных новообразований среди женщин. Рациональная гормонотерапия пациенток с гормонозависимым РМЖ с использованием современных эффективных и безопасных препаратов способствует увеличению выживаемости, поддержанию приемлемого качества жизни.
Согласно рекомендациям Американского общества клинической онкологии (American Society of Clinical Oncology) 2016 г., у больных метастатическим РМЖ с наличием рецепторов стероидных гормонов в опухоли основу гормонотерапии первой линии составляют ингибиторы ароматазы. Различий между ингибиторами ароматазы и тамоксифеном в показателях общей выживаемости нет. Кроме того, для гормонотерапии больных метастатическим РМЖ рекомендованы нестероидные ингибиторы ароматазы, такие как летрозол, анастрозол14.
При выборе варианта эндокринной терапии РМЖ следует учитывать предшествующую гормонотерапию, функцию яичников, профиль токсичности, сопутствующую патологию и биологические особенности опухоли.
Эффективность основных методов гормонотерапии при РМЖ изучали в ряде рандомизированных клинических исследований. Так, в исследовании FALCON (III фаза) перед учеными стояла задача подтвердить преимущество фулвестранта перед анастрозолом в отношении ВБП у больных местнораспространенным или метастатическим гормонозависимым РМЖ, не получавших ранее гормонотерапии. Максимальная эффективность терапии наблюдалась среди больных РМЖ с мягкотканными, костными метастатическими очагами и отсутствием висцеральных метастазов. В исследовании FALCON у больных без висцеральных метастазов показатели безрецидивной выживаемости на фоне лечения фулвестрантом составили 22,3 месяца.
Анализ данных продолжительности ВБП в зависимости от характера метастазирования, основанный на результатах сравнительных исследований эффективности фулвестранта и анастрозола (FIRST и FALCON), продемонстрировал несомненное преимущество фулвестранта в группе больных без висцеральных метастазов.
В исследованиях FALCON, CONFIRM, PALOMA-3, BOLERO-2 было зафиксировано снижение эффективности гормонотерапии от первой к третьей линии, однако тенденция к преимуществу результатов лечения у больных без висцеральных метастазов сохранялась15, 16.
Согласно данным исследований, терапия метастатического РМЖ фулвестрантом значительно улучшает контроль заболевания без ущерба для здоровья больных, предупреждает прогрессирование заболевания, сохраняя при этом качество жизни. На основании полученных данных Минздрав России зарегистрировал новые показания для применения фулвестранта (Фазлодекс®). Препарат рекомендован для лечения местнораспространенного или метастатического ER-положительного РМЖ у женщин в постменопаузе, не получавших эндокринной терапии, а также при рецидиве во время или после проведения адъювантной эндокринной терапии либо при прогрессировании заболевания на фоне гормонотерапии.
Таким образом, сегодня Фазлодекс® на законных основаниях занимает лидирующую позицию в первой линии терапии метастатического ER-положительного РМЖ.
По словам докладчика, в настоящее время проводятся активные исследования ингибиторов циклинзависимых киназ. Включение препаратов этого класса в схему эндокринной терапии РМЖ позволит задерживать формирование резистентности к антагонистам сигнального каскада эстрогенов.
Как известно, рак характеризуется потерей контроля над клеточным циклом. Регуляция клеточного цикла осуществляется белками – циклинами. Их роль заключается в активации ферментов, так называемых циклинзависимых киназ (cyclin-dependent kinases, CDK). Гиперактивация CDK4/6 характерна для множества злокачественных опухолей, в том числе ER-положительного РМЖ, и приводит к утрате пролиферативного контроля.
Палбоциклиб – пероральный ингибитор CDK4/6 препятствует синтезу ДНК путем ареста перехода клетки из G1 в S фазу, in vivo наиболее эффективно угнетает рост клеточных линий люминального РМЖ.
Среди работ, посвященных изучению новых препаратов для лечения РМЖ, особый интерес вызывают результаты серии исследований PALOMA. В плацебоконтролируемом исследовании PALOMA-2 (III фаза) палбоциклиб в сочетании с ингибитором ароматазы летрозолом в первой линии терапии показал хорошие результаты в отношении медианы ВБП у женщин в менопаузе с распространенным ER-положительным HER2-негативным РМЖ. По оценке исследователей, время до прогрессирования в группе больных, получавших палбоциклиб в комбинации с летрозолом, составило 24,8 месяца17. Можно сказать, что эффективность комбинированного режима «палбоциклиб + летрозол» оказалась сопоставима с эффективностью монотерапии фулвестрантом в исследовании FALCON в подгруппе пациенток без висцеральных метастазов9.
В рандомизированном двойном слепом плацебоконтролируемом исследовании PALOMA-3 (III фаза) участвовала 521 больная диссеминированным гормонозависимым HER2-негативным РМЖ, получавшая ранее одну линию гормонотерапии по поводу метастатической болезни. Пациенток рандомизировали на группы комбинированной гормонотерапии (фулвестрант + палбоциклиб) и монотерапии фулвестрантом. Медиана безрецидивной выживаемости составила 9,2 месяца в группе комбинированной гормонотерапии (фулвестрант + палбоциклиб) и 3,7 месяца в группе монотерапии фулвестрантом. Добавление палбоциклиба не повлияло на увеличение токсичности проводимого лечения. Данные исследования PALOMA-3 позволяют считать комбинацию палбоциклиба и фулвестранта эффективным режимом гормонотерапии второй линии18.
Таким образом, в исследовании PALOMA палбоциклиб статистически значимо увеличивал медиану ВБП у больных метастатическим РМЖ. В сочетании с летрозолом в первой линии гормонотерапии и фулвестрантом во второй палбоциклиб продемонстрировал преимущества.
Как отметила М.Б. Стенина, анализ результатов исследований показывает необходимость совершенствования критериев отбора больных для того или иного метода лекарственной терапии РМЖ. Отвечая на вопрос о необходимости изменения парадигмы гормонотерапии, докладчик подчеркнула, что сегодня подходы к гормонотерапии пациенток с РМЖ основываются не только на знании закономерностей патогенеза и течения болезни, но и на доказательной базе, сформированной по результатам клинических исследований.
В настоящее время новые показания для применения фулвестранта расширяют возможности лечения женщин в постменопаузе с ER-положительным местнораспространенным или метастатическим РМЖ на ранних этапах.
Заключение
Фулвестрант (Фазлодекс®, компания «АстраЗенека») – представитель нового класса стероидных антиэстрогенов, ингибирующих пролиферативные эффекты эстрогенов на чувствительные ткани. По сравнению с нестероидными антиэстрогенными препаратами и другими модуляторами экспрессии ER фулвестрант характеризуется более высокой аффинностью к ER. Препарат действует как высокоселективный антагонист ER, полностью блокирует эффекты эстрогенов и не проявляет при этом эстрогеноподобной активности. Фазлодекс® отличают благоприятный профиль безопасности, хорошая переносимость и отсутствие серьезных побочных реакций. Препарат способствует повышению общей выживаемости, отдаляет сроки прогрессирования заболевания и позволяет сохранить больным метастатическим РМЖ качество жизни.
