количество статей
6422
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Оптимизация лечения гипертонической энцефалопатии с использованием нейропротекторной терапии Актовегином. Опыт клинического применения
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" № 2
- Аннотация
- Статья
- Ссылки
При неконтролируемой артериальной гипертонии хроническое нарушение мозгового кровообращения обусловливает развитие медленно прогрессирующего диффузного и очагового поражения вещества головного мозга – гипертонической энцефалопатии (ГЭ).
В статье рассмотрены стадии и синдромы ГЭ, ее лечение; приведено обоснование включения в схемы терапии ГЭ препаратов, улучшающих мозговой кровоток и метаболизм нервной ткани и способных замедлить прогрессирование энцефалопатии, например Актовегина. Этот содержащий исключительно физиологические компоненты препарат обладает инсулиноподобным, антигипоксическим, антиоксидантным, анаболическим, энергетическим эффектами, лежащими в основе органопротекторного воздействия Актовегина на головной мозг.
В статье рассмотрен клинический случай, демонстрирующий положительный эффект добавления нейрометаболического препарата к современной терапии, направленной на контроль артериального давления и коррекцию факторов риска.
При неконтролируемой артериальной гипертонии хроническое нарушение мозгового кровообращения обусловливает развитие медленно прогрессирующего диффузного и очагового поражения вещества головного мозга – гипертонической энцефалопатии (ГЭ).
В статье рассмотрены стадии и синдромы ГЭ, ее лечение; приведено обоснование включения в схемы терапии ГЭ препаратов, улучшающих мозговой кровоток и метаболизм нервной ткани и способных замедлить прогрессирование энцефалопатии, например Актовегина. Этот содержащий исключительно физиологические компоненты препарат обладает инсулиноподобным, антигипоксическим, антиоксидантным, анаболическим, энергетическим эффектами, лежащими в основе органопротекторного воздействия Актовегина на головной мозг.
В статье рассмотрен клинический случай, демонстрирующий положительный эффект добавления нейрометаболического препарата к современной терапии, направленной на контроль артериального давления и коррекцию факторов риска.
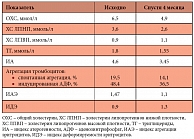
Таблица 1. Динамика показателей липидного спектра и клеточного звена гемостаза на фоне терапии
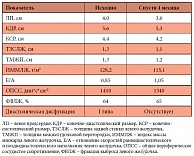
Таблица 2. Динамика эхокардиографических параметров в процессе лечения

Таблица 3. Динамика показателей суточного мониторирования артериального давления (АД) на фоне терапии
Цереброваскулярная болезнь (ЦВБ) стоит на втором месте после ишемической болезни сердца (ИБС) среди причин смерти во всем мире. Показатели смертности от сосудистых заболеваний головного мозга в России – одни из самых высоких в мире, что обусловлено неблагоприятными условиями жизни и низким качеством медицинского обслуживания, которое по многим параметрам отстает от стандартов, принятых в большинстве развитых стран. Мозговые инсульты (МИ) занимают второе место в структуре смертности населения России, приводят к потере трудоспособности и тяжелым нарушениям функций головного мозга у многих больных, переживших острую фазу.
По статистике, почти половина россиян, перенесших МИ, умирает от связанных с ним патологических процессов в течение года [1]. Известно, что в основе острых и хронических поражений головного мозга лежит целый ряд сердечно-сосудистых заболеваний (ССЗ), однако ведущее место среди них занимает артериальная гипертония (АГ). Именно АГ является одной из важнейших причин развития хронических форм недостаточности кровообращения головного мозга, геморрагического и ишемического инсультов (первичного и повторного), нарушений когнитивной функции [2, 3, 4, 5, 6, 7]. Выделяют следующие факторы риска развития инсульта, связанные с АГ:
- Уровень артериального давления (АД).
- Высокая активность ренина плазмы крови.
- Наличие гипертрофии левого желудочка (ГЛЖ).
- Высокое АД в утренние часы.
- Гипертонические кризы, приводящие к срывам механизмов мозговой ауторегуляции.
- Высокая вариабельность АД (колебания АД от высоких до низких значений).
Известно, что церебральная гемодинамика находится под постоянным контролем системы мозговой ауторегуляции, сложной нейрогуморальной системы, которая снижает мозговой кровоток при избытке притока крови и увеличивает при его дефиците. Система ауторегуляции контролирует приток крови к головному мозгу при уровне среднего АД в диапазоне от 60 до 150 мм рт. ст. (АД среднее = диастолическое АД (ДАД) + 1/3 пульсового давления) [6]. У больных с АГ этот диапазон смещен вверх вследствие увеличения сосудистого сопротивления, и нижняя граница ауторегуляции мозгового кровотока повышается до 85 мм рт. ст., что создает предпосылки для плохой переносимости гипотензивных состояний [4]. В структуре ЦВБ одно из ведущих мест занимает гипертоническая энцефалопатия (ГЭ, МКБ-10, рубрика I67.4).
ГЭ (хроническая форма) – медленно прогрессирующее диффузное и очаговое поражение вещества головного мозга, обусловленное хроническим нарушением мозгового кровообращения, связанным с длительно существующей неконтролируемой артериальной гипертонией [8, 9, 10], и является вариантом дисциркуляторной энцефалопатии (ДЭ). Впервые понятие ГЭ описали нейрофизиолог И.В. Ганнушкина и невролог Н.В. Лебедева в 1985 г. Авторы отметили, что у больных с АГ имеется значительное несоответствие между клиническими данными о перенесенных инсультах и наличием большого числа очагов в подкорковых узлах и белом веществе мозга (по данным компьютерной томографии) и еще большим числом очагов, обнаруживаемых при вскрытии. Патологические процессы, развивающиеся при АГ в головном мозге, являются результатом плазматического и геморрагического пропитывания, некроза стенки сосудов с ее последующим истончением. Для ГЭ характерно раннее поражение белого вещества головного мозга с признаками деструкции миелина нервных волокон, наличием мелких полостей, расширением периваскулярного пространства [10, 11].
ГЭ (хроническая форма) – медленно прогрессирующее диффузное и очаговое поражение вещества головного мозга, обусловленное хроническим нарушением мозгового кровообращения, связанным с длительно существующей неконтролируемой артериальной гипертонией [8, 9, 10], и является вариантом дисциркуляторной энцефалопатии (ДЭ). Впервые понятие ГЭ описали нейрофизиолог И.В. Ганнушкина и невролог Н.В. Лебедева в 1985 г. Авторы отметили, что у больных с АГ имеется значительное несоответствие между клиническими данными о перенесенных инсультах и наличием большого числа очагов в подкорковых узлах и белом веществе мозга (по данным компьютерной томографии) и еще большим числом очагов, обнаруживаемых при вскрытии. Патологические процессы, развивающиеся при АГ в головном мозге, являются результатом плазматического и геморрагического пропитывания, некроза стенки сосудов с ее последующим истончением. Для ГЭ характерно раннее поражение белого вещества головного мозга с признаками деструкции миелина нервных волокон, наличием мелких полостей, расширением периваскулярного пространства [10, 11].
Эти изменения развиваются перивентрикулярно вокруг передних рогов боковых желудочков, распространяясь далее по боковым отделам желудочков симметрично в обоих полушариях мозга. Диффузные изменения могут сочетаться с очаговыми изменениями в белом веществе – лакунарными инфарктами. Перивентрикулярная зона белого вещества рассматривается как зона терминального кровоснабжения, что определяет ее особую чувствительность как к повышению АД, так и к артериальной гипотонии. Часто эти изменения не формируют симптоматики, приводя к развитию ГЭ [2, 12]. Протекая длительное время бессимптомно, с редкими эпизодами церебральной симптоматики, АГ в конце концов оказывает повреждающее действие на сосудистую систему и вещество головного мозга, приводя к формированию клинической картины ГЭ. Различают следующие факторы риска ГЭ:
Присоединение атеросклеротических процессов к АГ приводит к ускоренному ухудшению мозгового кровоснабжения и прогрессированию смешанной формы ДЭ. Существенным отличием ГЭ от атеросклеротической энцефалопатии считается преимущественное массивное поражение в основном мелких ветвей сосудов головного мозга диаметром 70–500 мкм, а не крупных внечерепных и внутричерепных сосудов, приводящее к развитию инсульта. Однако клинически разделить эти состояния бывает достаточно трудно [2, 4].
Стадии и клинические синдромы гипертонической энцефалопатии
Различают 3 стадии ГЭ [13]:
При 1-й стадии ГЭ отмечаются легкие когнитивные расстройства:
Вышеизложенное подчеркивает значимость раннего выявления ГЭ не только неврологами, но и кардиологами и терапевтами. Для оценки когнитивных нарушений рекомендуется проводить нейропсихологическое тестирование, позволяющее выявить и оценить когнитивные расстройства. Рекомендуется использовать тест «Краткая шкала оценки психического статуса» (Mini-Mental Status Examination, MMSE, M.F. Folstein и соавт., 1975) или тест «Мини-ког» (Mini-Cog) [12], представляющий собой комбинацию теста на запоминание трех слов и рисования часов. Данная шкала удобна для скрининга когнитивных нарушений, так как не занимает много времени и в то же время достаточно чувствительна. Однако шкала пригодна для диагностики умеренно выраженных когнитивных нарушений. С учетом выявленных факторов риска и неврологических изменений у больных с АГ необходимо определять специфические подходы к лечению таких больных. Основные принципы лечения ГЭ:
АГ является основным фактором риска развития когнитивных расстройств и деменции. Для профилактики и лечения этих осложнений необходимо снижать АД (особенно систолическое) до целевых уровней < 140/90 мм рт. ст. (оптимальное АД – 130–139/80–89 мм рт. ст.). Снижение АД должно быть осторожным и адекватным. Для этого рекомендуется применение пролонгированных препаратов, которые не только контролируют АД, но и обладают органопротекторными свойствами, оказывая профилактическое и лечебное влияние на когнитивные расстройства и деменцию.
Крупномасштабные контролируемые международные исследования (MOSES (Mortality and Morbidity after Stroke – Eprosartan vs Nitrendipine in Secondary Prevention – Смертность и осложнения после инсульта – сравнение эпросартана и нитрендипина для вторичной профилактики), ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial – Англо-Скандинавское исследование кардиальных исходов), PROGRESS (Perindopril Protection Against Recurrent Stroke Study – Исследование периндоприла для профилактики повторного инсульта), LIFE (Losartan Intervention For Endpoint reduction in hypertension – Назначение лозартана для уменьшения риска неблагоприятных исходов при артериальной гипертонии) и др.) доказали, что гипотензивная терапия бета-адреноблокаторами (БАБ), тиазидными диуретиками или их комбинацией, ингибиторами ангиотензинпревращающего фермента (иАПФ), антагонистами кальция 2–3-го поколения и антагонистами рецепторов ангиотензина II (АРА) снижает риск инсульта в среднем на 40%. Результаты исследований свидетельствуют о важности самого факта снижения АД у больных АГ для профилактики инсультов и развития когнитивных нарушений [4, 14–16].
- Неконтролируемая АГ.
- Гипертонические кризы (нарушение гематоэнцефалического барьера).
- Высокая вариабельность АД.
- Высокая ночная АГ.
- Избыточное снижение АД, особенно в ночное время (включая ятрогенное).
- Высокое пульсовое АД.
Присоединение атеросклеротических процессов к АГ приводит к ускоренному ухудшению мозгового кровоснабжения и прогрессированию смешанной формы ДЭ. Существенным отличием ГЭ от атеросклеротической энцефалопатии считается преимущественное массивное поражение в основном мелких ветвей сосудов головного мозга диаметром 70–500 мкм, а не крупных внечерепных и внутричерепных сосудов, приводящее к развитию инсульта. Однако клинически разделить эти состояния бывает достаточно трудно [2, 4].
Стадии и клинические синдромы гипертонической энцефалопатии
Различают 3 стадии ГЭ [13]:
- 1-я стадия – в клинике доминируют субъективные нарушения: слабость, утомляемость, эмоциональная лабильность, нарушение сна, снижение памяти, внимания, появление головных болей; отчетливых неврологических синдромов нет. Возможны анизорефлексия, дискоординация, симптомы орального автоматизма. Нарушение праксиса, гнозиса можно выявить при проведении специальных тестов;
- 2-я стадия – характеризуется усугублением жалоб; неврологическая симптоматика представлена в виде следующих синдромов: вестибулярного, цефалгического, пирамидного, дискоординаторного, амиостатического, атактического, дисмнестического. При этом обычно доминирует один из перечисленных неврологических синдромов. Отмечается снижение социальной и профессиональной адаптации;
- 3-я стадия – нарастание неврологической симптоматики; сочетание различных синдромов; появление псевдобульбарного синдрома; синдромы пароксизмальных нарушений (дроп-атаки, синкопальные состояния, эпилептиформные джексоновские припадки); выраженные когнитивные нарушения. Утрата работоспособности, нарушение социальной и бытовой адаптации.
При 1-й стадии ГЭ отмечаются легкие когнитивные расстройства:
- нарушение концентрации внимания;
- трудности сосредоточения и переключения с одной деятельности на другую;
- незначительное снижение оперативной памяти.
- происходит дальнейшее усугубление когнитивных расстройств;
- снижается мыслительная продукция;
- ухудшается память;
- отмечается вязкость мышления;
- сужается круг интересов.
- формирование грубых когнитивных нарушений;
- снижение критики;
- изменение личности;
- немотивированные поступки, неадекватные реакции и изменения психики, вплоть до социальной дезадаптации и деменции;
- деменция.
Вышеизложенное подчеркивает значимость раннего выявления ГЭ не только неврологами, но и кардиологами и терапевтами. Для оценки когнитивных нарушений рекомендуется проводить нейропсихологическое тестирование, позволяющее выявить и оценить когнитивные расстройства. Рекомендуется использовать тест «Краткая шкала оценки психического статуса» (Mini-Mental Status Examination, MMSE, M.F. Folstein и соавт., 1975) или тест «Мини-ког» (Mini-Cog) [12], представляющий собой комбинацию теста на запоминание трех слов и рисования часов. Данная шкала удобна для скрининга когнитивных нарушений, так как не занимает много времени и в то же время достаточно чувствительна. Однако шкала пригодна для диагностики умеренно выраженных когнитивных нарушений. С учетом выявленных факторов риска и неврологических изменений у больных с АГ необходимо определять специфические подходы к лечению таких больных. Основные принципы лечения ГЭ:
- Коррекция сосудистых факторов риска с нормализацией АГ.
- Восстановление мозгового кровотока.
- Улучшение церебрального метаболизма.
АГ является основным фактором риска развития когнитивных расстройств и деменции. Для профилактики и лечения этих осложнений необходимо снижать АД (особенно систолическое) до целевых уровней < 140/90 мм рт. ст. (оптимальное АД – 130–139/80–89 мм рт. ст.). Снижение АД должно быть осторожным и адекватным. Для этого рекомендуется применение пролонгированных препаратов, которые не только контролируют АД, но и обладают органопротекторными свойствами, оказывая профилактическое и лечебное влияние на когнитивные расстройства и деменцию.
Крупномасштабные контролируемые международные исследования (MOSES (Mortality and Morbidity after Stroke – Eprosartan vs Nitrendipine in Secondary Prevention – Смертность и осложнения после инсульта – сравнение эпросартана и нитрендипина для вторичной профилактики), ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial – Англо-Скандинавское исследование кардиальных исходов), PROGRESS (Perindopril Protection Against Recurrent Stroke Study – Исследование периндоприла для профилактики повторного инсульта), LIFE (Losartan Intervention For Endpoint reduction in hypertension – Назначение лозартана для уменьшения риска неблагоприятных исходов при артериальной гипертонии) и др.) доказали, что гипотензивная терапия бета-адреноблокаторами (БАБ), тиазидными диуретиками или их комбинацией, ингибиторами ангиотензинпревращающего фермента (иАПФ), антагонистами кальция 2–3-го поколения и антагонистами рецепторов ангиотензина II (АРА) снижает риск инсульта в среднем на 40%. Результаты исследований свидетельствуют о важности самого факта снижения АД у больных АГ для профилактики инсультов и развития когнитивных нарушений [4, 14–16].
Длительная гипотензивная терапия способна восстановить нарушенную ауторегуляцию мозговых сосудов на ранних стадиях, в то время как на более поздних стадиях АГ и ГЭ возможности лечения резко снижены. У больных с ГЭ 2–3-й стадии, особенно пожилого возраста, рекомендуется достигать умеренного, но стабильного снижения АД на 15–20% от исходного уровня. По мере адаптации больного к достигаемому уровню АД возможно дальнейшее постепенное снижение давления, которое должно стремиться к целевому уровню. Первый период постепенного снижения АД у отдельных больных может достигать 6 месяцев. Лечение этих больных целесообразно проводить совместно с неврологом [4]. В лечении больных с ГЭ уже начиная с 1-й стадии необходимо добавлять препараты, улучшающие мозговой кровоток и метаболизм нервной ткани, действующие на внутренние факторы и способные улучшить прогноз [9, 10, 17].
При хорошем контроле АД возможно назначение антиагрегантов с целью улучшения реологических свойств крови (ацетилсалициловая кислота – Кардиомагнил, клопидогрел, дипиридамол). Исследования CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events – Сравнение клопидогрела и аспирина у пациентов с риском ишемических осложнений) и ESРS-2 (European Stroke Prevention Study 2 – Европейское исследование профилактики инсульта 2) показали, что применение указанных препаратов уменьшает риск развития мозговой ишемии. Если у больных с ГЭ имеется мерцательная аритмия (постоянная или пароксизмальная форма), рекомендуется назначение пероральных антикоагулянтов: варфарина под контролем международного нормализованного отношения (МНО) или дабигатрана. С целью предупреждения прогрессирования атеросклеротических процессов необходимо назначение статинов (симвастатин, аторвастатин, розувастатин).
При хорошем контроле АД возможно назначение антиагрегантов с целью улучшения реологических свойств крови (ацетилсалициловая кислота – Кардиомагнил, клопидогрел, дипиридамол). Исследования CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events – Сравнение клопидогрела и аспирина у пациентов с риском ишемических осложнений) и ESРS-2 (European Stroke Prevention Study 2 – Европейское исследование профилактики инсульта 2) показали, что применение указанных препаратов уменьшает риск развития мозговой ишемии. Если у больных с ГЭ имеется мерцательная аритмия (постоянная или пароксизмальная форма), рекомендуется назначение пероральных антикоагулянтов: варфарина под контролем международного нормализованного отношения (МНО) или дабигатрана. С целью предупреждения прогрессирования атеросклеротических процессов необходимо назначение статинов (симвастатин, аторвастатин, розувастатин).
При лечении основных симптомов при ГЭ (ДЭ) особое внимание должно уделяться назначению препаратов, которые улучшают метаболические процессы в ткани головного мозга; к числу таких средств относится Актовегин [15, 16, 17, 18]. Актовегин – это депротеинизированный гемодериват, получаемый методами ультрафильтрации и диализа из крови телят. В его состав входят органические низкомолекулярные соединения, что исключает развитие прионных болезней (например болезни Крейтцфельдта – Якоба). Актовегин представляет собой депротеинезированный дериват с молекулярной массой менее 5000 дальтон. Препарат содержит исключительно физиологические компоненты – аминокислоты, олигопептиды, нуклеотиды, промежуточные продукты метаболизма жирных кислот и углеводов и низкомолекулярные фрагменты клеточных мембран, а также неорганические электролиты и микроэлементы. Препарат обладает инсулиноподобным антигипоксическим, антиоксидантным, анаболическим, энергетическим действиями. Актовегин активирует пируватдегидрогеназу, которая участвует в каскаде окисления глюкозы, увеличивает утилизацию глюкозы клетками, аэробное (наиболее энергетически выгодное) окисление глюкозы, активирует ферменты окислительного фосфорилирования (сукцинатдегидрогеназа, цитохром-С-оксидаза), ускоряет процесс распада продуктов анаэробного гликолиза (лактата, гидроксибутирата).
Актовегин способствует повышению устойчивости тканей к гипоксии, обеспечивает более эффективное потребление глюкозы и кислорода клетками мозга, повышает их энергетический статус, утилизирует кислые продукты обмена, что приводит к благоприятным нейрофизиологическим эффектам. Особенно важно отметить, что применение Актовегина при ГЭ является патогенетически обоснованным, так как препарат стимулирует транспорт глюкозы с помощью ее транспортеров (Glut). Актовегин активирует Glut 1 и Glut 3. Glut 1 находится во многих тканях, в том числе в эндотелиальных клетках, в церебральных микрососудах, глиальных клетках, нейронах, гематоэнцефалическом барьере (ГЭБ), что особенно важно при ГЭ, при которой наблюдается увеличение проницаемости ГЭБ. Стимулируя Glut 1 и Glut 3, Актовегин повышает приток глюкозы в мозг, доставку глюкозы к нейронам, оптимизирует энергетический баланс нервных клеток. Кроме того, препарат активирует фосфодиэстеразу, способствует синтезу важного нейротрансмиттера – ацетилхолина; активирует ключевой фермент эндогенной антиоксидантной системы – супероксиддисмутазу.
В отечественной литературе достаточно подробно описаны биохимические механизмы положительных эффектов Актовегина [2, 5, 10, 15, 19], лежащие в основе его органопротекторного воздействия на головной мозг. Эффективность и безопасность Актовегина подтверждены результатами многочисленных клинических исследований и длительной практикой его применения [7, 20, 21, 22]. В настоящее время Актовегин широко используется для лечения сосудистых заболеваний головного мозга и когнитивных нарушений различной степени выраженности [5, 17]. Его применение приводит к заметному улучшению психопатологических, психометрических и поведенческих характеристик. Очень важно отметить эффективность препарата при многих сопутствующих заболеваниях, особенно при диабетической полинейропатии. Актовегин назначают в зависимости от клинической ситуации парентерально от 5–10 мл внутривенно болюсно (в случае 1–2-й стадии ГЭ) до 250–500 мл 10–20%-ного раствора внутривенно капельно (при 2–3-й стадии ГЭ) в течение 10–14 дней, затем переходят на прием 6–9 таблеток в сутки в течение 1–2 месяцев. Курсы лечения проводят 2 раза в год.
Таким образом, АГ является важнейшим фактором риска ГЭ, первичного и повторного инсультов, развития нарушений когнитивной функции. Оптимизация профилактики и лечения ГЭ заключается в адекватном комплексном лечении АГ, нарушений липидного обмена, улучшении коагулологических и реологических свойств крови, а также в обязательном включении нейропротекторной терапии (Актовегина), что позволяет не только уменьшить неврологическую симптоматику, но и улучшить прогноз заболевания и качество жизни больных.
Клинический пример
Рассмотрим опыт клинического применения Актовегина у больного с ГЭ. Больной С., 56 лет, профессиональный водитель, обратился с жалобами на головную боль в затылочной области, головокружение, шум в голове, слабость, сердцебиение, ухудшение памяти, повышенную раздражительность, плохой сон с частыми пробуждениями, быструю утомляемость, особенно к концу рабочего дня, на то, что он допускает частые ошибки, так как ему трудно сосредоточиться, и все это мешает профессиональной деятельности.
Из анамнеза: в течение последних 5 лет отмечает периодическое повышение АД до 170/100 мм рт. ст., которое связывает с переутомлением и стрессами на работе. По совету участкового врача периодически принимал атенолол 50 мг в сутки, Эднит 10 мг в сутки. Два года назад перенес транзиторную ишемическую атаку (ТИА) на фоне гипертонического криза. У матери пациента в анамнезе гипертоническая болезнь, умерла от инсульта в возрасте 61 года. Из вредных привычек отмечает курение в течение 20 лет. Индекс пачко-лет составляет 16,7.
Объективно: состояние удовлетворительное, телосложение правильное, гиперстеничен, вес 88 кг, рост 173 см, индекс массы тела (ИМТ) 29,0 кг/м2, окружность талии 104 см. Перкуторно над всей поверхностью легких звук легочный, при аускультации дыхание везикулярное с жестким оттенком, хрипы не выслушиваются. Частота дыхания (ЧД) – 18 в мин. Область сердца не изменена. Границы сердца расширены влево на 1 см. Тоны сердца приглушены, акцент 2 тона над аортой, шумы отсутствуют. АД – 165/95 мм рт. ст. (Д = S), частота сердечных сокращений (ЧСС) – 84 в мин.
Живот мягкий, безболезненный. Периферических отеков нет. Пульсация на аа.dorsalis pedis сохранена. Очаговой симптоматики со стороны ЦНС нет. При исследовании когнитивных функций с помощью опросника ММSE результат составил 24 балла, что соответствует легким преддементным когнитивным нарушениям. При исследовании когнитивных функций по методике «Мини-ког» пациент не смог вспомнить одно слово из трех. Лабораторные исследования: клинические анализы крови и мочи, биохимические анализы крови в норме. Липидный спектр изменен (соответствует ДЛП IIа типа), агрегация тромбоцитов и индекс агрегации эритроцитов (ИАЭ) повышены, а индекс деформируемости эритроцитов (ИДЭ) снижен (табл. 1).
Инструментальные методы исследования
Электрокардиограмма (ЭКГ): ритм синусовый, горизонтальное положение электрической оси сердца (ЭОС), признаки ГЛЖ. Индекс Соколова – Лайона (сумма амплитуды SVI + RV5 = 40 мм (N < 38 мм), амплитуда RV5 > RV4. Эхокардиография: аорта уплотнена, правые отделы сердца в норме, признаки ГЛЖ. Результаты исследования представлены в таблице 1. Суточное мониторирование АД (СМАД) – заключение: у больного стойкая систоло-диастолическая АГ с недостаточным снижением АД и повышенной вариабельностью АД в ночное время. Магнитно-резонансная томография (МРТ) головного мозга: умеренный лейкоареоз в области задних рогов боковых желудочков.
Ультразвуковая допплерография (УЗДГ) магистральных артерий головы (МАГ): выявлено уплощение комплекса интима-медиа с двух сторон, стеноз до 25% в левой внутренней сонной артерии в области ее бифуркации за счет атеросклеротической бляшки с неровными контурами. Нарушение функции внешнего дыхания (ФВД) по обструктивному и рестриктивному типу (смешанный вариант) легкой степени тяжести: объем форсированного выдоха за первую секунду маневра форсированного выдоха (ОФВ1) – 79%, индекс Генслера – 71%. Проба с сальбутамолом отрицательная. Консультация невролога: гипертоническая энцефалопатия 2-й степени на фоне атеросклероза. Умеренные когнитивные нарушения. Цефалгический и вестибулярный синдромы.
Диагноз: гипертоническая болезнь 3-й стадии, АГ 2-й степени, риск очень высокий (4), с преимущественным поражением головного мозга и сердца. Гипертоническая энцефалопатия 2-й степени с цефалгическим и вестибулярным синдромами (ТИА в анамнезе). Умеренные когнитивные нарушения. ГЛЖ. ДЛП IIа типа. Атеросклеротический стеноз внутренней сонной артерии 1-й степени. Хроническая обструктивная болезнь легких (ХОБЛ): смешанный тип, легкой степени тяжести вне обострения. Хронический обструктивный бронхит, 1-я стадия ДН 0.
Цель лечения данного больного заключается в профилактике развития мозгового инсульта и нормализации когнитивных функций. Больной нуждается в терапии, которая позволит контролировать АД и будет обладать органопротекторным действием, а именно: улучшать мозговой кровоток, обеспечивать вазопротекторный эффект, замедление процессов ремоделирования сердца. Выбор терапии обосновывают:
С учетом выявленных изменений (неконтролируемая АГ, ДЛП, нарушение клеточного звена гемостаза, наличие умеренных когнитивных нарушений) больному были даны рекомендации по здоровому образу жизни: не курить, ограничить потребление соли до 5 г в сутки, гипохолестериновая диета, активная физическая нагрузка (ходьба по 40 минут 4 раза в неделю). Назначена терапия: Лодоз (бисопролол 5 мг/гидрохлоротиазид 6,25 мг), Кардиомагнил 75 мг в сутки, симвастатин 10 мг в сутки, Актовегин внутрь – 400 мг 3 раза в сутки в течение 2 недель, затем 200 мг 3 раза в сутки в течение 3,5 месяцев.
Результат: через 4 месяца наблюдения на фоне проводимой терапии больной отметил значительное улучшение самочувствия и состояния: исчезли головные боли, головокружение, сердцебиение и слабость. Значительно улучшились память, работоспособность, нормализовался сон.
Нормализовался профиль и достигнуты целевые значения АД – 135/80 мм рт. ст., ЧСС – 64 в мин. Нормализовались показатели липидного обмена, агрегация тромбоцитов, индекс агрегации эритроцитов и их деформируемость, что способствует уменьшению микроциркуляторных нарушений. Отмечена положительная динамика эхокардиографических показателей. Динамика показателей на фоне проводимой терапии представлена в таблицах 1, 2, 3. Больному рекомендовано продолжить терапию с повторными курсами приема Актовегина в течение 1–2 месяцев 2 раза в год и с последующим контролем изученных параметров через год.
Комментарии: представлен пациент среднего возраста (по критериям Всемирной организации здравоохранения (ВОЗ), средний возраст – до 65 лет), с ведущими жалобами на головные боли, головокружение, слабость, ощущение сердцебиения, которые пациент связывает с повышением АД; указанные симптомы затрудняют профессиональную деятельность, также страдает память. Основными факторами риска ГЭ, непосредственно связанными с тяжестью и течением АГ, являются плохо контролируемая АГ, гипертонические кризы, высокая вариабельность АД, нарушенный суточный ритм АД с высоким АД по ночам и в ранние утренние часы. Указанные изменения имеются у больного. Выбор гипотензивной терапии у конкретного больного зависит не только от тяжести течения АГ, но и от возраста, признаков поражения органов-мишеней, наличия симпатикотонии, которую лучше всего контролировать с помощью БАБ.
В отечественной литературе достаточно подробно описаны биохимические механизмы положительных эффектов Актовегина [2, 5, 10, 15, 19], лежащие в основе его органопротекторного воздействия на головной мозг. Эффективность и безопасность Актовегина подтверждены результатами многочисленных клинических исследований и длительной практикой его применения [7, 20, 21, 22]. В настоящее время Актовегин широко используется для лечения сосудистых заболеваний головного мозга и когнитивных нарушений различной степени выраженности [5, 17]. Его применение приводит к заметному улучшению психопатологических, психометрических и поведенческих характеристик. Очень важно отметить эффективность препарата при многих сопутствующих заболеваниях, особенно при диабетической полинейропатии. Актовегин назначают в зависимости от клинической ситуации парентерально от 5–10 мл внутривенно болюсно (в случае 1–2-й стадии ГЭ) до 250–500 мл 10–20%-ного раствора внутривенно капельно (при 2–3-й стадии ГЭ) в течение 10–14 дней, затем переходят на прием 6–9 таблеток в сутки в течение 1–2 месяцев. Курсы лечения проводят 2 раза в год.
Таким образом, АГ является важнейшим фактором риска ГЭ, первичного и повторного инсультов, развития нарушений когнитивной функции. Оптимизация профилактики и лечения ГЭ заключается в адекватном комплексном лечении АГ, нарушений липидного обмена, улучшении коагулологических и реологических свойств крови, а также в обязательном включении нейропротекторной терапии (Актовегина), что позволяет не только уменьшить неврологическую симптоматику, но и улучшить прогноз заболевания и качество жизни больных.
Клинический пример
Рассмотрим опыт клинического применения Актовегина у больного с ГЭ. Больной С., 56 лет, профессиональный водитель, обратился с жалобами на головную боль в затылочной области, головокружение, шум в голове, слабость, сердцебиение, ухудшение памяти, повышенную раздражительность, плохой сон с частыми пробуждениями, быструю утомляемость, особенно к концу рабочего дня, на то, что он допускает частые ошибки, так как ему трудно сосредоточиться, и все это мешает профессиональной деятельности.
Из анамнеза: в течение последних 5 лет отмечает периодическое повышение АД до 170/100 мм рт. ст., которое связывает с переутомлением и стрессами на работе. По совету участкового врача периодически принимал атенолол 50 мг в сутки, Эднит 10 мг в сутки. Два года назад перенес транзиторную ишемическую атаку (ТИА) на фоне гипертонического криза. У матери пациента в анамнезе гипертоническая болезнь, умерла от инсульта в возрасте 61 года. Из вредных привычек отмечает курение в течение 20 лет. Индекс пачко-лет составляет 16,7.
Объективно: состояние удовлетворительное, телосложение правильное, гиперстеничен, вес 88 кг, рост 173 см, индекс массы тела (ИМТ) 29,0 кг/м2, окружность талии 104 см. Перкуторно над всей поверхностью легких звук легочный, при аускультации дыхание везикулярное с жестким оттенком, хрипы не выслушиваются. Частота дыхания (ЧД) – 18 в мин. Область сердца не изменена. Границы сердца расширены влево на 1 см. Тоны сердца приглушены, акцент 2 тона над аортой, шумы отсутствуют. АД – 165/95 мм рт. ст. (Д = S), частота сердечных сокращений (ЧСС) – 84 в мин.
Живот мягкий, безболезненный. Периферических отеков нет. Пульсация на аа.dorsalis pedis сохранена. Очаговой симптоматики со стороны ЦНС нет. При исследовании когнитивных функций с помощью опросника ММSE результат составил 24 балла, что соответствует легким преддементным когнитивным нарушениям. При исследовании когнитивных функций по методике «Мини-ког» пациент не смог вспомнить одно слово из трех. Лабораторные исследования: клинические анализы крови и мочи, биохимические анализы крови в норме. Липидный спектр изменен (соответствует ДЛП IIа типа), агрегация тромбоцитов и индекс агрегации эритроцитов (ИАЭ) повышены, а индекс деформируемости эритроцитов (ИДЭ) снижен (табл. 1).
Инструментальные методы исследования
Электрокардиограмма (ЭКГ): ритм синусовый, горизонтальное положение электрической оси сердца (ЭОС), признаки ГЛЖ. Индекс Соколова – Лайона (сумма амплитуды SVI + RV5 = 40 мм (N < 38 мм), амплитуда RV5 > RV4. Эхокардиография: аорта уплотнена, правые отделы сердца в норме, признаки ГЛЖ. Результаты исследования представлены в таблице 1. Суточное мониторирование АД (СМАД) – заключение: у больного стойкая систоло-диастолическая АГ с недостаточным снижением АД и повышенной вариабельностью АД в ночное время. Магнитно-резонансная томография (МРТ) головного мозга: умеренный лейкоареоз в области задних рогов боковых желудочков.
Ультразвуковая допплерография (УЗДГ) магистральных артерий головы (МАГ): выявлено уплощение комплекса интима-медиа с двух сторон, стеноз до 25% в левой внутренней сонной артерии в области ее бифуркации за счет атеросклеротической бляшки с неровными контурами. Нарушение функции внешнего дыхания (ФВД) по обструктивному и рестриктивному типу (смешанный вариант) легкой степени тяжести: объем форсированного выдоха за первую секунду маневра форсированного выдоха (ОФВ1) – 79%, индекс Генслера – 71%. Проба с сальбутамолом отрицательная. Консультация невролога: гипертоническая энцефалопатия 2-й степени на фоне атеросклероза. Умеренные когнитивные нарушения. Цефалгический и вестибулярный синдромы.
Диагноз: гипертоническая болезнь 3-й стадии, АГ 2-й степени, риск очень высокий (4), с преимущественным поражением головного мозга и сердца. Гипертоническая энцефалопатия 2-й степени с цефалгическим и вестибулярным синдромами (ТИА в анамнезе). Умеренные когнитивные нарушения. ГЛЖ. ДЛП IIа типа. Атеросклеротический стеноз внутренней сонной артерии 1-й степени. Хроническая обструктивная болезнь легких (ХОБЛ): смешанный тип, легкой степени тяжести вне обострения. Хронический обструктивный бронхит, 1-я стадия ДН 0.
Цель лечения данного больного заключается в профилактике развития мозгового инсульта и нормализации когнитивных функций. Больной нуждается в терапии, которая позволит контролировать АД и будет обладать органопротекторным действием, а именно: улучшать мозговой кровоток, обеспечивать вазопротекторный эффект, замедление процессов ремоделирования сердца. Выбор терапии обосновывают:
- факторы риска (ДЛП, курение);
- поражение органов-мишеней: ГЛЖ, признаки атеросклероза МАГ;
- наличие ассоциированного заболевания: ГЭ 2-й стадии с когнитивными нарушениями.
С учетом выявленных изменений (неконтролируемая АГ, ДЛП, нарушение клеточного звена гемостаза, наличие умеренных когнитивных нарушений) больному были даны рекомендации по здоровому образу жизни: не курить, ограничить потребление соли до 5 г в сутки, гипохолестериновая диета, активная физическая нагрузка (ходьба по 40 минут 4 раза в неделю). Назначена терапия: Лодоз (бисопролол 5 мг/гидрохлоротиазид 6,25 мг), Кардиомагнил 75 мг в сутки, симвастатин 10 мг в сутки, Актовегин внутрь – 400 мг 3 раза в сутки в течение 2 недель, затем 200 мг 3 раза в сутки в течение 3,5 месяцев.
Результат: через 4 месяца наблюдения на фоне проводимой терапии больной отметил значительное улучшение самочувствия и состояния: исчезли головные боли, головокружение, сердцебиение и слабость. Значительно улучшились память, работоспособность, нормализовался сон.
Нормализовался профиль и достигнуты целевые значения АД – 135/80 мм рт. ст., ЧСС – 64 в мин. Нормализовались показатели липидного обмена, агрегация тромбоцитов, индекс агрегации эритроцитов и их деформируемость, что способствует уменьшению микроциркуляторных нарушений. Отмечена положительная динамика эхокардиографических показателей. Динамика показателей на фоне проводимой терапии представлена в таблицах 1, 2, 3. Больному рекомендовано продолжить терапию с повторными курсами приема Актовегина в течение 1–2 месяцев 2 раза в год и с последующим контролем изученных параметров через год.
Комментарии: представлен пациент среднего возраста (по критериям Всемирной организации здравоохранения (ВОЗ), средний возраст – до 65 лет), с ведущими жалобами на головные боли, головокружение, слабость, ощущение сердцебиения, которые пациент связывает с повышением АД; указанные симптомы затрудняют профессиональную деятельность, также страдает память. Основными факторами риска ГЭ, непосредственно связанными с тяжестью и течением АГ, являются плохо контролируемая АГ, гипертонические кризы, высокая вариабельность АД, нарушенный суточный ритм АД с высоким АД по ночам и в ранние утренние часы. Указанные изменения имеются у больного. Выбор гипотензивной терапии у конкретного больного зависит не только от тяжести течения АГ, но и от возраста, признаков поражения органов-мишеней, наличия симпатикотонии, которую лучше всего контролировать с помощью БАБ.
Несмотря на наличие такого сопутствующего заболевания, как ХОБЛ, возможно использование селективного БАБ бисопролола без риска ухудшения бронхиальной проходимости. В случае когда у больного имеется ГЭ, к лечению необходимо добавлять препараты, улучшающие мозговой кровоток и метаболизм нервной ткани и способные замедлить прогрессирование энцефалопатии. Современный подход к гипотензивной терапии подразумевает использование комбинированной терапии несколькими препаратами в низких дозах. Метаанализ 17 рандомизированных плацебоконтролируемых исследований (47 653 больных) показал, что длительный прием гипотензивных препаратов, в том числе БАБ и диуретиков, достоверно снижал риск развития инсульта на 35–40% [23].
В более поздней работе (2006) канадские исследователи N. Khan и F. McAlister опубликовали результаты метаанализа эффективности БАБ в зависимости от возраста. В метаанализ были включены 32 рандомизованных контролируемых исследования за 1984–2004 гг., в которых участвовали 145 811 пациентов с АГ. Было показано, что БАБ не уступают другим классам гипотензивных препаратов в отношении снижения риска сердечно-сосудистой смерти, инфаркта миокарда и инсульта [14]. В новых рекомендациях ВНОК по профилактике сердечно-сосудистых заболеваний повышение ЧСС указывается в числе факторов риска сердечно-сосудистых осложнений, а в рекомендациях по лечению АГ говорится о необходимости контроля этого показателя. Таким образом, назначение Лодоза соответствует современным стандартам ведения больных с АГ и позволяет не только снизить АД, улучшить профиль АД, но и уменьшить ЧСС. Положительную роль сыграло назначение симвастатина 10 мг и кардиомагнила 75 мг, обеспечившее улучшение липидного обмена и тромбоцитарного звена гемостаза, а также уменьшение агрегации и повышение деформируемости эритроцитов.
Когнитивные нарушения могут отмечаться даже при нетяжелом поражении головного мозга. Причиной ТИА у пациента, вероятнее всего, была неконтролируемая АГ, а выявленные изменения на МРТ (лейкоареоз) указывают на хроническую ГЭ. Степень когнитивных нарушений можно рассматривать как умеренную, так как сформировался клинически очерченный синдром, который ухудшает качество жизни, мешает выполнению профессиональных обязанностей. Когнитивные нарушения сочетаются с элементами эмоциональной лабильности, раздражительностью, что характерно для сосудистых поражений головного мозга. В то же время больной критичен к себе, сохраняет независимость и самостоятельность. Назначение Актовегина, оказывающего комбинированное воздействие на состояние эндотелия и стенки сосудов головного мозга, мозговой кровоток и метаболизм нервной ткани, способствует замедлению патологических изменений сосудов и вещества головного мозга, особенно на фоне адекватной гипотензивной терапии Лодозом. Описанный клинический случай показывает, что своевременно назначенная адекватная терапия для контроля АД и коррекции факторов риска, с включением нейрометаболической терапии, может оказать положительное воздействие на течение ГЭ и улучшить качество жизни.
В более поздней работе (2006) канадские исследователи N. Khan и F. McAlister опубликовали результаты метаанализа эффективности БАБ в зависимости от возраста. В метаанализ были включены 32 рандомизованных контролируемых исследования за 1984–2004 гг., в которых участвовали 145 811 пациентов с АГ. Было показано, что БАБ не уступают другим классам гипотензивных препаратов в отношении снижения риска сердечно-сосудистой смерти, инфаркта миокарда и инсульта [14]. В новых рекомендациях ВНОК по профилактике сердечно-сосудистых заболеваний повышение ЧСС указывается в числе факторов риска сердечно-сосудистых осложнений, а в рекомендациях по лечению АГ говорится о необходимости контроля этого показателя. Таким образом, назначение Лодоза соответствует современным стандартам ведения больных с АГ и позволяет не только снизить АД, улучшить профиль АД, но и уменьшить ЧСС. Положительную роль сыграло назначение симвастатина 10 мг и кардиомагнила 75 мг, обеспечившее улучшение липидного обмена и тромбоцитарного звена гемостаза, а также уменьшение агрегации и повышение деформируемости эритроцитов.
Когнитивные нарушения могут отмечаться даже при нетяжелом поражении головного мозга. Причиной ТИА у пациента, вероятнее всего, была неконтролируемая АГ, а выявленные изменения на МРТ (лейкоареоз) указывают на хроническую ГЭ. Степень когнитивных нарушений можно рассматривать как умеренную, так как сформировался клинически очерченный синдром, который ухудшает качество жизни, мешает выполнению профессиональных обязанностей. Когнитивные нарушения сочетаются с элементами эмоциональной лабильности, раздражительностью, что характерно для сосудистых поражений головного мозга. В то же время больной критичен к себе, сохраняет независимость и самостоятельность. Назначение Актовегина, оказывающего комбинированное воздействие на состояние эндотелия и стенки сосудов головного мозга, мозговой кровоток и метаболизм нервной ткани, способствует замедлению патологических изменений сосудов и вещества головного мозга, особенно на фоне адекватной гипотензивной терапии Лодозом. Описанный клинический случай показывает, что своевременно назначенная адекватная терапия для контроля АД и коррекции факторов риска, с включением нейрометаболической терапии, может оказать положительное воздействие на течение ГЭ и улучшить качество жизни.
1. Скворцова В.И., Чазова И.Е., Стаховская Л.В. Вторичная профилактика инсульта. М: ПАГРИ, 2002. 118 с.
2. Карпов Ю.А. Церебропротекция при лечении больных с высоким риском сердечно-сосудистых осложнений // РМЖ. 2008. Т. 16. № 21. С. 1423–1428.
3. Строков И.А., Моргоева Ф.Э. Артериальная гипертония и дисциркуляторная энцефалопатия: алгоритм лечения // РМЖ. 2004. Т. 12. № 7. С. 501–505.
4. Ощепкова Е.В. Гипертоническая энцефалопатия. Справочник поликлинического врача. М.: Медиа Медика, 2004. № 3. С. 43–47.
5. Стуров Н.В., Манякин И.С., Басова Е.А. Сосудистая энцефалопатия при артериальной гипертензии как сочетание когнитивных нарушений и органического поражения головного мозга // Трудный пациент. 2011. Т. 9. № 1. С. 26–29.
6. Кобалава Ж.Д., Толкачева В.В., Котовская Ю.В. Цереброваскулярные осложнения артериальной гипертонии // Качество жизни. Медицина. 2005. № 3 (10). С. 17–21.
7. Диденко О.А. Оценка фармакодинамической эффективности комплексной терапии больных дисциркуляторной энцефалопатией на фоне артериальной гипертензии и церебрального атеросклероза схемой Актовегин – Инстенон форте // РМЖ. 2007. Т. 15. № 15. С.1172–1177.
8. Яхно Н.Н. Когнитивные расстройства в неврологической клинике // Неврологический журнал. 2006. Т. 11. № 1. С. 4–12.
9. Яхно Н.Н., Захаров В.В. Когнитивные и эмоционально-аффективные нарушения при дисциркуляторной энцефалопатии // РМЖ. 2002. Т. 10. № 12–13. С. 531–551.
10. Кисляк О.А., Болотов А.В. Возможности применения метаболической терапии при гипертонической энцефалопатии // Consilium Medicum. 2008. Т. 10. № 7. С. 39–42.
11. Coca A. Cerebral involvement in hypertensive cardiovascular disease // Eur. Heart. J. 2003. Vol. 5. P. 19–25.
12. Захаров В.В. Умеренные когнитивные расстройства. Практическое пособие для врача. М., 2010. 12 с.
13. Дадашева М.Н., Агафонов Б.В., Каравашкина Е.А. и др. Цереброваскулярные заболевания. Клиническое течение. Современные принципы комплексной терапии. Учебное пособие. М., 2011. 22 с.
14. Кобалава Ж.Д., Котовская Ю.В. Артериальная гипертония: ключи к диагностике и лечению. М., 2007. 198 с.
15. Котов С.В., Исакова Е.В., Рябцева А.А., Лобов М.А., Рудакова И.Г. Комплексная терапия хронической ишемии мозга / Под ред. В.Я. Неретина. М., 2002. 95 с.
16. Чуканова Е.И. Актовегин в лечении больных с дисциркуляторной энцефалопатией // Фарматека. 2005. № 17. С. 71–76.
17. Строков И.А., Афонина Ж.А. и др. Актовегин в лечении заболеваний нервной системы // РМЖ. 2008. Т. 16. № 12. С. 1665–1670.
18. Румянцева С.А. Комплексная терапия гипертонической и смешанной энцефалопатии // Фармакотерапия. 2010. № 1. С. 81–86.
19. Суслина З.А., Гераскина Л.А., Фонякин А.В. Артериальная гипертония, сосудистая патология мозга и антигипертензивное лечение. М., 2006. 200 с.
20. Шмырев В.И., Остроумова О.Д., Боброва Т.А. Возможности препарата Актовегин в профилактике и лечении деменции // РМЖ. 2003. Т. 11. № 4. С. 216–221.
21. Oswald W.D., Steiger W. Улучшение зависимых от возраста составляющих когнитивных процессов как показатель эффективности ноотропного препарата (двойное слепое плацебоконтролируемое исследование) // Сборник научно-практических статей «Актовегин в неврологии». М., 2002. С. 34–50.
22. Kanowski S., Kinzler E., Lehmann E., Schweizer A., Kuntz G. Confirmed clinical efficacy of actovegin in elderly patients with organic brain syndrome // Pharmacopsychiatry. 1995. Vol. 28. № 4. P. 125–133.
23. Chalmer J., McMahon S., Anderson C. et al. Clinicians manual on blood pressure and stroke prevention. Second ed. London, 2000. 129 р.
Новости на тему
05.02.2024
02.02.2024
СТАТЬИ по теме
Отправить статью по электронной почте
Ваш адрес электронной почты:
При неконтролируемой артериальной гипертонии хроническое нарушение мозгового кровообращения обусловливает развитие медленно прогрессирующего диффузного и очагового поражения вещества головного мозга – гипертонической энцефалопатии (ГЭ).
В статье рассмотрены стадии и синдромы ГЭ, ее лечение; приведено обоснование включения в схемы терапии ГЭ препаратов, улучшающих мозговой кровоток и метаболизм нервной ткани и способных замедлить прогрессирование энцефалопатии, например Актовегина. Этот содержащий исключительно физиологические компоненты препарат обладает инсулиноподобным, антигипоксическим, антиоксидантным, анаболическим, энергетическим эффектами, лежащими в основе органопротекторного воздействия Актовегина на головной мозг.
В статье рассмотрены стадии и синдромы ГЭ, ее лечение; приведено обоснование включения в схемы терапии ГЭ препаратов, улучшающих мозговой кровоток и метаболизм нервной ткани и способных замедлить прогрессирование энцефалопатии, например Актовегина. Этот содержащий исключительно физиологические компоненты препарат обладает инсулиноподобным, антигипоксическим, антиоксидантным, анаболическим, энергетическим эффектами, лежащими в основе органопротекторного воздействия Актовегина на головной мозг.
В статье рассмотрен клинический случай, демонстрирующий положительный эффект добавления нейрометаболического препарата к современной терапии, направленной на контроль артериального давления и коррекцию факторов риска.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
