количество статей
6422
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Острая сердечная недостаточность 2010: что изменилось
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" №1
- Аннотация
- Статья
- Ссылки
23 ноября 2010 года в рамках проходившей в Москве в РКНПК Росмедтехнологий III Всероссийской конференции «Неотложная кардиология–2010» состоялся научный симпозиум «Острая сердечная недостаточность 2010: что изменилось», организованный компанией «Орион Фарма».
На мероприятии с докладами выступили известные ученые, ведущие специалисты по острой и хронической сердечной недостаточности. Они поделились с собравшимися (прежде всего – практикующими врачами и студентами-медиками) своим взглядом на проблемы ведения пациентов с ОСН.
23 ноября 2010 года в рамках проходившей в Москве в РКНПК Росмедтехнологий III Всероссийской конференции «Неотложная кардиология–2010» состоялся научный симпозиум «Острая сердечная недостаточность 2010: что изменилось», организованный компанией «Орион Фарма».
На мероприятии с докладами выступили известные ученые, ведущие специалисты по острой и хронической сердечной недостаточности. Они поделились с собравшимися (прежде всего – практикующими врачами и студентами-медиками) своим взглядом на проблемы ведения пациентов с ОСН.

С.Н. Терещенко, д.м.н., профессор, руководитель отдела заболеваний сердца и сердечной недостаточности РКНПК Росмедтехнологий, Москва
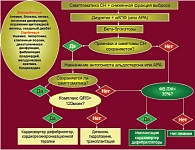
Рис. 1. Алгоритм назначения инотропных препаратов пациентам с ХСН
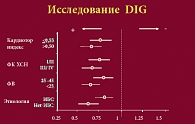
Рис. 2. Смертность от ХСН и госпитализация
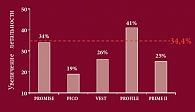
Рис. 3. Результаты многоцентровых исследований инотропных средств
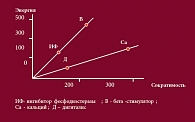
Рис. 4. Взаимосвязь между сократимостью миокарда и потребляемой энергией
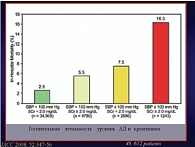
Рис. 5. Взаимосвязь между госпитальной летальностью, уровнем АД и креатинина
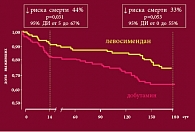
Рис. 6. Влияние левосимендана на выживаемость

Д.А. Затейщиков, д.м.н., профессор кафедры кардиологии и общей терапии ФГУ «Учебно-научный медицинский центр» УДП РФ
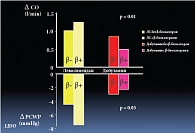
Рис. 7. Применение левосимендана у пациентов, принимающих β-блокаторы

А.А. Скворцов, д.м.н., ведущий научный сотрудник РКНПК Росмедтехнологий
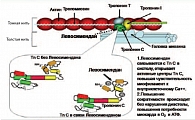
Рис. 8. Механизм действия левосимендана

Рис. 9. Смертность больных в зависимости от наличия ХСН в анамнезе
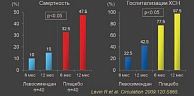
Рис. 10. Влияние повторных инфузий левосимендана на смертность и госпитализации больных тяжелой ХСН

Ю.И. Гороховатский, к.м.н., заместитель директора НМХЦ им. Н.И. Пирогова
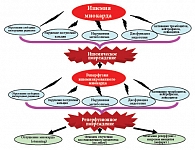
Рис. 11. Каскад реакций «ишемия-реперфузия»
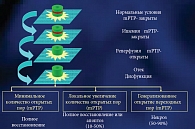
Рис. 12. Влияние ишемии-реперфузии на состояние митохондриальных переходных пор

Рис. 13. Фармакологическое прекондиционирование левосименданом
Применение инотропных средств в лечении сердечной недостаточности
Начиная свое выступление, профессор С.Н. Терещенко ознакомил присутствующих с рекомендациями Европейского кардиологического общества, касающимися лечения пациентов с ХСН, точнее, назначения таким пациентам инотропных препаратов (рис. 1).
По словам докладчика, целесообразным является назначение инотропных препаратов тем больным, которые не отреагировали на стандартную медикаментозную терапию. Кроме того, оправданным можно считать назначение сердечных гликозидов пациентам с ХСН, сопровождающейся постоянной формой мерцательной аритмии. Что же касается больных с синусовым ритмом, то, как показывают проведенные исследования, прием сердечных гликозидов улучшает качество их жизни и уменьшает количество госпитализаций.
Профессор Терещенко также отметил, что данная группа препаратов оказывает положительное влияние вне зависимости от функционального класса заболевания и причин, вызвавших сердечную недостаточность.
Больные с мерцательной аритмией составляют 31% всех пациентов, страдающих ХСН. Однако, согласно данным многоцентровых клинических исследований, сердечные гликозиды сегодня назначаются лишь 20–25% больных ХСН, хотя врачам уже ясно, что именно сердечные гликозиды являются единственными инотропными средствами, которые могут быть рекомендованы для постоянного применения. Остальные препараты с инотропным действием, например, милринон, ибопамин или веснаринон, к сожалению, не уменьшают вероятность летального исхода. Смертность больных, страдающих хронической сердечной недостаточностью, на фоне приема данных препаратов не снижается (рис. 2). Более того, длительное применение добутамина способствует увеличению летальности в данной группе пациентов.
Возникает закономерный вопрос: должны ли врачи полностью отказаться от инотропной терапии больных ХСН, особенно если учесть, что существуют данные многоцентровых исследований (рис. 3), указывающие на то, что применение инотропных средств способно увеличить летальность на 34%. Почему так происходит? Дело в том, что увеличение инотропной функции приводит к энергетическому обеднению кардиомиоцитов. То есть, увеличивая сократимость данных клеток, мы одновременно истощаем миокард (рис. 4), что, в свою очередь, приводит к ухудшению гемодинамики, возникновению ишемии, развитию нарушений ритма и увеличению риска возникновения инфаркта миокарда.
Но, подчеркнул профессор Терещенко, данная ситуация характерна только для пациентов с хронической сердечной недостаточностью, принимающих инотропные препараты в течение длительного периода.
Как же обстоят дела с больными, страдающими острой сердечной недостаточностью? Если принять во внимание различные причины возникновения данного патологического состояния, то станет очевидно, что значительный процент пациентов с ОСН составляют люди с декомпенсированной формой хронической сердечной недостаточности. Еще одной значимой причиной развития ОСН является отек легких, а вот процент случаев ОСН, вызванной кардиогенным шоком или правожелудочковой недостаточностью, сравнительно невелик.
Разработан четкий и однозначный алгоритм лечения больных острой сердечной недостаточностью, подразумевающий назначение мочегонных препаратов и периферических вазодилататоров. К сожалению, даже применение последних не всегда влияет на исход лечения – выживаемость больных с острой сердечной недостаточностью по-прежнему оставляет желать лучшего. Тем не менее, как лечить больных с повышенным артериальным давлением, врачам на сегодняшний день известно.
Куда сложнее дела обстоят с теми пациентами, у которых систолическое АД снижено. Как правильно подобрать инотропное средство для лечения таких больных? Вопрос абсолютно не праздный, особенно если вспомнить, что именно низкое артериальное давление у больных с острой сердечной недостаточностью существенно увеличивает показатели госпитальной смертности.
На прогноз заболевания у данной категории пациентов влияют следующие факторы: артериальное давление ниже 100 мм рт. ст. и повышение уровня креатинина. То есть, перед лечащим врачом возникают одновременно две проблемы. Во-первых, низкое АД, а во-вторых, развитие острого кардиоренального синдрома (рис. 5).
Что же может предложить современная медицина для лечения таких непростых пациентов? По словам профессора Терещенко, одной из наиболее эффективных терапевтических методик в данной ситуации является внутриаортальная баллонная контрпульсация. Немаловажно, что в первую очередь она показана больным ОСН с низкой фракцией выброса. К сожалению, на сегодняшний день, данный метод лечения применяется далеко не во всех кардиоцентрах, потому, что многие блоки интенсивной терапии просто не оснащены необходимым оборудованием. Нет самих контрпульсаторов, не хватает и лабораторий, под контролем которых могла бы проводиться внутриаортальная контрпульсация.
В ситуации, когда техническое оснащение российских больниц оставляет желать лучшего, специалистам очевидно, что отказаться от применения инотропных препаратов в терапии пациентов, страдающих ОСН, просто невозможно. Эти средства показаны в следующих случаях: падение сократительной функции левого желудочка, наличие артериальной гипотонии, недостаточная эффективность стандартной терапии, наличие тяжелых проявлений заболевания у больных с низким сердечным выбросом, не обусловленным гиповолемией. Кроме того, инотропные средства должны назначаться в тех ситуациях, когда больной получает внутривенные наркотические анальгетики, мочегонные препараты или периферические вазодилататоры.
Увеличение сократимости миокарда при приеме инотропных средств происходит за счет повышения уровня кальция внутри клеток, стимуляции β-адренорецепторов и аденилциклазы, а также подавления активности фосфодиэстеразы. Для лечения больных с ОСН на сегодняшний день показаны такие инотропные препараты, как добутамин, левосимендан, норадреналин и адреналин.
Переходя к освещению вопросов тактики ведения пациентов с ОСН, являющейся декомпенсацией хронической сердечной недостаточности, профессор Терещенко подчеркнул, что подход врача должен зависеть от уровня АД пациента. Если АД выше 105 мм рт. ст., должны назначаться периферические вазодилататоры и левосимендан, дозировка которого подбирается в зависимости от состояния больного. При артериальном давлении 80–100 мм рт. ст. левосимендан не применяется. Пациенты с АД менее 90 мм рт. ст. и отечным синдромом нуждаются в коррекции объема циркулирующей крови и применении инотропных препаратов, таких, как добутамин или норадреналин, причем выбирать конкретное лекарственное средство врач должен в зависимости от состояния больного.
При низких показателях артериального давления – ниже 70 мм рт. ст. следует проверить наличие гиповолемии и при необходимости ее ликвидировать. То же относится и к нарушениям ритма – их необходимо скорректировать. При лечении пациентов с ОСН и низким АД должен использоваться норадреналин в высоких дозах или, при его отсутствии, Допмин (допамин) в вазопрессорной дозировке. Когда давление начинает повышаться, можно заменить норадреналин на Допмин или уменьшить дозу последнего. Затем, при дальнейшем росте АД и после выхода пациента из шока, применяется добутамин, после чего можно добавить периферические вазодилататоры или перевести пациента на левосимендан.
По данным исследований, летальность пациентов, у которых применялся левосимендан, была практически идентична летальности больных, получавших периферические вазодилататоры. Комбинированная терапия периферическими вазодилататорами в сочетании с инотропными средствами по эффективности также аналогична лечению левосименданом. Дело в том, что по своему гемодинамическому эффекту левосимендан находится между вазодилататорами и инотропными средствами.
Левосимендан не увеличивает частоту сердечных сокращений и не приводит к изменению сердечного индекса, а эффект от однократного применения данного препарата продолжается на протяжении 14 суток.
Завершая свое выступление, профессор Терещенко еще раз коротко перечислил основные достоинства левосимендана и подчеркнул, что механизм действия данного средства на сегодняшний день полностью изучен, известны и ситуации, в которых врачи могут и должны применять именно это лекарственное средство (рис. 6).
Применение β-блокаторов в лечении ОСН
Начиная свое выступление, профессор С.Н. Терещенко ознакомил присутствующих с рекомендациями Европейского кардиологического общества, касающимися лечения пациентов с ХСН, точнее, назначения таким пациентам инотропных препаратов (рис. 1).
По словам докладчика, целесообразным является назначение инотропных препаратов тем больным, которые не отреагировали на стандартную медикаментозную терапию. Кроме того, оправданным можно считать назначение сердечных гликозидов пациентам с ХСН, сопровождающейся постоянной формой мерцательной аритмии. Что же касается больных с синусовым ритмом, то, как показывают проведенные исследования, прием сердечных гликозидов улучшает качество их жизни и уменьшает количество госпитализаций.
Профессор Терещенко также отметил, что данная группа препаратов оказывает положительное влияние вне зависимости от функционального класса заболевания и причин, вызвавших сердечную недостаточность.
Больные с мерцательной аритмией составляют 31% всех пациентов, страдающих ХСН. Однако, согласно данным многоцентровых клинических исследований, сердечные гликозиды сегодня назначаются лишь 20–25% больных ХСН, хотя врачам уже ясно, что именно сердечные гликозиды являются единственными инотропными средствами, которые могут быть рекомендованы для постоянного применения. Остальные препараты с инотропным действием, например, милринон, ибопамин или веснаринон, к сожалению, не уменьшают вероятность летального исхода. Смертность больных, страдающих хронической сердечной недостаточностью, на фоне приема данных препаратов не снижается (рис. 2). Более того, длительное применение добутамина способствует увеличению летальности в данной группе пациентов.
Возникает закономерный вопрос: должны ли врачи полностью отказаться от инотропной терапии больных ХСН, особенно если учесть, что существуют данные многоцентровых исследований (рис. 3), указывающие на то, что применение инотропных средств способно увеличить летальность на 34%. Почему так происходит? Дело в том, что увеличение инотропной функции приводит к энергетическому обеднению кардиомиоцитов. То есть, увеличивая сократимость данных клеток, мы одновременно истощаем миокард (рис. 4), что, в свою очередь, приводит к ухудшению гемодинамики, возникновению ишемии, развитию нарушений ритма и увеличению риска возникновения инфаркта миокарда.
Но, подчеркнул профессор Терещенко, данная ситуация характерна только для пациентов с хронической сердечной недостаточностью, принимающих инотропные препараты в течение длительного периода.
Как же обстоят дела с больными, страдающими острой сердечной недостаточностью? Если принять во внимание различные причины возникновения данного патологического состояния, то станет очевидно, что значительный процент пациентов с ОСН составляют люди с декомпенсированной формой хронической сердечной недостаточности. Еще одной значимой причиной развития ОСН является отек легких, а вот процент случаев ОСН, вызванной кардиогенным шоком или правожелудочковой недостаточностью, сравнительно невелик.
Разработан четкий и однозначный алгоритм лечения больных острой сердечной недостаточностью, подразумевающий назначение мочегонных препаратов и периферических вазодилататоров. К сожалению, даже применение последних не всегда влияет на исход лечения – выживаемость больных с острой сердечной недостаточностью по-прежнему оставляет желать лучшего. Тем не менее, как лечить больных с повышенным артериальным давлением, врачам на сегодняшний день известно.
Куда сложнее дела обстоят с теми пациентами, у которых систолическое АД снижено. Как правильно подобрать инотропное средство для лечения таких больных? Вопрос абсолютно не праздный, особенно если вспомнить, что именно низкое артериальное давление у больных с острой сердечной недостаточностью существенно увеличивает показатели госпитальной смертности.
На прогноз заболевания у данной категории пациентов влияют следующие факторы: артериальное давление ниже 100 мм рт. ст. и повышение уровня креатинина. То есть, перед лечащим врачом возникают одновременно две проблемы. Во-первых, низкое АД, а во-вторых, развитие острого кардиоренального синдрома (рис. 5).
Что же может предложить современная медицина для лечения таких непростых пациентов? По словам профессора Терещенко, одной из наиболее эффективных терапевтических методик в данной ситуации является внутриаортальная баллонная контрпульсация. Немаловажно, что в первую очередь она показана больным ОСН с низкой фракцией выброса. К сожалению, на сегодняшний день, данный метод лечения применяется далеко не во всех кардиоцентрах, потому, что многие блоки интенсивной терапии просто не оснащены необходимым оборудованием. Нет самих контрпульсаторов, не хватает и лабораторий, под контролем которых могла бы проводиться внутриаортальная контрпульсация.
В ситуации, когда техническое оснащение российских больниц оставляет желать лучшего, специалистам очевидно, что отказаться от применения инотропных препаратов в терапии пациентов, страдающих ОСН, просто невозможно. Эти средства показаны в следующих случаях: падение сократительной функции левого желудочка, наличие артериальной гипотонии, недостаточная эффективность стандартной терапии, наличие тяжелых проявлений заболевания у больных с низким сердечным выбросом, не обусловленным гиповолемией. Кроме того, инотропные средства должны назначаться в тех ситуациях, когда больной получает внутривенные наркотические анальгетики, мочегонные препараты или периферические вазодилататоры.
Увеличение сократимости миокарда при приеме инотропных средств происходит за счет повышения уровня кальция внутри клеток, стимуляции β-адренорецепторов и аденилциклазы, а также подавления активности фосфодиэстеразы. Для лечения больных с ОСН на сегодняшний день показаны такие инотропные препараты, как добутамин, левосимендан, норадреналин и адреналин.
Переходя к освещению вопросов тактики ведения пациентов с ОСН, являющейся декомпенсацией хронической сердечной недостаточности, профессор Терещенко подчеркнул, что подход врача должен зависеть от уровня АД пациента. Если АД выше 105 мм рт. ст., должны назначаться периферические вазодилататоры и левосимендан, дозировка которого подбирается в зависимости от состояния больного. При артериальном давлении 80–100 мм рт. ст. левосимендан не применяется. Пациенты с АД менее 90 мм рт. ст. и отечным синдромом нуждаются в коррекции объема циркулирующей крови и применении инотропных препаратов, таких, как добутамин или норадреналин, причем выбирать конкретное лекарственное средство врач должен в зависимости от состояния больного.
При низких показателях артериального давления – ниже 70 мм рт. ст. следует проверить наличие гиповолемии и при необходимости ее ликвидировать. То же относится и к нарушениям ритма – их необходимо скорректировать. При лечении пациентов с ОСН и низким АД должен использоваться норадреналин в высоких дозах или, при его отсутствии, Допмин (допамин) в вазопрессорной дозировке. Когда давление начинает повышаться, можно заменить норадреналин на Допмин или уменьшить дозу последнего. Затем, при дальнейшем росте АД и после выхода пациента из шока, применяется добутамин, после чего можно добавить периферические вазодилататоры или перевести пациента на левосимендан.
По данным исследований, летальность пациентов, у которых применялся левосимендан, была практически идентична летальности больных, получавших периферические вазодилататоры. Комбинированная терапия периферическими вазодилататорами в сочетании с инотропными средствами по эффективности также аналогична лечению левосименданом. Дело в том, что по своему гемодинамическому эффекту левосимендан находится между вазодилататорами и инотропными средствами.
Левосимендан не увеличивает частоту сердечных сокращений и не приводит к изменению сердечного индекса, а эффект от однократного применения данного препарата продолжается на протяжении 14 суток.
Завершая свое выступление, профессор Терещенко еще раз коротко перечислил основные достоинства левосимендана и подчеркнул, что механизм действия данного средства на сегодняшний день полностью изучен, известны и ситуации, в которых врачи могут и должны применять именно это лекарственное средство (рис. 6).
Применение β-блокаторов в лечении ОСН
Назначение β-блокаторов больным, страдающим сердечной недостаточностью, на сегодняшний день считается золотым стандартом лечения этого заболевания. Однако на практике, в обычной городской больнице, препараты данной группы либо не назначаются вовсе, либо даются в неправильных дозировках. К сожалению, многие практикующие врачи (даже те из них, которые считают применение β-блокаторов при сердечной недостаточности целесообразным) не могут правильно назвать целевую дозу метопролола.
Изменить ситуацию можно, постоянно напоминая врачам, что назначение β-блокаторов больным с ХСН положительно влияет на выживаемость, что было доказано как минимум в трех больших исследованиях трех лекарственных препаратов. Более сложная ситуация с острой сердечной недостаточностью.
В рекомендациях по диагностике и лечению острой и хронической сердечной недостаточности сказано, что у больных, получающих β-адреноблокаторы, при поступлении в стационар в связи с декомпенсацией ХСН их доза может быть уменьшена или они отменены. Однако общим правилом является продолжение лечения в том случае, если больной поступает в стационар с ОСН, являющейся декомпенсацией ХСН.
Поводов для отмены β-блокаторов несколько: брадикардия, высокая степень атриовентрикулярной блокады, бронхоспазм или кардиогенный шок.
Считается, что терапию β-адреноблокаторами следует назначать клинически стабильным больным, не находящимся на инотропных средствах. Очень важно, что начинать терапию необходимо в условиях стационара, не менее чем за сутки до выписки.
Профессор Затейщиков также обратил внимание собравшихся на следующее обстоятельство: как в зарубежных, так и в отечественных рекомендациях дата начала терапии β-блокаторами приурочена к дате выписки. Однако в Европе больного выписывают домой на 4–5-й (максимум – 10-й) день, то же относится и к США. В России же перенесших ОСН выписывают не ранее, чем через 15–20 дней.
Терапия β-блокаторами может быть начата только после оптимизации объема циркулирующей крови и успешной отмены внутривенных диуретиков, вазодилататоров и положительных инотропных средств, причем осторожно следует назначать β-блокаторы после инотропной терапии.
К сожалению, на сегодняшний день практически нет данных многоцентровых исследований, основываясь на которых специалисты могли бы однозначно решить вопрос целесообразности продолжения или прекращения приема β-блокаторов.
Впрочем, в отсутствие данных широкомасштабных исследований, мы можем обратиться к данным крупных регистров. В качестве примера профессор Затейщиков привел американский регистр OPTIMIZE-HF (Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients With Heart Failure), в котором содержится информация о 48 тысячах больных, причем часть этих больных страдала систолической дисфункцией и не получала β-блокаторы. Если проанализировать данные по этим больным, то станет очевидна корреляция: среди больных, попавших в стационар с ОСН и не получавших после обострения β-блокаторы, смертность выше. Впрочем, профессор Затейщиков призвал собравшихся с осторожностью относиться к этим данным, поскольку речь идет о ретроспективном анализе данных, полученных из регистра больных, а не о спланированном исследовании со специально отобранными участниками. В частности, невозможно учесть влияние тех факторов, из-за которых некоторым больным не были назначены β-блокаторы.
Следующий вопрос: какой инотропный препарат назначить больному, получавшему β-адреноблокаторы? Дело в том, что большая часть используемых положительных инотропных агентов взаимодействует с β-блокаторами, причем последние ослабляют действие инотропных средств.
Профессор Затейщиков привел данные еще одного исследования, в котором левосимендан сравнивался с другим инотропным средством, добутамином. Оба препарата назначались больным, принимавшим β-адреноблокаторы. В ходе исследования было установлено, что в группе находившихся на лечении левосименданом быстрее увеличивался сердечный выброс и эффективнее снижалось давление заклинивания легочной артерии.
Чем же левосимендан отличается от остальных инотропных препаратов? Подавляющее большинство положительных инотропных агентов повышают концентрацию кальция в плазме, а ведь именно уровень кальция является фактором, влияющим на силу сокращения. Повышение уровня кальция приводит к увеличению количества активированного тропонина С, обеспечивая более интенсивную работу актомиозинового комплекса. Левосимендан не увеличивает концентрацию кальция, он меняет конформацию молекулы тропонина таким образом, как будто количество ионов кальция действительно увеличилось. Главная особенность такого механизма действия – то, что количество кальция внутри клетки не нарастает, и процесс расслабления кардиомиоцита также не нарушается.
Завершая свое выступление, профессор Затейщиков еще раз коротко сформулировал основные его тезисы. Итак, если больной, попавший в стационар из-за острой сердечной недостаточности, ранее не получал β-блокаторы, необходимо дождаться стабилизации его состояния и назначить эти средства. Если же β-блокаторы уже применялись, следует по возможности избегать прекращения их приема. В качестве инотропного препарата в этом случае может быть использован левосимендан.
Место левосимендана в терапии декомпенсации ХСН
Несмотря на существенные достижения современной медицины в лечении больных с сердечной недостаточностью, смертность среди пациентов декомпенсированной ХСН по-прежнему остается очень высокой. Она составляет около 28%, что превышает показатели смертности среди пациентов, поступающих в стационар с впервые возникшей острой сердечной недостаточностью. Еще одной проблемой современной кардиологии является то обстоятельство, что 50% пациентов, оказавшихся в больнице из-за декомпенсации ХСН, в течение шести месяцев вновь госпитализируются.
Согласно статистическим данным около 70% пациентов с СН, у которых артериальное давление при поступлении в стационар было ниже 90 мм рт. ст., погибает в течение первого года после госпитализации. По мнению А.А. Скворцова, это именно те пациенты, которые в первую очередь нуждаются в лечении положительными инотропными средствами. В этой связи таким пациентам важно назначать такие препараты, которые не только улучшают клиническое состояние больного, но и благоприятно влияют на долгосрочный прогноз или, по крайней мере, не его ухудшают.
Левосимендан – препарат с уникальным механизмом действия (рис. 8). Прием этого средства не приводит к увеличению внутриклеточного кальция. В то же время хорошо известно, что кардиомиоциты у больных с сердечной недостаточностью и так перегружены этими ионами. Связываясь с тропонином С, левосимендан повышает его чувствительность к внутриклеточному кальцию, тем самым повышая сократимость без нарушения диастолы. Кроме того, левосимендан способствует открытию АТФ-зависимых калиевых каналов в гладкомышечных клетках, что приводит к расширению артерий и вен, в том числе коронарных. Этот эффект левосимендана обуславливает антиишемическое действие препарата, а также его способность снижать постнагрузку, быстро и значительно повышать сердечный выброс и уменьшать давление наполнения сердца.
Гемодинамические эффекты левосимендана проявляются очень быстро и, что немаловажно, продолжаются и после того, как инфузия препарата была завершена. Пролонгированное действие левосимендана (эффект от введения препарата сохраняется на протяжении 7–9 суток) обусловлено тем, что у него имеется по крайней мере два активных метаболита с периодом полного выведения 70–80 ч.
Ссылаясь на данные проведенных исследований, А.А. Скворцов сообщил, что выраженный гемодинамический эффект наблюдается при применении левосимендана в дозировке 0,1–0,2, и даже 0,05 мкг/кг/мин. Более высокие дозы левосимендана применять нецелесообразно, так как это приводит к существенному снижению артериального давления.
На сегодняшний день опубликованы (полностью или частично) результаты нескольких масштабных клинических исследований, проведенных среди пациентов с декомпенсированной ХСН: LIDO, REVIVE и SURVIVE (рис. 9). Для исследований отбирались больные 3 и 4-го функциональных классов сердечной недостаточности, а в качестве препаратов сравнения использовался добутамин либо плацебо. Согласно данным, полученным в ходе исследования LIDO, применение левосимендана приводило к более выраженному повышению сердечного выброса и уменьшению давления заклинивания легочной артерии у пациентов, включенных в исследование. У тех пациентов, которые изначально находились на терапии β-блокаторами, эффект левосимендана по сравнению с добутамином оказался наиболее выраженным.
В исследовании REVIVE приняли участие 600 пациентов, преимущественно – тяжелых больных с декомпенсированной ХСН (средний показатель фракции выброса составил всего 23%), которые были рандомизированы на группы «плацебо» и «левосимендан». В ходе исследования было установлено, что среди пациентов, получавших левосимендан, ухудшение наблюдалось реже, а улучшение – чаще, причем эффект от введения препарата сохранялся через 24 и 48 ч. Кроме того, пациенты, находившиеся на инфузии левосимендана, на 42% реже получали дополнительную терапию, а длительность госпитализации у них сократилась приблизительно на 2 суток.
К сожалению, такой важнейший параметр, как смертность, в группе участников исследования REVIVE, получавших левосимендан, оказался выше, чем у пациентов, принимавших плацебо. Высоковероятно, что такой результат может быть связан с тем обстоятельством, что в группе пациентов, получавших левосимендан, было значительно большее количество случаев тяжелой гипотонии, развитие которой особенно опасно у больных ишемической болезнью сердца. По мнению А.А. Скворцова, важно, что определенной предпосылкой к увеличению эпизодов гипотонии и смертности больных ХСН в этом клиническом испытании могло быть включение в исследование больных ОСН с исходно низким уровнем АД (85 мм рт. ст.), находящихся в состоянии кардиогенного шока, а так же параллельно получавших в/в терапию периферическими вазодилататорами, применение которых было разрешено по условиям этого протокола.
SURVIVE, еще одно исследование, в котором принимали участие преимущественно тяжелые больные с фракцией выброса менее 30%, 4-м ФК СН. Кроме того, у больных, включенных в исследование SURVIVE, отмечались очень высокие концентрации мозгового натрийуретического пептида, более 1000 пг/мл, что дополнительно указывает на тяжелое состояние этих пациентов. В ходе исследования было установлено, что влияние левосимендана на риск отдаленной (через 90 и 180 дней после введения) смерти больных СН был сопоставим с аналогичным показателем среди пациентов в группе добутамина. Но после проведения дополнительного анализа результатов исследования стало ясно, что применение левосимендана существенно снижает риск смерти в ранние сроки, на 5-й и на 30-й день после применения препарата. Данный эффект был особенно выражен у больных, имевших в анамнезе симптомы ХСН, а также у тех пациентов, которые исходно находились на терапии β-адреноблокаторами.
Еще одним важным аспектом лечения левосименданом является его влияние на концентрацию мозгового натрийуретического пептида. Согласно данным исследования REVIVE и SURVIVE, она гораздо эффективнее снижалась при лечении левосименданом, чем при приеме плацебо и добутамина.
В 2010 году был проведен метаанализ всех ключевых исследований с левосименданом, который подтвердил ранее выдвинутые предположения:
- применение левосимендана для лечения больных декомпенсированной ХСН предпочтительнее добутамина (с уровнем систолического АД выше 85 мм рт. ст.);
- левосимендан достоверно улучшает прогноз по сравнению с добутамином:
- в ранние сроки после инфузии,
- у пациентов с ХСН в анамнезе, а также исходно находящихся на терапии β-адреноблокаторами;
- левосимендан оказывает выраженный эффект на концентрацию мозгового натрийуретического пептида у больных с ОСН;
- достоверных отличий во влиянии однократного применения левосимендана на долговременный прогноз по сравнению с использованием с плацебо не выявлено, но левосимендан достоверно улучшает прогноз по сравнению с добутамином, особенно в ранние сроки после инфузии.
А.А. Скворцов резюмировал, что в настоящее время готовятся новые исследования левосимендана, которые дадут дополнительную информацию об этом препарате для медицинского сообщества.
Фармакологическое прекондиционирование левосименданом в кардиохирургии
Успешное развитие кардиохирургии позволило снизить госпитальную летальность в отдельных группах больных до 1–3%. Однако несмотря на успехи нельзя не признать существование серьезных нерешенных проблем. В настоящее время по-прежнему высока частота осложнений после операций на сердце с ИК, которая составляет 20–30%. К главным причинам гибели больных в раннем послеоперационном периоде относят острую сердечную недостаточность, синдром острого повреждения легких, острую почечную недостаточность, дисфункцию нервной системы, синдром полиорганной недостаточности.
Если внимательно рассматривать категорию пациентов, которым была выполнена операция, можно заметить, что практически у каждого из них в ближайшем послеоперационном периоде имеются признаки нарушения контрактильности миокарда, требующие проведения временной инотропной терапии. Примерно у 25% больных после операции имеются электрофизиологические, гистологические и биохимические признаки инфаркта миокарда. Около 10% пациентов переносят инфаркт с Q-зубцом.
До настоящего времени основные усилия кардиохирургов были направлены на защиту сердца от ишемических повреждений во время основного этапа операции, однако сейчас специалистам стало очевидно, что должны существовать и другие факторы, способствующие развитию осложнений. Был предложен ряд гипотез, лидирующей из которых на сегодняшний день является предположение, что основным источником проблем являются ишемические/реперфузионные изменения в миокарде. Кроме того, дополнительным фактором риска может стать системная воспалительная реакция на искусственное кровообращение и хирургическую травму.
Судьба ишемизированного миокарда при восстановлении кровообращения может быть различна, от инфаркта миокарда до частичного восстановления функции, которое называется миокардиальным станнингом. Такое разнообразие клинического течения имеет под собой биохимическую основу. Дело в том, что ишемия-реперфузия может рассматриваться как каскад реакций, начинающихся в период ишемии и повторяющихся уже во время реперфузии (рис. 11).
Клинически реперфузия сопровождается нарушениями ритма, падением контрактильности миокарда и дисфункцией эндотелия. Кроме того, описаны случаи, когда нефатальная ишемия на фоне реперфузии неожиданно оборачивалась тяжелыми повреждениями.
Результаты проведенных исследований привели специалистов к разработке теории «реперфузионных повреждений», а также поставили перед кардиохирургами закономерный вопрос: можно ли расширить арсенал мероприятий по кардиопротекции, так, чтобы они не ограничивались противоишемической защитой сердца (кардиоплегией). Кардиопротекция в период реперфузии жизненно необходима, так как именно восстановление кровотока приводит к дисфункции миокарда.
Таким образом, профилактика повреждений миокарда во время кардиохирургических вмешательств включает реализацию различных механизмов цитопротекции до ишемии (прекондиционирование), во время ишемии и в ранней фазе реперфузии (посткондиционирование).
Биохимические изменения, происходящие во время ишемии и реперфузии, сложны. Недостаток кислорода приводит к снижению синтеза АТФ в митохондриях. Эти явления приводят к активации гликолиза, накоплению молочной кислоты, что приводит к ацидозу. Следствием уменьшения содержания АТФ является снижение функционирования транспортных систем. Так, при гипоксии наблюдается ингибирование К+-каналов, что приводит к деполяризации мембраны клетки и увеличению входа Са2+ через потенциал-чувствительные Са2+-каналы. В ответ на понижение рН среды (повышение содержания ионов Н+) Na+/H+-обменник переносит наружу внутриклеточные ионы водорода в обмен на ионы натрия. Это вызывает увеличение содержания ионов Na+ в клетке. Увеличение содержания ионов Na+ в клетке замедляет работу Na+/Са2+-обменника, в результате в клетке увеличивается содержание Са2+. Кроме того, при глубокой гипоксии Na+/Са2+-обменник может активировать свою работу в обратном направлении, что приводит к некоторому уменьшению содержания внутриклеточного натрия и резкому увеличению содержания ионов кальция. Свободные радикалы и пероксинитрит, генерируемые при гипоксии, инактивируют Са2+-АТФ-азу саркоплазматического ретикулума внешней мембраны и мембран внутриклеточного депо кальция, что тоже приводит к увеличению содержания внутриклеточного кальция.
Одним из существенных последствий внутриклеточной аккумуляции Na+ и Са2+ являются ишемическая контактура кардиомиоцитов и вазоконстрикция сосудов различных тканей. Во время ранней фазы реперфузии происходит быстрая коррекция ацидоза путем активации Na+/Н+-обменника, Na+/НСО3-симпортера и активного удаления из клетки лактата.
Следствием коррекции ацидоза является активация Na+/Са2+ обмена с прогрессирующим ростом содержания Са2+ в цитозоле.
В патогенезе повреждений клетки при ишемии и реперфузии ключевую роль играет дисфункция митохондриальных переходных пор. Быстрое восстановление кровообращения после ишемии и восстановление переноса электронов в дыхательной цепи митохондрий генерирует массивное образование радикалов и вызывает перегрузку Са2+ митохондриального матрикса. Эти два фактора стимулируют открытие митохондриальных пор (mPTP). В нормальных условиях mPTP закрыты и внутренняя мембрана непроницаема для большинства метаболитов и ионов (рис. 12).
Во время ишемии mPTP блокированы вследствие ацидоза и угнетения переноса электронов. Во время реперфузии роеоксигенация и восстановление транспорта электронов стимулируют образование АФК и способствуют дальнейшему увеличению содержания внутриклеточного кальция. Увеличение концентрации кальция в цитозоле ведет к блокаде энергетических процессов на мембране митохондрий и снижению синтеза АТФ. Реализация этих механизмов ведет к открытию mPTP. Открытие mPTP вызывает нарушение осмотического градиента и сопровождается отеком матрикса и разрывом (повреждением) других митохондриальных мембран.
Судьба клетки определяется количеством открытых митохондриальных каналов. При малом числе открытых mPTP функция клетки восстанавливается полностью. При большом числе открытых mPTP клетка может восстанавилваться полностью или погибнуть в результате апоптоза. В случае генерализованного открытия mPTP клетка погибает в результате некроза.
Таким образом, предупреждение открытия mPTP является методом профилактики ишемических/реперфузионных повреждений. Именно этот механизм лежит в основе кардиопротекторного эффекта ишемического прекондиционирования.
Прекондиционирование – это термин, который используют для характеристики толерантности клетки к воздействию повреждающего фактора в результате предварительного влияния на клетку стрессорных стимулов. Применительно к миокарду, ишемическое прекондиционирование характеризует адаптационный ответ на короткий эпизод ишемии/реперфузии, формирующий парадоксальную устойчивость миокарда к последующей летальной ишемии. Левосимендан относится к группе препаратов, оказывающих «подобное прекондиционированию» действие. Этот эффект принято обозначать термином фармакологическое прекондиционирование (рис. 13).
Как и при ишемическом прекондиционировании, в условиях фармакологического прекондиционирования левосименданом результатом действия различных внутриклеточных медиаторов является открытие митохондриальных КАТФ-каналов. АТФ-зависимые калиевые каналы являются важным медиатором и/или исполнительным звеном кардиопротекции. Активация КАТФ-каналов блокирует открытие переходных митохондриальных пор, предотвращает апоптоз и/или некроз путем сохранения нуклеотидов и высокоэнергетических фосфатов. Улучшение защиты миокарда во время операции в условиях реализации механизмов фармакологического прекондиционирования проявляется уменьшением размера инфаркта миокарда, улучшением сократительной функции миокарда и сердечного выброса, а также снижением частоты реперфузионных аритмий. Есть основания полагать, что левосимендан путем открытия КАТФ-каналов митохондрий может имитировать ишемическое прекондиционирование и улучшить сердечную функцию и жизнеспособность клеток.
Наряду с прекондиционированием, к основным механизмам действия левосимендана относят увеличение чувствительности сократительных белков какрдиомиоцитов к кальцию и способность открывать АТФ-зависимые калиевые каналы в гладких мышцах сосудистой стенки. Эти свойства левосимендана могут быть весьма полезны при реализации концепции профилактики интраоперационного инфаркта миокарда, основанной на противоишемическом (антиишемическом) эффекте β-адреноблокаторов. К сожалению, прием этих средств сопровождается рядом нежелательных эффектов, например, уменьшением сердечного выброса и артериальной гипотензией, что делает оправданным назначение β-блокаторов в сочетании с инотропными препаратами. Вместе с тем, существуют свидетельства, что наряду с улучшением параметров гемодинамики, применение β-стимуляторов сопровождается достаточно частым возникновением побочных эффектов и может приводить к увеличению смертности даже при незначительном внутривенном введении. Экспериментальные данные и результаты клинических исследований указывают на способность левосимендана улучшить сократимость миокарда при одновременном использовании β-адреноблокаторов.
Левосимендан относится к негликозидным инотропным средствам и является представителем нового класса препаратов, называемых «сенситизаторами кальция». Действие левосимендана проявляется при имеющихся концентрациях кальция в клетке и принципиально отличается от широко использующихся положительных инотропных агентов, приводящих к увеличению содержания цАМФ и кальция внутри клетки (добутамин, допамин). Поэтому можно ожидать, что многие нежелательные явления (повышение потребления миокардом кислорода и потребности в нем, аритмогенный эффект), вызванные перегрузкой кардиомиоцитов кальцием, при применении левосимендана не будут выражены. Это особенно важно для пациентов с тяжелыми нарушениями гемодинамики, у которых невозможно стабилизировать систему кровообращения во время операции какими-либо способами, помимо назначения комбинации β-блокаторов с инотропными препаратами.
Завершая свое выступление, Ю.И. Гороховатский рассказал собравшимся о собственном опыте применения левосимендана при кардиохирургических операциях. Инфузию препарата начинали с этапа вводной анестезии. Нагрузочная доза не использовалась. Поддерживающая доза составила 0,1 мкг/кг/мин. Длительность введения 20–24 ч. По сравнению с контрольной группой, получавшей стандартную терапию, больные, которым вводился левосимендан, демонстрировали лучшие показатели производительности сердца. Уровень тропонина Т был ниже в группе левосимендана. Кроме того, левосимендан благотворно влиял на гемодинамические показатели в первые сутки после операции. Общая тенденция снижения послеоперационных осложнений с применением левосимендана включала в себя снижение частоты фибрилляции предсердий, меньшую необходимость в инотропной поддержке, меньшее время ИВЛ и более короткий период пребывания в реанимационном отделении и в стационаре.
Таким образом, можно с уверенностью утверждать, что левосимендан обладает кардиопротекторными свойствами, которые проявляются при использовании данного средства с целью фармакологического прекондиционирования.
Новости на тему
05.02.2024
28.12.2023
СТАТЬИ по теме
Отправить статью по электронной почте
Ваш адрес электронной почты:
23 ноября 2010 года в рамках проходившей в Москве в РКНПК Росмедтехнологий III Всероссийской конференции «Неотложная кардиология–2010» состоялся научный симпозиум «Острая сердечная недостаточность 2010: что изменилось», организованный компанией «Орион Фарма».
На мероприятии с докладами выступили известные ученые, ведущие специалисты по острой и хронической сердечной недостаточности. Они поделились с собравшимися (прежде всего – практикующими врачами и студентами-медиками)
своим взглядом на проблемы ведения пациентов с ОСН.
На мероприятии с докладами выступили известные ученые, ведущие специалисты по острой и хронической сердечной недостаточности. Они поделились с собравшимися (прежде всего – практикующими врачами и студентами-медиками)
своим взглядом на проблемы ведения пациентов с ОСН.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
