Полиморфизм гена рецептора лептина и лептинорезистентность при неалкогольной жировой болезни печени, ассоциированной с ожирением
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить клиническое значение полиморфизма Gln223Arg гена рецептора лептина, его взаимосвязь с уровнями лептина и растворимого рецептора лептина у больных НАЖБП, ассоциированной с ожирением.
Материал и методы. Обследовано 114 пациентов с НАЖБП (56 женщин и 58 мужчин, средний возраст – 51,4 ± 1,34 года). У 42 больных установлен диагноз неалкогольного стеатогепатита, в остальных случаях диагностирован стеатоз печени. Олигонуклеотидный полиморфизм гена LEPR определяли с помощью аллельспецифической полимеразной цепной реакции (тест-система ООО НПФ «Литех»). Содержание лептина и его растворимого рецептора (sLep-R) в крови устанавливали методом иммуноферментного анализа. Группа контроля состояла из 72 здоровых лиц с индексом массы тела менее 25 кг/м2.
Результаты. Гомозиготный генотип гена LEPR Arg223Arg при НАЖБП наблюдался реже, а аллель 223Gln встречался чаще, чем в группе контроля. У пациентов с НАЖБП уровень лептина в крови был выше, а содержание sLep-R ниже, чем у здоровых добровольцев. Показатели лептина и sLep-R находились в состоянии обратной зависимости. Содержание лептина у женщин с НАЖБП превышало таковое у пациентов мужского пола, а уровни sLep-R не различались. Установлено, что лептин в крови напрямую зависит от индекса массы тела, соотношения «объем талии/объем бедер», значений НОМА-индекса, показателей холестерина липопротеинов низкой плотности и триглицеридов. При наличии гомозиготного варианта LEPR Arg223Arg плазменный уровень лептина достоверно ниже, чем при наличии аллеля Gln223 в гомозиготном или гетерозиготном вариантах. Содержание растворимого рецептора в этих группах больных одинаково.
Заключение. Полиморфизм гена LEPR Gln223Arg ассоциирован с гиперлептинемией у больных НАЖБП. Повышенные уровни лептина могут играть важную роль в патогенезе НАЖБП, особенно неалкогольного стеатогепатита.
Цель – оценить клиническое значение полиморфизма Gln223Arg гена рецептора лептина, его взаимосвязь с уровнями лептина и растворимого рецептора лептина у больных НАЖБП, ассоциированной с ожирением.
Материал и методы. Обследовано 114 пациентов с НАЖБП (56 женщин и 58 мужчин, средний возраст – 51,4 ± 1,34 года). У 42 больных установлен диагноз неалкогольного стеатогепатита, в остальных случаях диагностирован стеатоз печени. Олигонуклеотидный полиморфизм гена LEPR определяли с помощью аллельспецифической полимеразной цепной реакции (тест-система ООО НПФ «Литех»). Содержание лептина и его растворимого рецептора (sLep-R) в крови устанавливали методом иммуноферментного анализа. Группа контроля состояла из 72 здоровых лиц с индексом массы тела менее 25 кг/м2.
Результаты. Гомозиготный генотип гена LEPR Arg223Arg при НАЖБП наблюдался реже, а аллель 223Gln встречался чаще, чем в группе контроля. У пациентов с НАЖБП уровень лептина в крови был выше, а содержание sLep-R ниже, чем у здоровых добровольцев. Показатели лептина и sLep-R находились в состоянии обратной зависимости. Содержание лептина у женщин с НАЖБП превышало таковое у пациентов мужского пола, а уровни sLep-R не различались. Установлено, что лептин в крови напрямую зависит от индекса массы тела, соотношения «объем талии/объем бедер», значений НОМА-индекса, показателей холестерина липопротеинов низкой плотности и триглицеридов. При наличии гомозиготного варианта LEPR Arg223Arg плазменный уровень лептина достоверно ниже, чем при наличии аллеля Gln223 в гомозиготном или гетерозиготном вариантах. Содержание растворимого рецептора в этих группах больных одинаково.
Заключение. Полиморфизм гена LEPR Gln223Arg ассоциирован с гиперлептинемией у больных НАЖБП. Повышенные уровни лептина могут играть важную роль в патогенезе НАЖБП, особенно неалкогольного стеатогепатита.



Введение
В настоящее время неалкогольная жировая болезнь печени (НАЖБП) рассматривается как одно из связанных с метаболическим синдромом заболеваний или одно из проявлений метаболического синдрома, ассоциированного с ожирением и инсулинорезистентностью [1, 2]. Ожирение, особенно висцеральное, относится к наиболее распространенным факторам риска развития НАЖБП [3, 4].
Лептин – гормон жировой ткани, секретируемый в основном адипоцитами белой жировой ткани и формирующий сигнал для отрицательной обратной связи в центральной нервной системе, регулирующий аппетит и обмен веществ [5]. За счет снижения потребления пищи и увеличения термогенеза лептин контролирует количество жировой ткани и, следовательно, массу тела. Секреция лептина регулируется различными гормонами, в том числе инсулином, глюкокортикостероидами и собственно лептином [6, 7]. Лептин секретируется пропорционально количеству белой жировой ткани и циркулирует либо в свободной, либо связанной с белками форме [8].
У лиц с ожирением экспрессия гена лептина в жировой ткани повышается, что приводит к увеличению уровня лептина в крови. Потенциальным механизмом развития ожирения считается состояние резистентности к лептину по аналогии с инсулинорезистентностью, наблюдаемой при сахарном диабете 2-го типа.
Лептинорезистентность чаще выявляется у пациентов с морбидным ожирением, реже у лиц с нормальной массой тела [9]. Доказано наличие лептинорезистентности у больных НАЖБП [10].
К гиперлептинемии и лептинорезистентности могут приводить мутации в генах лептина и его рецептора. Действие лептина в периферических тканях осуществляется путем взаимодействия со специфическими трансмембранными рецепторами. Рецептор лептина (LEPR или Ob-R) принадлежит семейству цитокинов 1-го класса и может служить важным маркером чувствительности к лептину [11].
Выделено шесть изоформ рецепторов лептина, которые экспрессируются в центральной нервной системе и других периферических тканях [12]. Кроме трансмембранных рецепторов имеется растворимая форма рецептора лептина (sLep-R), или растворимый рецептор лептина, который является основным лептин-связывающим белком, формирующим комплексы с циркулирующим лептином, а баланс между свободной и связанной формами лептина регулирует его биодоступность [13].
Все виды рецепторов лептина кодируются одним геном – LEPR [14]. Наиболее распространенной и изучаемой мутацией гена LEPR считается замена аденина гуанином в 668-м положении (A668G, rs1137101), что приводит к замене глутамина аргинином в 223-й позиции в белке (Gln223Arg, Q223R), а также изменению функциональных особенностей рецептора.
Высказывается мнение, что мутации гена LEPR могут быть факторами риска развития НАЖБП [15, 16]. Однако сведения о связи полиморфизма Gln223Arg LEPR с уровнями лептина и его циркулирующего рецептора при НАЖБП немногочисленны.
Определение роли полиморфизма Gln223Arg LEPR в изменениях продукции лептина и sLep-R у больных НАЖБП, ассоциированной с ожирением, может иметь важное клиническое значение для понимания механизмов развития лептинорезистентности и поиска новых биомаркеров жировой болезни печени.
Целью данного исследования стала оценка клинического значения полиморфизма Gln223Arg гена рецептора лептина, в том числе во взаимосвязи с уровнями лептина и его растворимого рецептора у больных НАЖБП, ассоциированной с ожирением.
Материал и методы
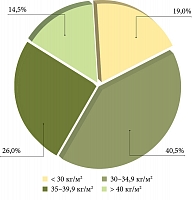
Обследовано 114 пациентов (56 женщин, 58 мужчин) с диагностированной НАЖБП. Средний возраст обследованных – 51,4 ± 1,34 года. У всех больных диагностировано ожирение или избыточная масса тела, средний показатель индекса массы тела (ИМТ) составил 35,46 ± 0,92 кг/м2. Распределение пациентов в зависимости от ИМТ представлено на рис. 1. Показатели обмена липидов у пациентов отличались от нормы: общий холестерин (ХС) – 5,83 ± 0,23 ммоль/л, ХС липопротеинов низкой плотности (ЛПНП) – 3,6 ± 0,22 ммоль/л, ХС липопротеинов высокой плотности – 1,08 ± 0,04 ммоль/л, триглицериды – 2,85 ± 0,35 ммоль/л. У всех пациентов с НАЖБП имела место инсулинорезистентность – показатели НОМА-индекса в группе составили 4,75 (4,14–7,32).
У 42 пациентов установлен диагноз неалкогольного стеатогепатита (НАСГ), в остальных случаях диагностирован стеатоз печени. Активность ферментов цитолиза в группе НАЖБП в целом была следующей: аланинаминотрансфераза – 61,0 (39,5–93,8) ЕД/л, аспартатаминотрансфераза – 40,0 (29,5–58,5) ЕД/л.
В исследование не включались пациенты с сопутствующим поражением печени алкогольной этиологии (употребление алкоголя в гепатотоксических дозах), с наличием маркеров вирусных гепатитов – anti-HCV, HBsAg, с аутоиммунным или лекарственным поражением печени, а также при наличии сахарного диабета (СД) 1-го типа или инсулинозависимого СД 2-го типа. В исследовании не участвовали пациенты с суб- и декомпенсированным циррозом печени (класс B или C по шкале Чайлда – Пью).
В контрольную группу, сопоставимую с основной группой по половозрастным характеристикам, вошли 72 здоровых добровольца с ИМТ < 25 кг/м2. Всем лицам контрольной группы выполнено генетическое исследование полиморфизма гена LEPR. Содержание лептина и его рецептора определяли у 42 человек группы контроля. Всем пациентам проведено общеклиническое исследование с обязательным определением антропометрических параметров (ИМТ, объем талии (ОТ), объем бедер (ОБ), соотношение ОТ/ОБ, а также стандартное лабораторно-инструментальное обследование). 37 пациентам для подтверждения диагноза стеатогепатита выполнена пункционная биопсия печени.
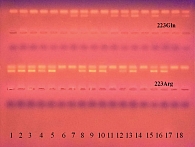
Олигонуклеотидный полиморфизм гена LEPR (Gln223Arg) определяли с помощью аллельспецифической полимеразной цепной реакции (тест-система ООО НПФ «Литех») с последующей электрофоретической детекцией. На рисунке 2 представлен вариант электрофореграммы продуктов амплификации полиморфного локуса LEPR Gln223Arg.
В плазме крови пациентов определяли содержание sLep-R и лептина методом иммуноферментного анализа с помощью коммерческих тест-систем (ВioVendor и Diagnostics Biochem Canada Inc.).
Полученные результаты были статистически обработаны с помощью компьютерных программ Microsoft Office Excel 2010 с встроенной подпрограммой Attestat 10.5.1, IBM SPSS Statistics 21. Соответствие распределения частот генотипов равновесию Харди – Вайнберга определяли по стандартным формулам. О частоте встречаемости аллеля/генотипа (в долях) судили по соотношению количества его носителей к общему количеству носителей тестируемых аллелей/генотипов в исследуемой выборке. Различия в распределении частот генотипов и аллелей между сравниваемыми группами определяли с помощью критерия хи-квадрат. При нормальном распределении данных количественные значения представлены в виде средней ± стандартная ошибка средней (). Данные выборок с ненормальным распределением описывались в виде медианы и интерквантильного (25-й и 75-й процентили) размаха (Ме (Q1–Q3)). Для сравнения данных в этих группах использовали U-критерий Манна – Уитни. Достоверными считались различия при p ≤ 0,05. Корреляционный анализ проводили с использованием критерия Спирмена.
Результаты и обсуждение
Распределение аллелей и генотипов полиморфного локуса LEPR Gln223Arg представлено в табл. 1. Гомозиготный генотип Arg223Arg в группе пациентов с НАЖБП, ассоциированной с ожирением, встречался реже, чем у здоровых лиц с нормальной массой тела. При этом гетерозиготный вариант Gln223Arg отмечался чаще, но статистических различий установить не удалось (р = 0,056). Анализ распространенности отдельных аллелей показал, что аллель 223Gln при жировой болезни печени на фоне ожирения наблюдался чаще, а 223Arg, напротив, реже, чем в группе контроля (р = 0,04). Данные литературы о вариациях обсуждаемого олигонуклеотидного полиморфизма противоречивы: распространенность аллеля Arg в европейских популяциях варьируется от 32 до 58% [17]. Данные о частоте полиморфизма Gln223Arg при ожирении, метаболическом синдроме и НАЖБП различны. Так, среди жителей Санкт-Петербурга носительство аллеля Arg обнаружено у 44% больных ожирением и 40% в общей популяции [18]. Выявлена более высокая распространенность аллеля Arg223 в гомозиготном состоянии у лиц с избыточным весом и ожирением по сравнению с субъектами с нормальной массой тела [19].
В других исследованиях, наоборот, установлен более высокий риск развития метаболического синдрома у носителей Gln223Gln и Gln223Arg генотипов [20], а также доказан «протективный» эффект аллеля Arg в отношении риска развития ожирения у жителей Тихоокеанских островов [21]. А.В. Морозова и соавт. показали, что носительство аллеля 223Gln может предрасполагать к развитию НАЖБП и в отсутствие ожирения, особенно у женщин [22].
Содержание лептина в крови пациентов с НАЖБП было выше, а sLep-R ниже, чем в группе сравнения (табл. 2). Наши данные сопоставимы с выводами метаанализа 33 исследований, проведенного A.T. Polyzos и соавт., которые пришли к выводу, что, несмотря на определенную разнородность полученных результатов, у пациентов с НАЖБП повышен уровень циркулирующего лептина по сравнению со здоровыми лицами [23]. Связь свободных фракций лептина в плазме обеспечивает sLep-R, он же регулирует его биодоступность [24]. Развивающийся дисбаланс лептина и sLep-R может свидетельствовать о высокой резистентности периферических тканей к действию лептина [10]. Как известно, лептинорезистентность в большей степени проявляется у пациентов с НАЖБП, чем у лиц с ожирением без стеатоза печени [10], а уровни сывороточного лептина при стеатогепатите превышают таковые у здоровых лиц [25]. В то же время у пациентов с НАЖБП концентрация sLep-R значительно ниже, чем у пациентов контрольной группы [10]. Нами также выявлена обратная корреляционная зависимость между уровнями лептина и sLep-R у больных НАЖБП – rs = -0,61 (р = 0,0005). Эта зависимость отражает характер взаимосвязи системы «лептин – растворимый рецептор лептина».
Отмечались определенные различия в содержании лептина в крови у мужчин и женщин. Уровень лептина у женщин с НАЖБП выше, чем у мужчин, – 37,2 (23,5–54,8) и 18,55 (8,8–44,8) нг/мл соответственно (р = 0,019). Однако уровни sLep-R у мужчин и женщин не различались. Более высокое содержание лептина у женщин подтверждают и работы других авторов [10, 26]. Лептин секретируется и экспрессируется преимущественно в жировой ткани, и гендерная разница объясняется отчасти более высоким количеством жировых отложений у женщин.
Бытует мнение, что к сниженной продукции рецептора лептина приводит полиморфизм его гена. Кроме того, полиморфизм в гене рецептора лептина связан с риском развития НАЖБП [15, 27]. Считается, что полиморфизм гена рецептора лептина способствует развитию НАЖБП, влияя на липидный обмен и чувствительность к инсулину [28].
Мы проанализировали уровни лептина и sLep-R в зависимости от генотипов полиморфного локуса LEPR (табл. 3). Оказалось, что при гомозиготном варианте Arg223Arg плазменный уровень лептина достоверно ниже, чем при наличии аллеля Gln223 в гомозиготном или гетерозиготном вариантах. При этом содержание растворимого рецептора в группах не различалось. Таким образом, аллель Gln223 ассоциирован с повышенными уровнями лептина в крови пациентов с НАЖБП.
Уровень лептина в крови напрямую зависел от ИМТ (rs = 0,31), соотношения ОТ/ОБ (rs = 0,34), показателей ХС ЛПНП (rs = 0,29) и триглицеридов (rs = 0,35) – во всех случаях р < 0,05. Выявленные корреляции подтверждают взаимосвязь гиперлептинемии с ожирением, а также гиперлипидемией, ассоциируемой с липотоксичностью при НАЖБП [10, 29].
Кроме того, установлена положительная корреляционная зависимость между содержанием в плазме лептина и значениями НОМА-индекса – rs = 0,39 (р = 0,028). Известно, что лептин может влиять на чувствительность гепатоцитов к сигналам инсулина, поскольку способствует накоплению в клетках печени свободных жирных кислот, приводящему к инсулинорезистентности [29]. Мы не смогли обнаружить прямую зависимость между уровнями лептина и показателями биохимической активности воспалительного процесса в печени – уровнями ферментов цитолиза.
Был проведен анализ распространенности полиморфизма гена LEPR в группах с НАСГ и простым стеатозом. Выяснилось, что в группе НАСГ реже, чем при стеатозе, встречался генотип Arg223Arg: 0,26 и 0,46; р = 0,045. Было также обнаружено, что при стеатогепатите чаще встречается аллель 223Gln – 0,55 против 0,37 при стеатозе (р = 0,016). Отношение шансов наличия стеатогепатита при наличии аллеля 223Gln оказалось равным 2,01 (1,17–3,48); р = 0,012. При этом средние значения лептина в группе НАСГ превысили таковые в группе стеатоза – 51,55 (23,8–64,7) и 26,7 (12,2–35,7) нг/мл соответственно (р = 0,029). Полученные данные о высоких уровнях лептина у больных НАСГ подтверждают аналогичные результаты предыдущих исследований [25, 30]. С учетом хорошо известных воспалительных и профиброгенных свойств лептина [30] можно предположить, что наличие полиморфизма гена LEPR предрасполагает к высоким уровням лептина, который в свою очередь способствует развитию воспалительного процесса в стеатозной печени.
Заключение
Гомозиготный генотип гена LEPR Arg223Arg при жировой болезни печени на фоне ожирения наблюдается реже, а аллель 223Gln встречается чаще, чем в группе контроля. У пациентов с НАЖБП уровень лептина в крови выше, а содержание sLep-R ниже, чем у здоровых добровольцев. Показатели лептина и sLep-R находятся в обратной зависимости. Содержание лептина у женщин с НАЖБП выше, чем у мужчин, а уровни sLep-R одинаковы. Уровень лептина в крови напрямую связан с ИМТ, соотношением ОТ/ОБ, значением НОМА-индекса, показателями ХС ЛПНП и триглицеридов. При наличии гомозиготного варианта LEPR Arg223Arg плазменный уровень лептина достоверно ниже, чем при наличии аллеля Gln223 в гомозиготном или гетерозиготном вариантах. Содержание растворимого рецептора в группах одинаково.
Таким образом, аллель Gln223 ассоциирован с повышенными уровнями лептина в крови пациентов с НАЖБП. При неалкогольном стеатогепатите чаще, чем при стеатозе печени, встречается аллель 223Gln, реже – генотип Arg223Arg.
A.V. Yagoda, MD, PhD, Prof., T.V. Geyvandova, S.Sh. Rogova, PhD, N.I. Geyvandova, MD, PhD, Prof.
Stavropol State Medical University
Stavropol Regional Clinical Diagnostic Center
Contact person: Natalia I. Geyvandova, ngeyvandova@yandex.ru
Summary. The role of adipocytokine leptin in the pathogenesis of non-alcoholic fatty liver disease (NAFLD) is not well defined.
Objective: to determine the clinical significance of the Gln223Arg polymorphism of the leptin receptor gene, it's relationship with the levels of leptin and soluble receptor in patients with non-alcoholic fatty liver disease associated with obesity.
Material and methods. 114 patients with NAFLD (56 women and 88 men, mean age 51.4 ± 1.34 years) were examined. In 42 patients, non-alcoholic steatohepatitis was diagnosed, in other cases, liver steatosis was diagnosed. Oligonucleotide polymorphism of the LEPR gene was determined using allele-specific PCR (test-system NPF Liteh LLC). Leptin and it's soluble receptor (sLep-R) level in blood was determined by ELISA. The control group consisted of 72 healthy individuals with a BMI < 25.
Results. The Homozygous genotype of the LEPR gene Arg223Arg was less frequently observed than in NAFLD, and the allele 223Gln was more frequently observed than in the control group. In patients with NAFLD, the level of leptin in blood is higher, and the sLep-R level is lower than in healthy ones. Leptin and sLep-R are in inverse relationship. Leptin levels were higher in women with NAFLD than in male patients, and sLep-R levels did not differ. Leptin in blood had a direct dependence on the body mass index, the ratio OT/OB, on the values of the HOMA index, the values of low density lipoprotein cholesterol and triglycerides. In the presence of the homozygous LEPR Arg223Arg variant, the plasma leptin level was significantly lower than in the presence of the Gln223 allele in the homozygous or heterozygous variants, and the soluble receptor level in these groups of patients did not differ.
Conclusion. LEPR Gln223Arg gene polymorphism is associated with hyperleptinemia in patients with NAFLD. Elevated levels of leptin can play an important role in the pathogenesis of NAFLD, and especially non-alcoholic steatohepatitis.
