Применение афатиниба в терапии немелкоклеточного рака легкого с делецией в 19-м экзоне гена EGFR
- Аннотация
- Статья
- Ссылки
- English
Введение
Рак легкого остается ведущей причиной смерти в структуре онкологических заболеваний в мире [1], в том числе в России [2].
В Иркутской области в 2014 г. диагноз рака легкого впервые установлен у 1170 пациентов, умерло 973 пациента. Показатели заболеваемости и смертности составили 48,41 и 40,26 на 100 000 населения соответственно [2, 3]. У 60,3% больных диагноз установлен на IV стадии заболевания, летальность на первом году составила 63,1% [3, 4]. В регионе наиболее часто встречаются плоскоклеточный рак – 47,9%, аденокарцинома – 26,3%, мелкоклеточный рак – 21,7%, [3].
В США и странах Европы в структуре немелкоклеточного рака легкого (НМРЛ) преобладает аденокарцинома – до 55% [5].
Несмотря на появление новых методов терапии местнораспространенного метастатического НМРЛ, его лечение остается одной из основных проблем современной онкологии. Основными задачами являются увеличение продолжительности жизни больных и улучшение ее качества (облегчение симптомов заболевания, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта и качества жизни пациентов [6, 7].
Проведенные в 1990-х гг. исследования и их метаанализы убедительно показали более высокие результаты лечения на фоне химиотерапии платиносодержащими комбинациями по сравнению с поддерживающей терапией при распространенном НМРЛ [8, 9]. Однако медиана выживаемости составила менее года, а время до прогрессирования – четыре – шесть месяцев. Улучшить результаты лечения удалось благодаря внедрению новых химиопрепаратов, применению таргетного лечения при наличии активирующих мутаций генов EGFR и ALK, а также новой стратегии поддерживающей терапии [10].
У больных неплоскоклеточным НМРЛ на первом этапе проводится генетический анализ для выявления мутаций гена EGFR и транслокации ALK. Делеция в 19-м экзоне и замена в 21-м экзоне (L858R) составляют 90% выявляемых мутаций [11]. О наличии данных изменений в гене EGFR свидетельствует чувствительность опухоли к группе препаратов ингибиторов тирозинкиназы EGFR. В такой ситуации больным в качестве терапии первой линии рекомендованы препараты афатиниб, эрлотиниб или гефитиниб [6].
Клинический случай
В мае 2015 г. в Иркутский областной онкологический диспансер обратилась пациентка 1969 г.р. с жалобами на боли в левом бедре, усиливающиеся при ходьбе. При обследовании установлен диагноз: рак (аденокарцинома) нижней доли правого легкого T2N2M1, стадия IV, метастаз в левую подвздошную кость. С учетом единичного характера отдаленного метастазирования пациентке 17 июня 2015 г. была выполнена расширенная нижняя билобэктомия справа с билатеральной лимфаденэктомией. При гистологическом исследовании – папиллярная аденокарцинома нижней доли правого легкого G2, метастазы в трех лимфатических узлах. При генетическом исследовании опухолевого материала методом полимеразной цепной реакции (ПЦР) в режиме реального времени выявлена делеция в 19-м экзоне гена EGFR.
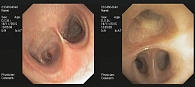
После операции пациентке назначили химиотерапию комбинацией цисплатина, этопозида и золедроновой кислоты. Лечение сопровождалось нежелательными явлениями, такими как тошнота и рвота 2-й степени согласно классификации СТСАЕ, гематологическая токсичность (нейтропения 3-й степени), анемия 1-й степени тяжести. После проведения пяти курсов химиотерапии, в соответствии с критериями RECIST, зафиксированы прогрессирование заболевания с появлением множественных метастазов в паренхиме легких и рецидив роста опухоли в культе промежуточного бронха правого легкого, что было подтверждено морфологическим исследованием, материал для которого был получен при фибробронхоскопии (рис. 1).
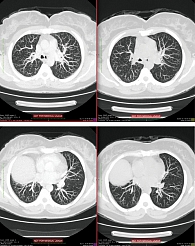
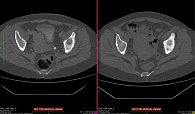
С ноября 2015 г. химиотерапию отменили и назначили терапию афатинибом 40 мг/сут. По окончании четырехмесячной терапии по результатам компьютерной томографии были констатированы полная регрессия метастазов в легких (рис. 2) и склерозирование метастаза в теле подвздошной кости (рис. 3). Клинически отмечалось улучшение общего самочувствия, уменьшение болей при ходьбе. Общий эффект от терапии был расценен как частичная ремиссия. Пациентка отмечала хорошую переносимость проводимой терапии по сравнению с химиотерапией. Нежелательных явлений, связанных с лечением, признаков гематологической и негематологической токсичности не зарегистрировано. Планируется продолжить терапию афатинибом до появления признаков прогрессирования.
Обсуждение
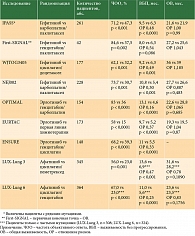
Внедрение в клиническую практику препаратов группы ингибиторов тирозинкиназы EGFR в качестве первой линии терапии (гефитиниб, эрлотиниб, афатиниб) позволило значительно улучшить результаты лечения НМРЛ с мутацией гена EGFR [12]. В таблице представлены данные исследований ингибиторов первого и второго поколения в первой линии терапии пациентов с аденокарциномой легкого IIIB–IV стадий с частыми мутациями гена EGFR. Как видим, в отличие от стандартной химиотерапии на фоне применения афатиниба показатели выживаемости без прогрессирования у пациентов с НМРЛ и частыми мутациями (13,6 месяца по данным независимой оценки) и достижения частоты объективных ответов (60–67%) были лучше [12].
Определение мутаций гена EGFR является обязательным в повседневной клинической практике при выборе метода терапии неплоскоклеточного НМРЛ.
В Иркутском областном онкологическом диспансере диагностика проводится методом ПЦР в режиме реального времени с помощью набора реагентов для определения соматических мутаций в гене EGFR Therascreen® EGFR RGQ PCR Kit (24) (QIAGEN, Германия). Используется сочетание двух технологий – праймеров Scorpions и аллель-специфической ПЦР – ARMS. Этот набор позволяет выявить 29 соматических мутаций в четырех экзонах гена EGFR и обеспечивает качественную оценку мутационного статуса.
В данном случае для анализа использовалась проба ДНК, выделенная из фиксированной в формалине и залитой парафином ткани опухоли легкого. Из парафинового блока изготовлено пять срезов с участка, содержащего более 20% опухолевых клеток. У пациентки выявлена делеция в 19-м экзоне гена EGFR. Данный вид мутации, а также замена в 21-м экзоне (L858R) являются наиболее частыми и составляют 90% обнаруживаемых мутаций [11].
В Иркутском областном онкологическом диспансере исследование мутаций гена EGFR проводится с октября 2013 г., исследовано 226 блоков, выявлено 40 образцов с мутациями, что составляет 17,7%. Основная часть мутаций – делеции в 19-м экзоне – 31 образец, мутации в 21-м экзоне (L858R) – шесть проб. Среди редких мутаций две с инсерциями в 20-м экзоне и одна с мутацией в 18-м экзоне. Наличие делеции в 19-м экзоне предполагает высокую чувствительность к афатинибу, что наглядно проиллюстрировано на примере.
Применение афатиниба увеличивает общий объективный ответ на терапию более чем в два раза по сравнению с платиносодержащей химиотерапией и позволяет существенно продлить выживаемость без прогрессирования [13, 14].
В запланированном подгрупповом анализе исследования LUX-Lung 3 отмечалось увеличение выживаемости без прогрессирования у пациентов с частыми мутациями гена EGFR – 13,6 месяца в группе афатиниба против 6,9 месяца в группе химиотерапии (отношение рисков (ОР) 0,47; p = 0,001).
J.C. Yang и соавт. проанализировали показатели общей выживаемости по данным исследований LUX-Lung 3 и LUX-Lung 6. В запланированном анализе результаты обоих исследований в отдельности показали преимущество общей выживаемости в пользу афатиниба по сравнению с химиотерапией в подгруппе Del19, LUX-Lung 3 (33,3 vs 21,1 месяца; ОР 0,54; p = 0,0015) и LUX-Lung 6 (31,4 vs 1,4 месяца; ОР 0,64; p = 0,0229). В противоположность этому статистические различия между группами отсутствовали у больных с заменой L858R в 21-м экзоне гена EGFR, что также прослеживается при терапии ингибиторами тирозинкиназы первого поколения [12].
В исследовании LUX-Lung 2 показана клиническая эффективность афатиниба у пациентов, ранее получавших химиотерапию. В группе пациентов с Del19, применявших афатиниб во второй линии терапии, медиана выживаемости без прогрессирования составила 13,7 месяца по данным независимой оценки. Медиана общей выживаемости в отдельных случаях достигла 38,7 месяца [15].
Наиболее частыми нежелательными явлениями при терапии афатинибом считаются диарея, сыпь/акне (по сравнению с химиотерапией). Однако такие явления поддаются коррекции сопроводительной терапией, что позволяет продолжать лечение [13, 14]. У данной пациентки на фоне терапии афатинибом токсичности не отмечалось.
Заключение
Терапия необратимым ингибитором тирозинкиназы афатинибом является высокоэффективным методом лечения больных с местнораспространенным метастатическим неплоскоклеточным НМРЛ с подтвержденной делецией в 19-м экзоне гена EGFR. Данная терапия хорошо переносится и приводит к значительному увеличению выживаемости без прогрессирования.
Терапия афатинибом признана стандартным методом лечения НМРЛ с мутацией EGFR у пациентов, ранее не получавших терапию ингибиторами тирозинкиназы.
D.M. Ponomarenko, D.Yu. Yukalchuk, V.G. Bryukhanov, S.S. Shulunov, S.S. Sidorova, Ye.A. Likhova, N.A. Kravchenko
District Oncology Dispensary (Irkutsk)
Contact person: Dmitry Mikhaylovich Ponomarenko, ponomarenkodm@gmail.com
A clinical case of generalized squamous non-small cell lung cancer with EGFR exon 19 deletion was described to analyze treatment approaches.
