Применение Актовегина в комплексной терапии синдрома диабетической стопы у больных сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки


В Сент-Венсенской декларации для стран и правительств мира (1980 г.) определена необходимость дальнейшей разработки методов лечения СДС и снижения частоты высоких ампутаций на 50% (4, 14).
Патогенез развития синдрома диабетической стопы крайне сложен и с учетом возрастных изменений включает в себя типичные для диабета микро- и макроангиопатию, остео- и нейропатию, на фоне которых при присоединении инфекции развиваются гнойно-некротические процессы нижних конечностей, которые требуют оперативного вмешательства. В большинстве случаев центральную роль в развитии СДС играют нейропатия (70-80%), деформация стопы (63%) и ишемии (9, 12). При манифестации диабета уже у 5% пациентов можно выявить признаки полинейропатии (7), а при инструментальных исследованиях частота выявления поражения периферических нервов у больных СД достигает 100% (2, 3, 14).
Сочетание гипергликемии с инсулинорезистентностью оказывает прямое повреждающее действие на сосудистую стенку, способствуя гиперкоагуляции и нарушению функции сосудов, усугубляет состояние микроциркуляции у больных с СДС. Поэтому коррекции гипергликемии должно придаваться первостепенное значение в лечении больных с гнойно-некротическими процессами нижних конечностей (6, 13).
В патогенезе развития диабетической полинейропатии наиболее важную роль играют микроангиопатия и метаболические нарушения, но все же центральным звеном в развитии этого осложнения является окислительный стресс.
Учитывая распространенность поражения магистральных сосудов нижних конечностей у больных с сахарным диабетом II типа, принципы фармакологической коррекции ишемии и тканевой гипоксии выходят на первый план.
Одним из препаратов, активизирующих обмен веществ в тканях, улучшающих трофику тканей и стимулирующих процесс регенерации, является антигипоксант комплексного действия Актовегин. Препарат содержит физиологические компоненты, обладающие высокой биологической активностью: аминокислоты, олигопептиды, нуклеозиды, электролиты. Молекулярная масса органических соединений не превышает 5000 Да. Механизм действия Актовегина заключается в улучшении аэробного обмена за счет повышения поступления и утилизации кислорода и глюкозы тканями. Это ведет к стимуляции образования АТФ, нормализации энергетического метаболизма в условиях его недостаточности, улучшению обмена веществ и функционированию клетки (7). Активные компоненты препарата оказывают также инсулиноподобное действие. Накопленный опыт применения Актовегина у лиц, страдающих СД, свидетельствует, что на фоне лечения происходит снижение потребности в инсулине и существенно замедляется прогрессирование диабетической полинейропатии и ангиопатии. В настоящем исследовании мы поставили своей целью изучить влияние Актовегина на состояние микроциркуляции на стопе и течение раневого процесса у больных с различными формами СДС.
Материалы и методы
В основе данной работы лежит анализ результатов лечения 68 пациентов с различными формами синдрома диабетической стопы, находившихся на стационарном лечении.
Все пациенты обеих групп имели тяжелые формы гнойно-некротических поражений стоп: гангрены пальцев, гнойно-некротические раны, флегмоны и их сочетания, при этом поражения захватывали несколько анатомических образований стопы. Объем оперативных вмешательств, выполненный больным, включал: ампутации пальцев стопы с резекцией плюсневых костей, вскрытие флегмон различной локализации и клеточных пространств стопы и голени, трансметатарзальные резекции стопы.
Проведена оценка эффективности Актовегина на состояние микроциркуляции и течение раневого процесса у этой категории больных. В зависимости от консервативного метода лечения все больные были разделены на две группы: основную группу составил 41 пациент, лечение которых дополнялось введением Актовегина. Продолжительность введения препарата составила 15 суток. Препарат вводился внутривенно капельно 250-500 мл в сутки в виде 10% или 20% раствора внутривенно капельно (общая доза – 2000 мг) в течение 10-15 дней, затем переходили на пероральный прием препарата в дозе 1-2 драже (200-400 мг) 3 раза в сутки в течение 1-1,5 месяцев. Следует отметить, что при применении препарата побочных эффектов не было.
Контрольную группу составили 27 больных со сходными формами СДС и течением сахарного диабета, находившихся в том же отделении в этот период времени. Больные обследованы до начала курса лечения и по его завершении. Консервативное лечение в группах включало также проведение интенсивной инсулинотерапии, антибактериальной терапии, разгрузку пораженной конечности, местные перевязочные средства.
В обеих исследуемых группах преобладали женщины (69,7% в основной группе и 64,7% в контрольной) с длительностью заболевания СД более 10 лет, средний возраст которых колебался в пределах 54,5 ± 7,2 года и 60,3 ± 5,7 лет. При поступлении в стационар у 74,6% пациентов основной и у 52,9% контрольной группы СД отмечена декомпенсация СД, и течение СД расценивалось как тяжелое. Пациенты обеих групп имели сочетание поздних осложнений СД и сопутствующих заболеваний, в основном преобладали: ИБС (71,1% в основной и 55,9% в контрольной группе), постинфарктный кардиосклероз (38,6% в основной и 38,2 в контрольной группах), артериальная гипертония 3 степени (у 49,4% пациентов основной и 23,5% контрольной группы), АГ 4 степени (у 14,5% больных основной и 11,8% контрольной группы). Это свидетельствует о тяжести состояния пациентов и требует коррекции терапии с учетом данных факторов.
Важным в выборе тактики лечения и объема хирургического вмешательства является форма СДС. При проведении исследования выявлено, что в обеих группах преобладали больные с нейропатической формой СДС (44,6% в основной и 44,1% в контрольной группах).
О нарушении уровня микроциркуляции у больных СДС с гнойно-некротическими процессами на стопе судили по изменению уровня ТсрО2.
Измерение транскутанного напряжения кислорода проводилось на аппарате ТСМ 400 (RADIMETER, США), который представляет собой устройство, использующее неинвазивные датчики, размещаемые на коже пациента, и предназначенное для измерения значений парциального давления кислорода у взрослого населения.
Измерение проводилось в положении больного лежа на спине при температуре окружающей среды не более 40ºС и относительной влажности воздуха не более 80% при условии отсутствия проведения больному искусственной газовой вентиляции легких. Не допускается проведение исследования при повышенном содержании кислорода в атмосфере и барокамерах.
Клиническую эффективность проводимого послеоперационного лечения ран у больных с СДС оценивали по следующим параметрам: уменьшению отека в области послеоперационной раны, температурной реакции, гиперемии окружающих тканей, инфильтрации краев раны.
Результаты и обсуждение
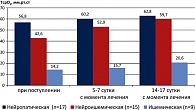
Проведенное исследование показало, что у пациентов с нейропатической формой СДС выявлено незначительное уменьшение показателей кислородного насыщения тканей, которое составило 56,8 ± 4,6 мм рт. ст. в основной и 61,2 ± 4,8 мм рт. ст. в контрольной группах.
У пациентов с ишемической формой СДС при поступлении отмечено резкое снижение уровня насыщения тканей кислородом, который составлял 14,2 ± 0,89 мм рт. ст. в основной и 12,8 ± 1,02 мм рт. ст. в контрольной группе. У больных с нейроишемической формой СДС показатели кислородного насыщения тканей стопы составил 42,6 ± 2,8 мм рт. ст. в основной и 38,4 ± 2,10 мм рт. ст. в контрольной группах.
В среднем на 3-4 сутки от начала приема Актовегина 95% пациентов отмечали уменьшение болевого синдрома в нижних конечностях, объективно выявлено уменьшение отека, локальное потепление конечности, особенно у пациентов нейроишемической и ишемической формой СДС.
Изменения показателя уровня ТсрО2 у больных с различными формами СДС при применении Актовегина представлены на рисунке 1.
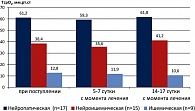
Полученные при исследовании данные свидетельствуют о том, что при применении в послеоперационном периоде Актовегина у больных с нейропатической формой СДС уже на 5-7 сутки отмечается значительное повышение уровня транскутанного напряжения кислорода в тканях стопы (ТсрО2) и составляет 60,2 ± 4,23 мм рт. ст. У больных с нейроишемической формой СДС отмечается более медленный прирост уровня ТсрО2 в тканях стопы по сравнению с показателями больных нейропатической формой СДС (достигает нормальных значений только к 14 суткам с момента лечения). У больных же с ишемической формой СДС, несмотря на проводимое лечение, уровень ТсрО2 остается низким и достигает субкритических значений (20,6 ± 1,6 мм рт. ст.), что свидетельствует о низкой эффективности медикаментозной коррекции ишемии у данной категории больных. Изменения показателя уровня ТсрО2 у больных с различными формами СДС при применении стандартного лечения представлены на рисунке 2.
При исследовании динамики изменения уровня кислородного насыщения тканей у больных, получавших стандартную терапию, выявлено, что показатель ТсрО2 у больных с нейропатической и нейроишемической формой СДС практически не отличался от показателей при поступлении в стационар (и составил 61,2 ± 3,2 и 38,4 ± 2,7 мм рт. ст. соответственно), а показатели у больных с ишемической формой СДС не только не увеличивались, но и имели тенденцию к снижению.
Не вызывает сомнений, что СД играет негативную роль в течении раневого процесса. Многие авторы подчеркивают замедление заживления ран, связанное в первую очередь со снижением активности фагоцитов, торможение формирования соединительной ткани и нарушение иммунного ответа на инфекционный процесс.
Таким образом, изучение особенностей течения раневого процесса является основным из направлений в решении вопроса в лечении больных с гнойно-некротическим процессом синдрома диабетической стопы (ГНСДС).
Хирургическое лечение пациентов, имеющих гнойно-некротические процессы на стопе, носило «сберегательный» характер и было направлено на купирование гнойно-воспалительного процесса и сохранение опорной функции конечности.
Большинство больных было оперировано в первые 3 суток с момента поступления в стационар (59,1% больных основной группы и 58,8% пациентов контрольной группы).
Оперативное вмешательство было произведено у 27 больных, получавших традиционную терапию, и у 41 пациента из исследуемой группы, лечение которых дополнялось введением Актовегина.
В обеих группах основными оперативными вмешательствами были ампутация пальцев (26,9% в основной и 31,7% в контрольной группе), трансметатарзальные резекции стопы (23,2% в основной и 21,9 % в контрольной группе) и некрэктомии (16,3% в основной и 26,8 % в контрольной группе).
Клиническую эффективность проводимого послеоперационного лечения ран у больных с СДС оценивали по следующим параметрам: уменьшению отека в области послеоперационной раны, температурной реакции, гиперемии окружающих тканей, инфильтрации краев раны (таблица 1).
Из данных таблицы 1 следует, что применение в послеоперационном периоде Актовегина способствует вне зависимости от формы СДС более быстрому исчезновению отека стопы (3-9 сутки в основной группе и 6-10 в контрольной группе), уменьшению локальной гиперемии стопы (1-5 сутки в основной и 4-7 сутки в контрольной группе), исчезновению инфильтрации краев раны (4-8 сутки в основной и 6-14 в контрольной группе).
Скорость заживления послеоперационных ран оценивали по срокам развития грануляционной ткани, появления грануляций (таблица 2).
При изучении данных таблицы 2 выявлено, что процессы репарации ран у больных основной группы проходили быстрее. Так, появление грануляционной ткани в ране происходило в зависимости от формы СДС на 3-12 сутки с момента оперативного лечения, у пациентов контрольной группы на 9-19 сутки, начало эпителизации выявлено в основной группе на 8-19 сутки, в контрольной – на 11-23 сутки.
Выводы
Применение Актовегина в комплексном лечении больных с различными формами СДС позволяет достоверно улучшить уровень микроциркуляции по данным ТрсО2.
Хирургическое лечение пациентов с гнойно-некротическими процессами нижних конечностей на фоне сахарного диабета 2 типа совместно с применением Актовегина позволяет стабилизировать течение раневого процесса и нормализовать сроки всех фаз раневого процесса.
Использование раствора Актовегина в клинической практике гнойных хирургических отделений позволяет уменьшить количество выполняемых «высоких» ампутаций.
