Принципы диагностики и лечения диабетической полиневропатии
- Аннотация
- Статья
- Ссылки

![Таблица 2. Стадии диабетической полиневропатии (ДПН) [12]](/upload/resize_cache/iblock/4bc/195_350_1/tiogamma2.jpg)


Классификация диабетической невропатии
Выделяют различные варианты диабетической невропатии, которые отличаются по клинике, патогенезу, гистологическим изменениям, течению, реакции на лечение, прогнозу [2, 30, 32, 34]. Как и другие заболевания периферической нервной системы, диабетические невропатии могут быть условно разделены на:
- фокальные (мононевропатии, радикулопатии, плексопатии);
- множественные, или мультифокальные (множественные невропатии);
- диффузные (полиневропатии) [2].
Полиневропатия – наиболее частая форма поражения периферической нервной системы при СД – характеризуется диффузным поражением нервных волокон, вовлекающим их независимо от того, в состав какого нерва они структурно входят, и проявляющимся относительно симметричной симптоматикой. Особенностью СД является частая комбинация различных форм поражения периферической нервной системы, поэтому выделить «чистые формы» представляется возможным далеко не всегда [2].
По течению диабетические невропатии можно разделить на острые (краниальные и другие мононевропатии, радикулопатии, радикулоплексопатия, острая сенсорная полиневропатия и др.) и хронические (дистальная сенсомоторная и вегетативная полиневропатии, туннельные невропатии и т. д.) (табл. 1) [13, 28, 32]. Первые часто бывают обратимыми, могут развиться на любой стадии диабета, в том числе и на ранней, а их тяжесть плохо коррелирует с уровнем гипергликемии. Они чаще возникают у пациентов с СД 2 типа, особенно у мужчин среднего и пожилого возраста. Вторые наблюдаются более часто и, как правило, возникают у лиц, длительно страдающих СД и имеющих другие его осложнения. Они примерно с одинаковой частотой наблюдаются у пациентов с 1 и 2 его типами, у мужчин и женщин. Их тяжесть в большей степени соответствует уровню и длительности гипергликемии [2, 28]. По распределению симптомов невропатии могут быть разделены на симметричные и асимметричные. По определению только первые могут быть формально отнесены к полиневропатиям, и именно они преимущественно рассматриваются в данной статье.
Факторы риска диабетической полиневропатии
В некоторых случаях полиневропатия предшествует появлению клинических признаков СД, и на момент диагностики СД невропатию можно выявить примерно у 10% больных. Со временем частота диабетической полиневропатии неуклонно возрастает, и спустя 10–20 лет она выявляется примерно у половины больных. Однако частота полиневропатии зависит не только от продолжительности СД, но и от эффективности контроля гипергликемии [32]. При удовлетворительном контроле уровня глюкозы в крови частота невропатии через 15 лет от момента развития заболевания не превышает 10%, тогда как при плохом контроле гликемии увеличивается до 40–50% [29]. С другой стороны, прямая зависимость между тяжестью СД и вероятностью невропатии прослеживается не всегда. Например, тяжелые формы невропатии иногда наблюдаются у лиц с относительно легким диабетом [15].
Вероятность развития невропатии при СД 1 и 2 типов примерно равна, но поскольку диабет 2 типа может длительное время развиваться субклинически, невропатия выявляется у более значительной части больных со вновь диагностированным диабетом 2 типа. Различия между двумя основными формами СД может проявляться и в том, что у больных с СД 1 типа проявления полиневропатии наиболее быстро нарастают в первые 2–3 года заболевания, после чего стабилизируются, тогда как при СД 2 типа тенденция к прогрессированию проявляется в течение всего заболевания. Тем не менее, как показывают проспективные исследования, и при СД 2 типа темп прогрессирования некоторых расстройств бывает неравномерным и может быть более интенсивным в первые годы болезни. В некоторых исследованиях показано, что факторами риска диабетической невропатии являются также висцеральное ожирение, высокий рост, артериальная гипертензия, пожилой возраст, курение, дислипидемия [34].
Патогенез диабетической полиневропатии
Ключевую роль в развитии диабетической полиневропатии играет гипергликемия [1, 2, 34]. Гипергликемия может приводить к повреждению нервной ткани за счет различных механизмов. Возникающая в результате гипергликемии активация полиолового пути через ряд промежуточных этапов приводит к избыточному образованию активных форм кислорода – свободных радикалов, превышающему возможности естественных антиоксидантных систем (окислительный стресс). Чувствительность к окислительному стрессу может повышаться при нарушении продукции энергии в нейронах. Важным фактором поражения нервных волокон может быть также интенсификация неферментативного гликирования белков, что сопровождается быстрым накоплением в клетках токсичных конечных продуктов гликирования (КПГ), которые могут играть важнейшую роль в развитии многих осложнений диабета. Содержание КПГ в нервных волокнах и vasa nervorum у больных с СД 2 типа существенно выше, чем в норме, и, более того, коррелирует с численностью миелинизированных волокон в периферическом нерве. Накопление полиолов, КПГ, интенсификация перекисного окисления липидов могут приводить к дисфункции эндотелия и снижению продукции NO, сопровождающемуся снижением реактивности сосудов и развитием ишемии [15]. Финальным конечным путем развития полиневропатии может быть торможение аксоплазматического транспорта, что в конечном итоге вызывает дистальную аксональную дегенерацию, которая может сопровождаться вторичной демиелинизацией. Помимо чисто метаболических и сосудистых нарушений, в развитии невропатии важную роль играют также наследственные и дизиммунные механизмы [11].
Патоморфологически при диабетической полиневропатии выявляется широкий спектр изменений, включающий аксональную дегенерацию, сегментарную демиелинизацию, ремиелинизацию, атрофию шванновских клеток, регенерацию нервных волокон с явлениями спрутинга. Наряду с вторичной демиелинизацией, при СД возможна и первичная демиелинизация, связанная с нарушением метаболизма шванновских клеток, однако она, по-видимому, не играет решающей роли в развитии и прогрессировании клинической симптоматики [23].
Хроническая дистальная сенсомоторная полиневропатия
Хроническая дистальная сенсомоторная полиневропатия – самая частая форма диабетической невропатии, преимущественно поражающая аксоны нервных волокон, уязвимость которых четко зависит от их длины. Симптоматика начинается с дистальных отделов нижних конечностей, иннервируемых наиболее длинными волокнами, и затем, по мере вовлечения все более коротких волокон, распространяется в проксимальном направлении. Практически облигатно страдает болевая и температурная чувствительность, отражая преимущественное и наиболее раннее вовлечение тонких миелинизированных и немиелинизированных волокон. В связи с этим часто отмечается и развитие вегетативной невропатии, что проявляется, в частности, гипогидрозом и сухостью кожи, вазомоторными нарушениями и снижением температуры на стопах. В меньшей степени и на более позднем этапе страдают крупные миелинизированные волокна, обеспечивающие глубокую чувствительность, и еще в меньшей степени – двигательные волокна. Поэтому слабость и атрофия мышц у большинства больных отсутствуют либо бывают выражены слабо [15]. В клинической картине доминируют нарушения чувствительности в виде ощущений боли, онемения, парестезий в нижних конечностях (ощущение холода, покалывание, жжение), которые могут проявляться спонтанно или при прикосновении. Боль может быть жгучей, режущей, рвущей, пронизывающей, реже – тупой. Часто она отмечается в покое и усиливается в ночное время, нарушая сон. Кожа становится крайне болезненной. В типичных случаях больной не может выносить даже прикосновения шерстяного одеяла, а затем иногда и обычного постельного белья. Причины боли при диабетической полиневропатии во многом остаются неясными. По-видимому, она не связана с регенерацией тонких немиелинизированных волокон. У большинства больных боль имеет тенденцию к спонтанному улучшению в течение нескольких месяцев, но иногда она неуклонно нарастает. Регресс боли может свидетельствовать не только о восстановлении функций, но и о дальнейшем прогрессировании патологического процесса (в последнем случае боль уменьшается на фоне расширения зоны снижения поверхностной чувствительности) [34].
При неврологическом осмотре выявляется снижение болевой и температурной чувствительности в дистальных отделах (по типу «носков» и «перчаток»), снижение вибрационной чувствительности (иногда оно бывает наиболее ранним проявлением полиневропатии), ослабление или отсутствие ахилловых, на более поздней стадии – коленных рефлексов. Двигательные и чувствительные нарушения на руках всегда выражены слабее, чем на ногах. В тяжелых случаях нарушения чувствительности захватывают передние отделы грудной клетки и живота (в форме вертикальной полоски, иногда каплевидно расширяющейся книзу). Из-за снижения чувствительности больные часто не замечают микротравм ног (от тесной обуви, камней и т. д.), что со временем может приводить к развитию на стопах трофических язв. При преимущественном поражении тонких волокон сухожильные рефлексы могут длительное время оставаться сохранными, несмотря на нарушение поверхностной чувствительности. При вовлечении толстых волокон обнаруживаются нарушения вибрационной чувствительности и суставно-мышечного чувства, выпадение сухожильных рефлексов, сенситивная атаксия, возможно похудание мелких мышц стоп и кистей.
В местах давления (например, в области головок плюсневых костей) могут образовываться безболезненные язвы, чему способствуют нарушение кровообращения и трофические нарушения в конечности. В патогенезе язв имеют значение несколько факторов: поражение мелких сосудов, нарушение чувствительности, вегетативная дисфункция, вторичная инфекция. Вследствие атрофии мышц и деформации стопы происходит увеличение площади контакта подошвы с опорой, что повышает риск травм. Мелкие травмы (в том числе связанные с неправильно подобранной обувью) из-за нарушения болевой чувствительности остаются незамеченными, что нередко приводит к инфицированию. У 15% больных на фоне сенсомоторной и вегетативной полиневропатии развивается нейроартропатия Шарко, проявляющаяся прогрессирующей деформацией голеностопного сустава или суставов стопы. В развитии трофических нарушений в костной ткани и нейроартропатии важное значение может иметь усиление кровотока, вызванное раскрытием денервированных артериовенозных шунтов. Невропатические язвы и нейроартропатия приводят к выраженной деформации суставов, вторичному инфицированию с развитием остеомиелита или гангрены (диабетическая стопа) [13]. В соответствии с часто используемой классификацией Dyck и соавт. выделяют 3 стадии полиневропатии (табл. 2). При выявлении симптомов надо помнить, что клиническими критериями диабетической полиневропатии являются снижение ахиллова рефлекса и/или порога восприятия вибрации в области большого пальца стопы, причем снижение должно быть выражено в той степени, которую нельзя объяснить особенностями возраста, пола, роста, веса (например, отсутствие ахиллова рефлекса у лиц 65 лет и старше не считается патологией). Параклиническими (минимальными) критериями диабетической полиневропатии считается изменение хотя бы одного показателя при исследовании нервов при исследовании скорости проведения по двум и более удаленным друг от друга нервам; изменение вариабельности пульса при глубоком дыхании; повышение порога восприятия вибрации, холода или тепловой боли при количественном исследовании чувствительности.
В клинической практике можно использовать упрощенную схему, предусматривающую выделение трех основных стадий диабетической полиневропатии:
- 1‑я стадия соответствует асимптомной (субклинической) полиневропатии, выявляющейся с помощью ЭНМГ, количественного исследования чувствительности и/или вегетативных тестов;
- 2‑я стадия соответствует легко или умеренно клинически выраженной полиневропатии, которую можно выявить при обычном неврологическом осмотре по характерным субъективным проявлениям, выпадению рефлексов, снижению чувствительности и т. д.;
- 3‑я стадия соответствует тяжелой полиневропатии, сопровождающейся развитием выраженного (существенно ограничивающего функциональные возможности, инвалидизирующего) сенсорного или сенсомоторного дефекта, вегетативной недостаточности, тяжелого болевого синдрома и таких осложнений, как трофические язвы, нейроартропатия или диабетическая стопа [2].
Диабетическая вегетативная невропатия
Важное клиническое значение имеет вегетативная невропатия, проявления которой выявляются более чем у половины больных с диабетической невропатией [1, 31]. При диабете 1 типа вегетативная невропатия возникает в среднем через 2 года после начала заболевания, в то время как при первичной диагностике диабета 2 типа ее признаки часто уже присутствуют. Прогрессирование вегетативной невропатии происходит главным образом при недостаточном уровне контроля метаболических нарушений. Основные проявления вегетативной невропатии представлены в табл. 3.
У больных с вегетативной невропатией нарушается способность распознавать гипогликемию, что объясняется исчезновением симпатоадреналовой реакции на гипогликемию вследствие поражения симпатических волокон и денервации мозгового слоя надпочечников. Практикующие врачи часто не уделяют достаточного внимания ее диагностике, между тем наличие вегетативной невропатии – один из важнейших факторов, предопределяющих неблагоприятный прогноз СД, высокий риск инсульта и повышенную смертность (смертность у больных с вегетативной невропатией превышает смертность больных без вегетативной невропатии почти в 5 раз) [5, 24, 32].
Транзиторная гипергликемическая полиневропатия
Транзиторная гипергликемическая полиневропатия – быстро обратимая форма полиневропатии, отмечающаяся у пациентов с недавно диагностированным или плохо контролируемым диабетом. Она возникает на фоне повышения уровня сахара в крови и быстро регрессирует после восстановления эугликемии. Быстрота регресса проявлений полиневропатии свидетельствует о том, что она связана с функциональными и метаболическими, а не со структурными изменениями в периферических нервных волокнах. Является ли транзиторная гипергликемическая полиневропатия предвестником более стойкого поражения периферической нервной системы, остается неясным [2].
Острая сенсорная полиневропатия
Острая сенсорная (болезненная) полиневропатия характеризуется быстро развивающейся спонтанной интенсивной жгучей или сверлящей болью, которая, начинаясь с дистальных отделов нижних конечностей, со временем распространяется на проксимальные, а иногда и все тело. Несмотря на выраженные субъективные проявления, нарушения чувствительности при неврологическом осмотре часто минимальны и скорее представлены гиперестезией и аллодинией, чем гипестезией. Двигательные нарушения наблюдаются редко. Кажущаяся атрофия мышц скорее объясняется кахексией, а ограничение движений чаще обусловлено не мышечной слабостью, а болью. Ахилловы рефлексы могут оставаться сохранными. Эти особенности объясняются преимущественным вовлечением тонких волокон. Острая сенсорная полиневропатия чаще всего развивается у мужчин с длительно протекающим, но не распознанным или плохо контролируемым СД (чаще СД 1 типа). В ряде случаев аналогичная клиническая картина проявляется вскоре после диагностики диабета и начала инсулинотерапии или приема пероральных сахароснижающих средств («инсулиновый неврит»). Полагают, что поражение нервов может быть связано с уменьшением энергетического субстрата в результате резкого снижения содержания глюкозы. Резкие колебания уровня глюкозы в крови могут спровоцировать снижение кровотока по сосудам нервов и ишемию нервных волокон. Полное восстановление после стабилизации уровня сахара в крови происходит в течение 6–24 месяцев, что связывают с завершением регенерации аксонов [2, 13].
Гипогликемическая полиневропатия
Причиной сенсомоторной и вегетативной полиневропатии при СД могут быть также повторные эпизоды тяжелой длительной гипогликемии при неадекватной инсулинотерапии.
Диабетическая радикулоплексопатия
Диабетическая радикулоплексопатия формально не относится к полиневропатии и характеризуется мультифокальным поражением корешков, спинномозговых нервов и сплетений, преимущественно на пояснично-крестцовом уровне [4, 14]. В прошлом она описывалась под разными названиями: «диабетическая амиотрофия», «синдром Брунса-Гарланда», «проксимальная диабетическая невропатия» и т. д. Этот вариант диабетической невропатии чаще всего наблюдается у лиц среднего и пожилого возраста, страдающих СД 2 типа и имеющих относительно легкие нарушения углеводного обмена. Вслед за появлением болевого синдрома в течение нескольких дней или недель развивается слабость и атрофия передних мышц бедра и мускулатуры тазового пояса. Нарушения чувствительности обычно минимальны или отсутствуют. Даже в тяжелых случаях, когда больные на тот или иной срок утрачивают способность к самостоятельному передвижению, прогноз относительно благоприятен. Боль обычно проходит в течение нескольких недель, но иногда сохраняется 6–9 месяцев. Парез и атрофия сохраняются в течение многих месяцев. Иногда восстановление занимает несколько лет, а у части больных сохраняется резидуальный дефект. Развитие данной невропатии связывают, по крайней мере у значительной части больных, с аутоиммунным васкулитом [14].
Диагностика диабетической полиневропатии
Проблема диагностики диабетической полиневропатии включает два аспекта: 1) раннее выявление признаков поражения периферической нервной системы у пациентов с уже установленным диагнозом СД; 2) диагностика СД и установление его этиологической роли у пациента с клинически явной полиневропатией. Раннее выявление и адекватная терапия диабетической полиневропатии может уменьшать риск тяжелых осложнений и повышать качество жизни больных [1, 3, 13]. У всех больных СД, независимо от наличия характерных жалоб, необходим ежегодный скрининг на полиневропатию, который должен включать:
- исследование болевой чувствительности,
- исследование чувствительности с помощью монофиламента,
- исследование вибрационной чувствительности с помощью градуированного камертона.
Выявление снижения чувствительности при исследовании монофиламентом и камертоном не только помогает в ранней диагностике невропатии, но и позволяет выявить пациентов, которым угрожает изъязвление стопы [5].
Для диагностики вегетативной недостаточности проводятся кардиоваскулярные тесты (оценка изменения пульса при глубоком вдохе, после вставания из положения лежа, при пробе Вальсальвы, изменения АД в тесте на сжимание рук и ортостатической пробе). Наиболее чувствительным и простым тестом является исследование дыхательной аритмии: в процессе регистрации ЭКГ больной глубоко вздыхает 6 раз за 1 минуту (продолжительность вдоха и выдоха должна составлять 5 секунд). В норме разница между максимальной (вдох) и минимальной (выдох) частотой сердечных сокращений должна быть не менее 10. С целью скрининга данный тест рекомендуется проводить у больных с СД с интервалом в 1–2 года [2, 5].
Электрофизиологическое исследование редко необходимо в типичных случаях диабетической полиневропатии и обычно проводится при сомнениях в диагнозе. При электронейромиографии (ЭНМГ) могут выявляться признаки, соответствующие как аксонопатии (снижение амплитуды М-ответа), так и демиелинизации (легкое или умеренное снижение скорости проведения по нервам, увеличение дистальной латенции, изменение F-волн). Скорость проведения по моторным и сенсорным нервам может проявляться уже на ранней стадии развития невропатии, но в последующем длительное время остается стабильной, тогда как признаки аксонопатии неуклонно нарастают. Следует учитывать, что легкое снижение скорости проведения по двигательным волокнам может отражать не столько демиелинизацию, сколько значительную утрату крупных аксонов. С другой стороны, выраженные признаки демиелинизации должны побуждать к исключению идиопатической воспалительной невропатии (особенно ХВДП), которая может «накладываться» на течение диабетической невропатии. В пользу ХВДП, требующей активной иммунотерапии (включая применение иммуноглобулина или кортикостероидов), могут также свидетельствовать проксимальные парезы и выраженное повышение уровня белка в ЦСЖ (при диабетической невропатии этот показатель, хотя и бывает повышен, редко достигает 1 г/л). У больных с СД важно исключать и другие возможные причины полиневропатии, связанные с побочным эффектом лекарственных средств, уремией, васкулитами, дефицитом витамина В12, парапротеинемией и т. д. [2, 4, 13, 15, 26]. Диабетическая полиневропатия часто сопровождается ретинопатией и нефропатией, выявление которых дополнительно указывает на СД как причину полиневропатии.
Принципы терапии диабетической невропатии
Поскольку гипергликемия – основной патогенетический фактор развития диабетической невропатии, то оптимизация уровня сахара в крови – основное условие стабилизации и регресса проявлений диабетической невропатии, а также ее профилактики. Наилучшим показателем, на который следует ориентироваться при проведении лечения СД, является уровень гликозилированного гемоглобина HbA1c, который должен быть менее 7% [5, 13, 32]. Гипергликемия может снижать болевой порог и уменьшать эффект анальгетиков, поэтому нормализация содержания глюкозы в крови может привести к существенному уменьшению боли. С другой стороны, важно избежать выраженных колебаний уровня сахара в крови, которые сами по себе оказывают повреждающее действие на нервные волокна.
Связь между улучшением контроля гипергликемии и более благоприятным течением полиневропатии особенно четко выявляется у пациентов с диабетом 1 типа, в то же время у пациентов с диабетом 2 типа ситуация менее определенная. В нескольких исследованиях не удалось показать, что более интенсивная терапия диабета 2 типа замедляет прогрессирование полиневропатии. Возможно, что достижению положительного результата противодействует инерция ранее запущенного патологического процесса, связанная с механизмами «метаболической памяти» [8, 10]. Таким образом, необходимая оптимизация контроля над гипергликемией не решает всех проблем. В связи с этим сохраняется потребность в лекарственных средствах, воздействующих на различные звенья патогенеза диабетической невропатии. Для лечения диабетической невропатии в различные годы были предложены различные средства нейрометаболического действия, однако в клинической практике наиболее широкое распространение получили препараты альфа-липоевой кислоты и бенфотиамин.
Механизм действия бенфотиамина (жирорастворимой формы витамина В1) при диабетической невропатии связан прежде всего с его способностью тормозить гликолиз, образование лактата и конечных продуктов гликирования, ослабляя тем самым токсический эффект гипергликемии. С другой стороны, за счет активации транскетолазы блокируются основные пути гипергликемического повреждения эндотелия, что приводит к улучшению микроциркуляции. Наиболее рационально применение жирорастворимых производных тиамина, обладающих более высокой биодоступностью и лучше проникающих через гематоневральный барьер. Их эффективность подтверждена в ряде плацебоконтролируемых исследований [7, 27]. Наиболее оптимальной суточной терапевтической дозой бенфотиамина считается 300 мг. Препарат из Германии Мильгамма® композитум содержит по 100 мг бенфотиамина и пиридоксина. Отличительной особенностью этого нейротропного комплекса является отсутствие цианкобаламина, поскольку длительный прием витамина В12 может вызвать чрезмерную стимуляцию красного ростка костного мозга и как следствие – его истощение. Форма драже имеет существенные преимущества по сравнению с традиционной таблетированной формой выпуска: благодаря послойной методике нанесения действующих веществ бенфотиамин и пиридоксин в Мильгамме® композитум не взаимодействуют между собой. Оптимальный курс лечения составляет 6–8 недель 2 раза в год. Применение альфа-липоевой кислоты при диабетической невропатии подробно рассмотрено ниже.
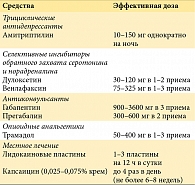
Исследования патогенеза позволили предположить, что применение ингибиторов альдоредуктазы, протеинкиназы, ангио-тензин-превращающего фермента и нейротрофические средства также могут сдерживать развитие диабетической полиневропатии, однако в клинических испытаниях подтвердить их эффективность пока не удалось [32]. При диабетической радикулоплексопатии средствами выбора являются кортикостероиды или иммуноглобулин, которые позволяют добиться более быстрого регресса неврологического дефицита [14]. Применение плазмафереза у пациентов с выраженным вегетативной невропатией может быть опасным в виду риска нарушений гемодинамики. Важное значение имеют также симптоматическая терапия болевого синдрома: медикаментозная (табл. 4) и немедикаментозная (лечебная гимнастика, рефлексотерапия, бальнеотерапия, магнитотерапия, чрескожная электронейростимуляция, электростимуляция спинного мозга), лечение вегетативной недостаточности (табл. 5) и правильный уход за стопами [2, 3, 24].
Применение тиоктовой (альфа-липоевой кислоты) при диабетической полиневропатии
Тиоктовая кислота состоит из липоамидной группы пирувата и альфа-кетоацидодегидрогеназ-ного комплекса и является естественным кофактором пируватдегидрогеназного комплекса, который связывает ацильные группы и переносит их от одной части комплекса в другую. Механизм лечебного действия тиоктовой кислоты объясняют прежде всего ее антиоксидантным эффектом – способностью инактивировать свободные радикалы (гидроксильный, супероксидный, пероксильный) и повышать активность антиоксидантных систем организма, восстанавливая внутриклеточный уровень глутатиона и витамина Е [7, 17, 38]. При СД в результате гипергликемии и активации альтернативных метаболических путей происходит накопление свободных радикалов и развитие (при недостаточности антиоксидантной защиты клетки) окислительного стресса, что приводит к торможению активности NO-синтетазы и блокированию NO-зависимой вазодилатации. В результате происходит повышение тонуса сосудов, уменьшается кровоток в эндоневрии, что вызывает ишемию нервной ткани и еще сильнее снижает выработку NO, замыкая порочный круг [38].
Противодействуя окислительному стрессу, тиоктовая кислота пре-дупреждает ингибирование активности NO-синтетазы и усиливает кровоток в эндоневрии, улучшает микроциркуляцию, снижая риск ишемического поражения нервной ткани и увеличивая скорость проведения импульса по нерву [18]. На экспериментальной модели диабетической невропатии тиоктовая кислота способствует нормализации активности эндоневральной Na+-K+-ATФазы. Экспериментальные данные позволяют предположить и возможность нейротрофического действия тиоктовой кислоты, заключающегося в стимуляции продукции фактора роста и регенерации аксонов, нормализации аксонального транспорта. Кроме того, отмечено, что тиоктовая кислота способствует утилизации глюкозы, повышению активности полиольного пути, повышает активность цикла Кребса, позволяет преодолеть периферическую резистентность к инсулину и может снижать необходимую для данного пациента дозу инсулина и оральных гипогликемических препаратов [15, 22].
Эффективность тиоктовой кислоты при диабетической полиневропатии подтверждена в нескольких рандомизированных двойных слепых плацебоконтролируемых испытаниях. В исследовании ALADIN (Аlfa-Lipoic Acid in Diabetic Neuropathy) показано, что у больных с СД 2 типа с полиневропатией внутривенные инфузии тиоктовой кислоты в течение 3 недель приводят к ослаблению боли и улучшению температурной и вибрационной чувствительности [25]. Доза тиоктовой кислоты 600 мг/сут не уступала по эффективности более высокой дозе (1200 мг/сут), но реже вызывала побочные эффекты со стороны желудочно-кишечного тракта [25]. В исследовании SYDNEY (SYmptomatic Diabetic NEuropathY trial) было показано, что 3‑недельный курс в/в введения тиоктовой кислоты уменьшает позитивные сенсорные симптомы и другие клинические проявления полиневропатии и улучшает электрофизиологические показатели проводимости нервов [6].
В исследованиях ORPIL и ALADIN III было показано, что терапевтический эффект и улучшение показателей проводимости нервных волокон могут быть получены и при длительном назначении тиоктовой кислоты внутрь [35]. Исследование SYDNEY 2 показало, что оптимальной для приема внутрь является доза 600 мг один раз в день. При приеме препарата в дозе 1200 и 1800 мг клинический эффект наступал быстрее, но значительно чаще возникали побочные эффекты [37].
В исследовании ISLAND на фоне приема 300 мг тиоктовой кислоты в качестве монотерапии и в комбинации с блокатором ангиотензиновых рецепторов имбесартаном отмечено увеличение эндотелий-зависимой вазодилатации плечевой артерии на 44% и 75% соответственно в сравнении с плацебо. Этот эффект сопровождался уменьшением уровня в плазме интерлейкина-6 и активатора плазминогена-1, что указывает на уменьшение эндотелиальной дисфункции через противовоспалительные и антитромботические механизмы. В исследовании DEKAN (Deutsche Kardiale Autonome Neuropathie) было показано, что прием тиоктовой кислоты больными с СД 2 типа в течение 4 месяцев приводит и к ослаблению проявлений вегетативной недостаточности [38, 39].
Метаанализ исследований, включавших в общей сложности 1258 пациентов, показал, что препарат способствует уменьшению как субъективных, так и объективных проявлений невропатии, уменьшает болевой синдром, улучшает чувствительность, что подтверждается данными электрофизиологических исследований. Кроме того, они свидетельствуют о хорошей переносимости и безопасности тиоктовой кислоты как при парентеральном введении, так и при приеме внутрь [34].
В настоящее время выпускаются несколько препаратов, содержащих различные соли тиоктовой кислоты (этилендиаминовую, трометамоловую, меглюминовую). При введении меглюминовой соли тиоктовой кислоты частота побочных эффектов ниже, чем при инфузии других солей тиоктовой кислоты. В России существует единственный препарат немецкого производства, который имеет в своем составе меглюминовую соль тиоктовой кислоты, – препарат Тиогамма® (Верваг Фарма Гмбх и Ко, Германия). В настоящее время Тиогамма® выпускается в форме флаконов по 50 мл, содержащих необходимую дозу препарата (600 мг) в разведенном виде, что значительно упрощает процедуру его введения. К флаконам прилагаются светозащитные футляры из черного полиэтилена, предохраняющие препарат от воздействия света. По окончании курса в/в инфузий препарат Тиогамма® назначают внутрь по 600 мг/сут (1 таблетка) или из расчета 10–15 мг/кг/сут. Эту дозу назначают один раз в день натощак, обычно за 30–45 минут до завтрака. При положительном эффекте лечение проводят повторными курсами по 3 месяца.
Следует иметь в виду, что тиоктовая кислота – фоточувствительное соединение, поэтому разведенный препарат должен быть защищен от света в процессе инфузии.
При выраженных симптомах полиневропатии препарат Тиогамма® первоначально назначают в/в в дозе 600 мг ежедневно или 5 раз в неделю на курс 10–20 инфузий.
