Рациональная фармакотерапия приступа мигрени
- Аннотация
- Статья
- Ссылки


Результаты многочисленных рандомизированных контролируемых исследований (РКИ), проводимых в последние 18 лет, показывают высокую эффективность и безопасность использования триптанов. Между тем в клинической практике примерно у ⅓ пациентов с мигренью применение триптанов характеризуются либо незначительной эффективностью, либо полным отсутствием эффекта. Существующее множество причин расхождений результатов РКИ и выводов клинических наблюдений относительно эффективности триптанов как класса требует более углубленного анализа.
Мигрень – хроническое заболевание нервной системы, которое характеризуется значительной вариабельностью тяжести приступов. При этом около 80% больных переносят тяжелые приступы мигрени и нуждаются в медицинской помощи (28). Масштабное эпидемиологическое исследование American Migraine Study показало, что 68% женщин и 57% мужчин с мигренью хотя бы раз обращались за помощью к врачам по поводу головной боли (17). Эта категория пациентов характеризуется более высокой частотой и тяжестью приступов по сравнению с теми, кто никогда не обращался за медицинской помощью. Между тем среди тех, кто хотя бы раз обращался за помощью, только 20% пациентов приходят на повторные визиты к врачам в течение года. Сходные данные получены и в других странах. Большое (4689 чел.) популяционное исследование FRAMIG (Medical and therapeutic management of MIGraine in FRAnce) (19), выявило, что только 18% больных с мигренью наблюдалось у врачей по поводу головной боли. Аналогичными были результаты эпидемиологического исследования, проведенного в Латинской Америке (22), которое показало, что 42% пациентов с впервые выявленным диагнозом мигрени когда-либо обращались за помощью к врачам по этому поводу: уровень обращаемости колебался от 36% в Эквадоре до 49% в Колумбии. Проспективное эпидемиологическое исследование, проведенное в Великобритании, выявило, что среди больных с мигренью количество консультаций составило 6,4/100 пациентов/год у женщин и 2,5 – у мужчин. Менее 20% больных приходят к специалистам повторно, среди которых 55% пациентов обращаются к неврологам и 30% – к врачам общей практики (14).
В России проведен интернет-опрос 1000 человек с целью оценки распространенности головных болей и обращаемости пациентов к различным специалистам (1). Среди опрошенных 52,2% отмечали периодические головные боли на протяжении нескольких лет. Из них 50,4% уже обращались к врачу по поводу головной боли, 18,5% собираются обратиться, а 31,3% – не собираются. Среди причин необращения к специалистам респонденты отмечают: недоверие врачам (81,6%), недоступность специалистов по головной боли (59,7%), отсутствие необходимости в консультации (47,4%), боязнь выявления тяжелого заболевания (19,2%). Проведенное скрининговое исследование позволяет говорить, что около трети пациентов не обращаются к врачу по поводу головной боли. Эпидемиологические данные в целом показывают, что основным барьером эффективной помощи больным является не только низкий уровень первичной обращаемости, но и недостаточный уровень последующего наблюдения за пациентами.
Хорошо известно, что большинство пациентов с мигренью вынуждены прибегать к лекарственным препаратам для облегчения боли (4), чаще используя более чем одно лекарственное средство. Результаты исследований American Migraine Study I и II демонстрируют, что около 97% пациентов с мигренью нуждаются в использовании фармакологических средств для купирования приступа мигрени. Количество пациентов, которые используют рецептурные средства, составляет менее половины, а доля тех, кто вынужден прибегать к использованию безрецептурных симптоматических средств, является весьма высокой (57-59%) (17). Проведенное в США большое популяционное исследование AMPP (American Migraine Prevalence and Prevention study) (8), которое включило 120000 человек общей популяции, выявило, что почти все пациенты с мигренью применяют средства для купирования головной боли. При этом около половины используют исключительно безрецептурные аналгетики, а 20% используют только рецептурные средства, но не при всех приступах, и только 12% пациентов с мигренью используют для купирования приступа специфические антимигренозные средства. Большинство пациентов используют симптоматические и превентивные средства только в случаях тяжелых приступов головной боли и при наличии типичных мигренозных симптомов (односторонняя пульсирующая боль, ассоциированные симптомы фото-, фонофобии, тошноты и рвоты).
Несмотря на многообразие применяемых обезболивающих средств, большинство пациентов с мигренью испытывают неудовлетворенность ими. В США только 29% пациентов оценивают используемое ими симптоматическое средство как эффективное (15). Несмотря на то что в последние годы в целом отмечается тенденция к улучшению уровня диагностики и выявления пациентов с мигренью, это, к сожалению, не отражается на увеличении использования рецептурных средств лечения мигрени (8). Существует несколько систематических обзоров, посвященных изучению предпочтений пациентов и требований к эффективному средству для лечения мигрени. Так, телефонное интервью, проведенное в США среди 688 больных с мигренью (16), показало, что более 70% пациентов не удовлетворены применяемым средством для купирования головной боли. Наиболее частыми причинами низкой эффективности препарата пациенты считали: слишком длительное время начала действия препарата (87%), неполный обезболивающий эффект (84%), непостоянный эффект (84%), возврат головной боли (71%), множество побочных эффектов (35%).
Выбор оптимального средства для облегчения мигренозной боли является непростым для каждого пациента с мигренью. Традиционно лечение приступа мигрени может подразделяться на неспецифическое и специфическое (таблица 1). Неспецифическая терапия подразумевает использование средств, которые применяются для лечения болевых синдромов различной локализации, и включает несколько классов препаратов: простые аналгетики, комбинированные аналгетики (в комбинации с кофеином, буталбиталом, короткодействующими барбитуратами), нестероидные противовоспалительные средства (НПВП), опиоиды, а также препараты для купирования сопровождающих симптомов. К специфическим антимигренозным средствам относят препараты эрготамина и селективные агонисты 5-НТB/D-рецепторов (триптаны), которые используются почти исключительно для лечения мигрени.
Выбор между специфическими и неспецифическими антимигренозными средствами может зависеть от характеристик мигренозных атак; не все атаки у одного и того же пациента могут потребовать одних и тех же средств. Так, легкие и иногда умеренные по тяжести атаки могут лечиться аспирином или другими НПВП, при необходимости в комбинации с препаратами, которые улучшают их абсорбцию, такими как метоклопрамид. Триптаны рекомендуются как препараты первой линии для умеренной и сильной головной боли при мигрени или любой выраженности головной боли, когда неспецифические средства не обеспечивают адекватное облегчение (26).
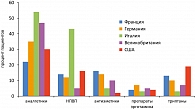
Несмотря на то что к настоящему времени специфическое лечение мигрени активно развивается и появилось много новых препаратов, их применение в клинической практике остается крайне низким. Так, в большом популяционном исследовании GRIM 2000 (Group de Researche Interdisciplinare sur la Migraine) (18), включавшем 25000 человек, было показано, что только 7,5% пациентов хотя бы раз использовали для купирования мигрени триптаны. При этом анализ этой группы пациентов показал, что именно у них имелись более тяжелые и продолжительные приступы, с более высоким уровнем дезадаптации (по данным MIDAS) и большим количеством сопровождающих симптомов. Схожие результаты получены и в другом эпидемиологическом исследовании FRAMIG 2000 (19) во Франции, где только 8% пациентов с мигренью использовали триптаны, а подавляющее большинство пациентов использовали неспецифические анальгетические препараты. И наконец, в исследовании MAZE (Migraine and Zolmitriptan Evaluation survey) (20), которое проводилось в нескольких европейских странах (Франция, Германия, Италия, Великобритании) и США, выявлено, что среди больных с мигренью 3-13% применяют триптаны в Европейских странах и 19% – в США (рисунок 1).
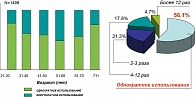
Практический опыт использования специфических антимигренозных средств, накопленный за последние 18 лет, свидетельствует о высокой эффективности и безопасности триптанов. Между тем приверженность пациентов к частому их использованию остается достаточно низкой. G. Ifergane с соавт. (13) провели ретроспективный анализ 1498 пациентов в Израиле. Более половины (56,1%) пациентов, попробовавших однажды триптан для купирования приступа мигрени, к нему повторно не возвращались. Только 4,7% пациентов использовали триптан более 12 раз (рисунок 2). Среди причин отказа от их использования пациенты чаще отмечали: недостаточный обезболивающий эффект, побочные эффекты и частый возврат головной боли даже после эффективного купирования приступа. Авторы считают, что основным препятствием к достижению максимальной эффективности применяемого средства является неправильное его использование (неадекватная доза, позднее применение в приступе, применение при немигренозной боли) и указывают на важность обучения пациентов основным принципам использования специфических антимигренозных средств.
Специфическое лечение приступов мигрени
Открытие специфических антимигренозных препаратов связано с распространенными в Средние века случаями эрготизма, обусловленными массовыми отравлениями мукой, загрязненной грибком Claviceps purpurea (спорынья пурпурная). В 1917-м A. Stoll выделил кристаллический эрготамин (алкалоид спорыньи), который начали использовать для лечения мигрени. В последующем классические работы J. Graham и H.G. Wolff в 1938 году продемонстрировали, что внутривенное введение эрготамина вызывает значительную констрикцию расширенных ветвей наружной сонной артерии во время мигренозной головной боли, что полностью купирует приступ мигрени (12).
Алкалоиды спорыньи имеют комплексные механизмы действия, которые связаны с их взаимодействием с различными типами рецепторов. Эрготамин в низких терапевтических концентрациях действует как агонист α-адренорецепторов, серотониновых рецепторов (особенно 5-НТ1B/1D) и дофаминовых D2-рецепторов. Эрготамин и дигидроэрготамин ингибируют феномен плазменной экстравазации в твердой мозговой оболочке при стимуляции тригеминального ганглия, что связывают со способностью блокировать высвобождение нейропептидов из периваскулярных нервных терминалей (11). Спектр побочных эффектов препаратов эрготамина обусловлен его полисистемным действием, так как эрготамин и дигидроэрготамин обладают аффинитетом к дофаминовым рецепторам (D1, D2), адренергическим рецепторам (α1, α2, β1, β2) и серотониновым рецепторам разных классов. Среди побочных эффектов наиболее значимыми являются тошнота, рвота, боль в животе, акропарестезии, крампи, тремор, диарея, синкопы. Учитывая системные влияния препаратов эрготамина на коронарные сосуды и периферические сосуды, они противопоказаны пациентам с ишемической болезнью сердца, неконтролируемой артериальной гипертензией, а также при беременности и лактации.
Триптаны принадлежат к классу селективных агонистов 5-НТ1B/1D рецепторов, которые не обладают (или обладают слабым) аффинитетом к другим классам серотониновых рецепторов. Эти средства имеют преимущество над всеми остальными симптоматическими средствами лечения мигрени, поскольку их создание основывалось на знании специфических механизмов мигренозной боли. Они синтезировались исключительно с этой целью и, соответственно, носят название специфических антимигренозных средств. Создание этого класса препаратов базировалось на идее синтеза агентов, имитирующих действие серотонина на рецепторы церебральных сосудов. В патофизиологии мигрени роли серотонина принадлежит особое место. Именно изучение серотонинергических механизмов мигрени инициировало серию нейрофармакологических исследований сравнительного анализа различных антагонистов серотонина. В экспериментальных исследованиях было показано, что инъекции метисергида вызывают констрикцию сосудов каротидного артериального бассейна, что в отличие от эффектов эрготамина не сопровождалось повышением артериального давления. Это позволило доказать, что метисергид селективно влияет на кровообращение в каротидном бассейне. Предположения, что метисергид действует селективно на каротидные рецепторы посредством неизвестных до этого специфических серотониновых рецепторов, инициировали серию экспериментов по синтезу аналогов триптамина, которые могут избирательно активировать эти специфические серотониновые рецепторы. Последовательная серия исследований дериватов триптамина, которые обладали эффектом селективного влияния на кровоток в артериовенозных анастомозах каротидного сосудистого русла, привела к созданию первого препарата этого класса – суматриптана (25). Эти работы явились революцией в лечении приступа мигрени и стали основанием для создания целого класса фармакологических средств со свойствами агонистов определенных подтипов серотониновых рецепторов – триптанов. В последующем на основании фармакологических эффектов суматриптана с целью улучшения липофильных свойств и способности проникать через гематоэнцефалический барьер синтезировались триптаны второго поколения. К триптанам второго поколения относятся: золмитриптан, наратриптан, ризатриптан, элетриптан, алмотриптан, фроватриптан.
Механизмы антимигренозной активности триптанов
Суматриптан является селективным агонистом 5-НТ1-рецепторов и в отличие от других дериватов триптамина не взаимодействует с 5-НТ2 – 5-НТ7-типами рецепторов и более того, внутри класса 5-НТ1 он активен в отношении только 1B/1D-подтипов рецепторов. Суматриптан сужает расширенные интракраниальные сосуды так же как серотонин, при этом он не сужает кровеносные сосуды нижних конечностей, кишечника и сердца, и это связано с тем, что последние содержат преимущественно 5-НТ2, но не 5-НТ1-рецепторы (11). Его клиническую эффективность связывают не только со способностью сужать расширенные краниальные сосуды, но и/или блокировать высвобождение кальцитонин-генродственного пептида (КГРП) и субстанции Р (SP) из тригеминальных окончаний в стенках церебральных сосудов (25). Механизмы, лежащие в основе внутриклеточных процессов, ответственных за краниальную селективность действия триптанов, до конца не ясны. Это может быть связано с существенным доминированием 5-НТ1 В-рецепторов над 5-НТ2-подтипом рецепторов в краниальных сосудах по сравнению с периферическими. Однако могут иметь значение и различия между краниальным и периферическим руслом в эффективности 5-НТ-рецепторного связывания.
Блокада высвобождения КГРП и SP из тригеминоваскулярных афферентов должна предотвращать активацию вазодилатации и блокировать развитие сосудистой боли. Экспериментальные исследования подтвердили участие в этих эффектах 5-НТ1 B-рецепторов гладкомышечных элементов, которые обусловливают вазоконстрикторное действие, и пресинаптических 5-НТ1 D-рецепторов и, возможно, 5-НТ1 F-рецепторов тригеминовскулярных афферентов, которые блокируют развитие нейрогенного воспаления. У человека эти подтипы 5-НТ1-рецепторов присутствуют в стволовых структурах, осуществляющих центральную болевую трансмиссию, а также в различных отделах коры головного мозга (25). В экспериментальных исследованиях на животных моделях продемонстрировано, что введение суматриптана у крыс сопровождается снижением синтеза серотонина в дорзальном ядре шва варолиева моста и некоторых других структурах ЦНС, в том числе в гипоталамусе, таламусе, церебральной коре. Влияние суматриптана на синтез серотонина может рассматриваться как дополнительный эффект триптанов в лечении острой мигренозной боли. Примечательно, что хроническое применение суматриптана сопровождается увеличением синтеза серотонина в различных областях мозга, но без существенного влияния на этот процесс в дорзальном ядре шва. Эти исследования предполагают, что хроническое использование триптанов, как это наблюдается при формировании медикаментозно-индуцированной головной боли, в результате вызывает десенситизацию 5-НТ1-рецепторов. Такой эффект может приводить к нарушению механизма обратной связи и нарушению контроля синтеза серотонина (25).
Многие триптаны обладают эффектом ингибиции активности тригеминальной системы, что выражается в подавлении электрической активности каудального ядра тройничного нерва при стимуляции верхнего сагиттального синуса в эксперименте. Этот эффект может быть связан с активацией нисходящих систем, модулирующих боль в околоводопроводном сером веществе. Центральные эффекты суматриптана показаны и в других экспериментальных работах. Так, R. Burstein с соавт. (5) в экспериментах с моделированием нейрогенного воспаления и центральной сенситизации с помощью аппликаций «воспалительного коктейля», содержащего гистамин, серотонин, брадикинин и простагландин Е2, на твердую мозговую оболочку крыс показали повышение чувствительности тригеминального ганглия к механическим стимулам. Раннее применение суматриптана эффективно блокировало развитие всех компонентов центральной сенситизации, а более позднее применение его имело ограниченный эффект. Подобная временная закономерность эффектов свойственна всем триптанам и определяет необходимость их приема в самом начале приступа мигрени.
Клиническая эффективность триптанов
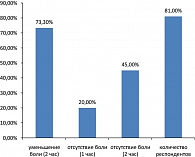
Для сопоставления эффективности различных представителей агонистов 5-НТ1B/1D-рецепторов принято использование стандартных показателей эффективности. Показатель «облегчения боли через 2 часа» отражает процент пациентов, у которых в ответ на прием препарата мигренозная боль уменьшилась от умеренной или тяжелой на момент начала терапии до слабой или до полного отсутствия боли через 2 часа. Показатель «полного обезболивающего эффекта через 2 часа» отражает определенный процент пациентов с полным отсутствием боли через 2 часа от момента приема препарата. У некоторых пациентов даже после эффективного купирования боли может возникнуть рецидив болевых ощущений в рамках одного приступа, что может потребовать дополнительного обезболивания. Поэтому показатель длительности обезболивания является наиболее важным. Показатель «длительности обезболивающего эффекта» отражает процент пациентов с отсутствием боли в течение 24 часов от момента приема препарата. Этот параметр крайне важен и с точки зрения купирования сопровождающих симптомов. Показатель «постоянство эффекта» означает эффективное купирование более чем в одном приступе мигрени. Дополнительным является показатель «постоянства обезболивающего эффекта с отсутствием побочных эффектов», как наиболее «идеальный» параметр эффективности. Унификация оценки эффективности различных 5-НТ1B/1D-рецепторов важна с точки зрения сопоставления эффектов отдельных симптоматических средств между собой. Суматриптан, как первый представитель этого класса препаратов, является «золотым стандартом» антимигренозной терапии и большинство сравнительных исследований для последующих представителей триптанов посвящено сопоставлению изучаемых эффектов с терапевтическим действием суматриптана. Показатель обезболивающего эффекта через 2 часа после приема суматриптана при пероральном приеме 100 мг составляет 22-34%, для назального спрея 10 мг – 47-61% и для подкожного введения 6 мг – 52-56% (26). Суматриптан является эффективным средством и с точки зрения предотвращения возврата головной боли в том же приступе мигрени, что на 34% превышает эффект плацебо.
В течение последних 18 лет проведено большое количество клинических исследований эффективности и безопасности триптанов с участием сотен тысяч пациентов, у которых анализировалось несколько миллионов мигренозных приступов. Применение триптанов в целом позволяет эффективно купировать 2 из 3 мигренозных атак. Сопоставление клинических эффектов триптанов второго поколения с суматриптаном характеризуется целым рядом особенностей, обусловленных фармакокинетическими свойствами каждого препарата. Эти особенности в ряде случаев касаются количества респондентов, быстроты обезболивающего эффекта или его длительности, эффективности купирования сопровождающих симптомов и стойкости эффекта. Последний показатель является одним из наиболее важных и отражает способность триптана обеспечить максимальный контроль над рецидивирующими приступами мигрени. R.M. Callagner и соавт. в 2000 г. (7) провели большое (1445 пациентов) сравнительное исследование, в котором в течение 6 месяцев оценивалась эффективность купирования 6 последовательных приступов мигрени золмитриптаном (2,5 мг и 5 мг) и суматриптаном (25 мг и 50 мг) (7). Сравнительный анализ показал преимущества золмитриптана по показателям регресса боли через 1, 4 и 24 часа (таблица 2).
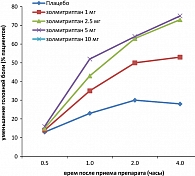
Одной из самых частых причин отказа пациентов от использования определенного препарата для купирования мигренозных приступов является неадекватное его дозирование. Например, эффективными для купирования мигрени считаются 800 мг ибупрофена, 550-750 мг напроксена. То же самое относится и к триптанам: например, 25 мг суматриптана при пероральном приеме или 5 мг ризатриптана не являются адекватной дозой для подавляющего большинства больных в большинстве приступов мигрени, когда требуются дозы 50-100 мг и 10 мг соответственно. Этот принцип основан на клинических исследованиях сопоставления эффективности разных доз триптанов. Примером могут служить результаты исследования эффективности и безопасности различных доз золмитриптана у 1444 больных с мигренью (24). Сопоставление эффективности купирования 3 последовательных приступов мигрени различными дозами золмитриптана (1 мг, 2,5 мг, 5 мг и 10 мг) с плацебо выявило, что в течение часа после приема препарата достоверное отличие по показателю уменьшению головной боли отмечалось в группах больных, принимающих 2,5 мг, 5 мг и 10 мг золмитриптана. Поэтому доза 1 мг не считается адекватной для купирования мигренозной боли (рисунок 3).
В клинической практике обезболивающее средство, как правило, принимается тогда, когда боль развивается и прогрессирует до высокой интенсивности. Это связано и с тем фактом, что в стандартные рекомендации пациентам входят советы: «Прежде чем приступить к купированию, особенно специфическими антимигренозными средствами, необходимо убедиться, что данный приступ является мигренозной головной болью». Между тем многочисленные исследования показывают преимущества более раннего применения триптанов в купировании приступов (5, 9). С патофизиологической точки зрения раннее применение триптана до развития центральной сенситизации и аллодинии обеспечивает более полный обезболивающий эффект и меньшую вероятность рецидива боли в данном приступе мигрени (5). Более позднее применение средства, когда есть признаки развития аллодинии, сопровождается менее удовлетворительным терапевтическим ответом. Большинство используемых триптанов обладают способностью влиять на различные сопровождающие симптомы, такие как тошнота, рвота, фото-, фоно и осмофобия. Раннее применение триптанов в мигренозном приступе также влияет на более эффективное купирование и большинства ассоциированных симптомов. К тому же тошнота и рвота, развивающиеся по мере прогрессирования атаки, затрудняют применение пероральных препаратов (27). Раннее применение купирующего средства важно и с этой точки зрения.
Триптаны в целом отличаются хорошей переносимостью, и все побочные эффекты носят обратимый характер. Среди редких нежелательных явлений следует обратить внимание на так называемые триптановые сенсации (боль в груди, в горле, покалывание во всем теле), которые могут вызвать тревогу у пациентов. Их возникновение также можно контролировать применением оптимальных доз. Например, изучение соотношения эффективности и безопасности применения различных доз золмитриптана продемонстрировало, что группа пациентов, принимавших 2,5 мг препарата, характеризовалась максимальной разницей между высоким процентом больных с купированием боли и низким процентом – с появлением побочных эффектов (24).
Несмотря на то что все триптаны обладают аффинитетом к 5-НТ1B/1D-рецепторам, они имеют различия фармакокинетических параметров. Различия фармакокинетических свойств разных триптанов имеет клиническое значение, поскольку отмечено, что отсутствие эффективности одного триптана в купировании приступов мигрени не означает, что будут неэффективными и другие. В соответствии с данными многочисленных РКИ максимальный терапевтический эффект пероральных триптанов в терминах облегчения боли через 2 часа достигается примерно у 70% пациентов. Примерно 30% пациентов не отвечает на определенный триптан. Это может быть связано с рядом причин: низкий или непостоянный уровень абсорбции препарата, использование препарата слишком поздно при прогрессировании боли в приступе мигрени, неадекватное дозирование препарата или крайняя вариабельность терапевтических ответов у конкретного пациента. Между тем данные РКИ, полученные в последние годы, подтверждают наблюдения из клинической практики о том, что пациенты с плохим ответом на один триптан могут в последующем получить преимущества при лечении другими триптанами. Так, D.W. Dodick (25) проведен анализ нескольких РКИ эффективности различных представителей триптанов у пациентов, не отвечающих на суматриптан, по крайней мере, в лечении 3 последовательных приступов мигрени. Этот анализ подтверждает наблюдения практикующих врачей, что «переключение» от одного триптана к другому в большинстве случаев дает очевидные терапевтические преимущества (рисунок 4).
Cady R.K. с соавт. (6) провели исследование 785 пациентов с мигренью, сравнивая пациентов, продолжающих постоянный прием триптанов для купирования приступов, с теми, кто отказывался от их приема. Предикторами продолжения длительного использования триптанов являлись доверие врачу, а также скорость купирования приступа и быстрота возврата к нормальному функционированию. При этом исходно пациенты не отличались ни по тяжести приступов, ни по количеству использования дополнительного обезболивания.
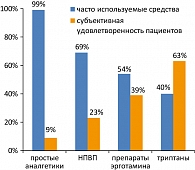
Несмотря на то что для специфического лечения мигрени триптаны являются препаратами выбора, в целом наблюдается недостаточное их использование пациентами. В 1999 году J. Pascual с соавт. (23) опубликовали результаты исследования, проведенного в 7 госпиталях различных регионов Испании, где проводился опрос пациентов о препаратах, которые они используют для купирования в большинстве приступов, их эффективности и удовлетворенности этими препаратами. Выяснилось, что 99% пациентов используют на регулярной основе аналгетики, 69% – НПВП, 54% – препараты эрготамина, 40% – триптаны. Когда пациентов опрашивали об удовлетворенности этими препаратами, то оказалось, что субъективно хорошим был эффект только у 9%, использующих аналгетики, у 23% пациентов, использующих НПВП, 39% пациентов, принимающих эрготамин, и у 63% пациентов, использующих триптаны (рисунок 5).
Таким образом, клинический опыт лечения триптанами и данные РКИ позволили выработать некоторые принципы рациональной терапии приступов мигрени. При выборе средства для купирования мигренозной боли следует учитывать клинические особенности пациента (время нарастания боли до максимальной, длительность приступа, выраженность сопровождающих симптомов). Эти особенности позволяют индивидуализировать подходы к терапии пациента в зависимости от характеристик приступа. Условием достижения максимальной эффективности при лечении триптанами является использование эффективных доз, наиболее ранний прием обезболивающего средства в процессе развития мигренозной боли. Соблюдение этих принципов способствует повышению эффективности лечения приступов мигрени и повышает комплаентность со стороны пациентов.
