Современная фармакотерапия остеоартроза
- Аннотация
- Статья
- Ссылки
- English

Остеоартроз (ОА) (остеоартрит) – хроническое прогрессирующее дегенеративно-дистрофическое заболевание суставов, характеризующееся дегенерацией суставного хряща с последующими изменениями субхондральной кости и развитием краевых остеофитов и сопровождающееся реактивным синовитом [1, 2].
ОА является наиболее распространенным заболеванием суставов. Его дебют обычно наблюдается после 40 лет. ОА коленного сустава (гонартроз) чаще развивается у женщин, тазобедренного сустава (коксартроз) – у мужчин.
Установлено, что при ОА страдают все структуры сустава, а также периартикулярные ткани. Следовательно, его лечение – трудная задача, требующая объединения усилий врачей разных специальностей: ревматологов, ортопедов, неврологов, хирургов.
Согласно рекомендациям Европейской антиревматической лиги (European League Against Rheumatism – EULAR) за 2012 г. [3] пациентам с ОА показано сочетание фармакологических и нефармакологических (обучение, снижение массы тела, защита сустава, физические упражнения) методов лечения. При их назначении следует учитывать локализацию поражения, выраженность боли и воспаления, факторы риска развития побочных реакций. Фармакологическое лечение проводится:
-
парацетамолом;
-
нестероидными противовоспалительными препаратами (НПВП) при неэффективности парацетамола, ингибиторами циклооксигеназы 2 (ЦОГ-2) при наличии факторов риска развития побочных реакций;
-
опиоидными анальгетиками;
-
хондропротекторами;
-
средствами локальной терапии (в том числе глюкокортикоидами (ГК)).
Кроме того, может быть назначено ортопедическое и хирургическое лечение.
Для купирования боли на начальных стадиях ОА используют анальгетики, в частности парацетамол в дозе 2–4 г/сут. В случае недостаточной эффективности парацетамола и отсутствия синовита можно применять Трамал – синтетический анальгетик центрального действия. Суточная доза препарата – 100–200 мг.
Основной группой лекарственных средств, применяемых при ОА, являются НПВП [4, 5]. Наиболее часто больным назначают «стандартные» НПВП – диклофенак (75–100 мг/сут), кетопрофен (до 300 мг/сут), ибупрофен (1200–2400 мг/сут). Из группы ингибиторов ЦОГ-2 – нимесулид (200 мг/сут), мелоксикам (7,5–15 мг/сут), целекоксиб (200 мг/сут).
Нимесулид достоверно уменьшает симптомы ОА. По эффективности он сопоставим, а в некоторых случаях даже превосходит другие НПВП (этодолак, диклофенак, кетопрофен, напроксен, пироксикам, целекоксиб и рофекоксиб) (см. таблицу) [6].
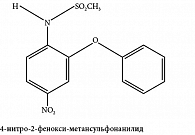
Нимесулид – один из немногих представителей НПВП, которые преимущественно или селективно ингибируют ЦОГ-2. Нимесулид (см. рисунок) является нейтральным НПВП (рКа около 6,5) с умеренной липофильностью. В отличие от классических неселективных НПВП он не содержит карбоксильную группу, однако имеет метансульфонамидный фрагмент. Необходимо отметить, что сульфонамидные или метилсульфонильные группы содержатся и в молекулах селективных ингибиторов ЦОГ-2 целекоксиба и рофекоксиба. Метансульфонамидный фрагмент нимесулида взаимодействует с ЦОГ-2, в результате подавляется его активность. В то же время фенильное кольцо нимесулида по характеру связей существенно отличается от селективных ингибиторов ЦОГ-2. При изучении связи между структурой препарата и его активностью отмечено, что производные нимесулида, не содержащие NO2-группу, обладают менее выраженным ноцицептивным эффектом. Следовательно, NO2-фрагмент может участвовать в реализации терапевтического эффекта нимесулида [6]. Кроме того, многие исследования показали, что нимесулид практически не подавляет выработку простагландинов слизистой оболочкой желудка.
Одно из главных преимуществ нимесулида – меньший риск развития серьезных осложнений со стороны желудочно-кишечного тракта (ЖКТ) – в два раза и более по сравнению с традиционными НПВП. А.Е. Каратеев и соавт. провели рандомизированное контролируемое исследование безопасности нимесулида (препарата Нимесил®) у больных после заживления НПВП-индуцированных язв и множественных эрозий слизистой оболочки желудка и/или двенадцатиперстной кишки. У пациентов, принимавших Нимесил® в дозе 200 мг/сут в течение двух месяцев, число рецидивов составило 5,6%, в то время как в контрольной группе (получали диклофенак в дозе 100 мг (свечи)) – 33,3% [7].
Влияние селективных ингибиторов ЦОГ-2 на печень сопоставимо с плацебо. Анализ литературы показывает, что при кратковременном применении нимесулида уровень аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) повышался у 0,4% больных, при использовании свыше шести месяцев – у 1,5% больных, в то время как прием диклофенака приводил к повышению значений АСТ и АЛТ практически у каждого пятого больного [8]. По данным органов здравоохранения Финляндии, с 1985 по 2002 г. во всем мире было зарегистрировано лишь 195 случаев гепатотоксичности. В Индии 600 педиатров участвовали в исследовании безопасности нимесулида у детей: о тяжелых гепатотоксических реакциях не сообщалось.
В крупном популяционном исследовании гепатотоксичности нимесулида проанализирована частота лекарственного поражения печени у 400 тыс. больных, получавших различные НПВП с 1997 по 2001 г. Было показано, что НПВП в целом повышают риск развития патологии печени, однако незначительно: общая частота гепатопатий – 29,8 на 100 тыс. пациенто-лет, относительный риск 1,4. При этом нимесулид приводил к развитию гепатопатий в 35,3 случая на 100 тыс. пациенто-лет. Это значительно реже, чем диклофенак – 39,2 и ибупрофен – 44,6. Тяжелое поражение печени (цитолиз, холестатический синдром) при применении НПВП наблюдалось очень редко – один случай на 10 тыс. больных [9].
В монографии, посвященной применению нимесулида, отмечается, что возникновение нежелательных реакций со стороны печени могло быть связано с приемом других потенциально гепатотоксичных лекарственных препаратов либо с существовавшими ранее состояниями и предрасположенностью к развитию печеночной недостаточности. Таким образом, данные о более высокой токсичности нимесулида по сравнению с другими НПВП отсутствуют.
Поскольку гепатотоксичность нимесулида не превышает гепатотоксичность других НПВП, широко используемых в странах Европы, Европейское медицинское агентство (European Medicines Agency – EMA) не нашло оснований для его запрета (пресс-релиз от 21.09.2007).
Еще один аспект, на котором необходимо остановиться, – потенциально протективный эффект нимесулида на хрящ. Показано, что нимесулид препятствует подавлению интерлейкином 1 синтеза протеогликанов, так же как и стимулированной им продукции оксирадикалов хрящом и оксида азота хондроцитами [10]. В отличие от индометацина, значительно повреждающего хрящ, нимесулид в условиях in vitro (даже в высоких дозах) не нарушал синтез протеогликана хрящом. Хондропротекторные свойства нимесулида подтвердили и данные клинических исследований: прием терапевтических доз нимесулида способствовал значительному снижению сывороточного уровня матричных металлопротеиназ, включая стромиелизин (или ММП-3) [11].
Эти факты в совокупности с низким риском развития осложнений со стороны ЖКТ стали доказательной базой для применения нимесулида при ОА [12].
Представляют интерес данные исследования, проведенного во Франции. Было показано, что терапия гранулированным нимесулидом при ОА в дозе 100 мг два раза в сутки в течение трех месяцев (в инструкции по применению, использовавшейся до 09.12.2009, продолжительность приема препарата Нимесил® не ограничивалась) уменьшала боль на 54% по визуальной аналоговой шкале и в 77% случаев результаты лечения оценивались врачами как отличные и хорошие. Побочные эффекты со стороны ЖКТ, нервной системы и кожи, развившиеся у 33% больных, расценивались как легкие или умеренные [8].
Поскольку ОА ассоциируется с пожилым возрастом, вопросы безопасности терапии НПВП имеют особое значение. В сравнительном исследовании нимесулида и напроксена у пациентов пожилого возраста было показано, что при одинаковой эффективности препаратов переносимость нимесулида была лучше [6].
В российском многоцентровом исследовании оценивалась эффективность и переносимость гранулированной формы нимесулида у больных ревматоидным артритом. Препарат принимался в течение 12 недель в дозе 200–400 мг. Значительное улучшение на фоне терапии зарегистрировано у 23,4% больных, улучшение – у 79,2%. Обратимые побочные явления отмечались у 8 (15,3%) пациентов, пятерым из них потребовалась отмена препарата [8].
В Институте ревматологии был проведен ряд исследований по изучению эффективности и безопасности гранулированной формы нимесулида при подагрическом артрите. Уже к пятому дню терапии высокая положительная динамика в отношении купирования боли и воспаления отмечалась у всех больных, несмотря на то что в исследовании участвовали пациенты с длительным артритом, у которых было поражено несколько суставов и предшествующее лечение было неэффективным. Не было зафиксировано случаев гастро- и гепатотоксичности, а также влияния препарата на показатели артериального давления при двух- и трехнедельных курсах лечения (в инструкции по применению, использовавшейся до 09.12.2009, продолжительность приема препарата Нимесил® не ограничивалась) [6].
Таким образом, нимесулид (Нимесил®) зарекомендовал себя как эффективное лекарственное средство для устранения боли и воспаления у больных ревматологического профиля, которое хорошо переносится пациентами.
Для замедления прогрессирования ОА применяются симптоматические препараты – хондропротекторы [13]. Широкое распространение из этой группы получили сульфатированные гликозаминогликаны – хондроитина сульфат (Структум) и глюкозамина сульфат (ДОНА, Стопартроз), комбинации хондроитина сульфата и глюкозамина гидрохлорида (АРТРА, Терафлекс), экстракты из морских организмов (Алфлутоп), а также неомыляемые соединения сои и авокадо (Пиаскледин) [14, 15]. Эти препараты отличаются отсроченным клиническим эффектом (спустя две – шесть недель от начала терапии), а также его длительностью (в течение двух – шести месяцев по окончании курса лечения).
При сочетании ОА с остеопорозом показано назначение стронция ранелата (Бивалос), который стимулирует синтез новой костной ткани посредством образования преостеобластов и препятствует разрушению костной ткани остеокластами.
Локальная терапия ОА предполагает внутри- или околосуставное введение ГК, внутрисуставное введение препаратов гиалуроновой кислоты, а также нанесение на область суставов мазей, кремов, гелей, паст на основе НПВП.
Внутрисуставное введение ГК показано больным с хроническим синовитом коленных суставов. Рекомендуется использование пролонгированных ГК. Число введений в один сустав не должно превышать трех-четырех в год из-за возможности прогрессирования деструктивных изменений хряща и субхондральной кости. При ОА коленных суставов также используется внутрисуставное введение препаратов, содержащих гиалуронат натрия (вязкоупругие имплантанты для инъекций в полость сустава).
Для уменьшения болевого синдрома активно применяют противовоспалительные мази, гели, кремы (Диклофенакол, Фастум гель, Финалгель и др.), Кармолис жидкость, аппликации димексида с анальгетиками и др.
При синовите могут применяться электромагнитное поле ультравысокой частоты, магнитотерапия, ультрафиолетовое облучение эритемными дозами. Показан электрофорез ингибиторов протеолитических ферментов: Трасилола, Контрикала и Пантрипина.
В период ремиссии эффективно применение лечебных грязей (иловых, торфяных) и других теплоносителей (парафина, озокерита).
Для снижения нагрузки на пораженные суставы рекомендуются ортезы на коленные, голеностопные, локтевые и первые запястно-пястные суставы.
Больным со значительным нарушением функции коленных и тазобедренных суставов показано хирургическое лечение (артроскопические операции, эндопротезирование суставов).
Таким образом, ОА представляет собой значимую медицинскую проблему, что связано с большой его распространенностью, разнообразием механизмов боли, преимущественно пожилым контингентом больных. Рациональная фармакотерапия ОА должна проводиться с учетом коморбидного фона, медленного развития структурно-модифицирующего эффекта препаратов. При этом необходимо проводить ортопедические и реабилитационные мероприятия.
I.B. Belyayeva
I.I. Mechnikov North-West State Medical University
Contact person: Irina Borisovna Belyayeva, belib@mail.ru
According to the recommendations released by The European League Against Rheumatism (2012) patients
with osteoarthrosis are indicated to combine pharmacological and non-pharmacological methods of treatment. The main group of medicines used for its treatment is presented by non-steroid anti-inflammatory drugs (NSAID). Here, we provide with a comparative efficacy analysis for nimesulide and other NSAIDs and present its safety data (a risk of developing complications in GI-tract and liver) as well as discuss its chondroprotective effects.
