V Общероссийский научно-практический семинар: Актуальные терапевтические подходы к лечению дисбиоза влагалища, нарушений менструального цикла, менопаузальных расстройств и осложненной беременности
- Аннотация
- Статья
- Ссылки





Регулярный менструальный цикл, по мнению к.м.н. И.А. ИЛОВАЙСКОЙ (МОНИКИ им. М.Ф. Владимирского), является важным показателем общего здоровья женщины, а менструальная функция – отражением нормальной работы гипоталамо-гипофизарно-яичниковой системы. Причины снижения функции яичников (гипогонадизм) и, как следствие, нарушений менструального цикла можно разделить на несколько групп:
- снижение секреции гонадотропных гормонов – фолликулостимулирующего и лютеинизирующего (гипогонадотропный гипогонадизм);
- овариальная недостаточность (гипергонадотропный гипогонадизм);
- другие нарушения (нормогонадотропный гипогонадизм): эндокринные заболевания, соматическая патология и др.
Тактика лечения определяется в зависимости от типа гипогонадизма. Диагностика гонадотропной недостаточности, как правило, не вызывает затруднений. Гораздо большие трудности связаны с определением причины нарушения менструального цикла при нормальном уровне гонадотропных, а иногда и половых гормонов. В этом случае следует искать соматические или эндокринные заболевания, которые могли вызвать данное состояние. Среди эндокринных заболеваний, способствующих развитию нормогонадотропного гипогонадизма, И.А. Иловайская отмечает:
- гипотиреоз;
- гиперпролактинемию;
- ожирение, метаболический синдром;
- гиперандрогению яичникового или надпочечникового генеза;
- синдром поликистозных яичников;
- сахарный диабет 1 и 2 типа.
Следует обратить внимание на симптомы, при которых пациенткам должно быть проведено дополнительное обследование:
- чрезмерно редкие (реже, чем каждые 45 дней) или частые (чаще, чем каждый 21 день) менструации;
- продолжительные (более 7 дней) менструации;
- чрезмерно обильные выделения (пациентка использует более 1 гигиенического продукта каждые 1–2 часа);
- изменение привычной регулярности и характера менструального цикла;
- задержка на 90 и более дней (даже единичная).
Углубленное обследование включает оценку гормонального статуса (определение уровня лютеинизирующего, фолликулостимулирующего, тиреотропного гормонов, пролактина, свободного Т4, инсулиноподобного фактора роста-1, а также – по показаниям – эстрадиола, тестостерона, глобулина, связывающего половые гормоны, дегидроэпиандростерона сульфата, 17-ОН-прогестерона, малую дексаметазоновую пробу) и ультразвуковое исследование органов малого таза. При избыточной массе тела необходимо исключить нарушения углеводного обмена, а при подозрении на аденому гипофиза следует провести магнитно-резонансную томографию головного мозга. Главным последствием нарушения менструального цикла И.А. Иловайская считает прогестероновую недостаточность, абсолютную или относительную. Однако лабораторное измерение уровня прогестерона в данной ситуации нецелесообразно: если нет овуляции, нет и оснований для определения уровня прогестерона, а если овуляция есть, но нет полноценной трансформации эндометрия, то данное исследование не имеет практического значения.
Из препаратов, способных устранить прогестероновую недостаточность, И.А. Иловайская выделила дидрогестерон (препарат Дюфастон® производства компании «Эбботт»). Дюфастон® применяется в клинической практике более 40 лет, за это время был накоплен обширный положительный опыт использования данного средства с целью коррекции нарушений менструального цикла. Дидрогестерон не оказывает негативного влияния на метаболизм, что позволяет его использовать у пациентов с эндокринопатиями (при сахарном диабете 1 и 2 типа, нарушениях функции щитовидной железы, ожирении, гипер- и гипогонадотропном гипогонадизме). Завершая свое выступление, А.И. Иловайская напомнила, что лечение нарушений менструального цикла должно быть нацелено как на поиск причин, так и на ликвидацию последствий этих нарушений. Даже если установить причину обильных или болезненных менструаций у конкретной пациентки почему-либо не представляется возможным, а все серьезные заболевания уже исключены, врач все равно должен подумать о терапии, которая может улучшить качество жизни больной.
Раннее начало ЗГТ, продолжительность жизни и ее качество: дискуссионные аспекты и доказательные результаты
Еще один доклад к.м.н. И.А. Иловайская посвятила возможностям применения заместительной гормональной терапии (ЗГТ) у женщин зрелого возраста. С периодом менопаузы в жизни женщины связан повышенный риск развития множества заболеваний, в частности метаболического синдрома, вероятность развития которого увеличивается в три раза. Помимо абдоминального ожирения и гиперинсулинемии данный синдром характеризуется повышением артериального давления и стойкой гипертриглицеридемией. Метаболический синдром связан как с проявлениями климакса, так и с риском развития сердечно-сосудистых заболеваний (ССЗ). Ретроспективный анализ, включавший 951 женщину с хирургической или естественной менопаузой, показал, что 10-летний риск развития ССЗ прямо коррелирует с индексом массы тела и количеством баллов по шкале Грина (эта шкала используется для оценки тяжести климактерических нарушений)1.
Следует также помнить, что время наступления менопаузы влияет как на риск развития когнитивных нарушений и деменции, так и на общий риск смертности. Еще одним классическим примером негативного воздействия возрастного гормонального дефицита является развитие остеопороза. В ходе исследования O. Svejme и соавт., которое охватило 390 женщин европейской расы, разделенных по критерию возраста начала менопаузы (на тех, у кого менопауза наступила до 47 лет и позже этого возраста), оценивалась частота развития остеопороза, переломов, а также смертность в возрасте 77 лет2. Было установлено, что в группе женщин, у которых менопауза наступила ранее 47 лет, риск развития остеопороза был выше в 1,83 раза, риск переломов – в 1,68, а риск смерти в возрасте 77 лет и раньше – в 1,59 раза.
В настоящее время существует несколько подходов к терапии климактерических расстройств, по-разному влияющих на жизненный прогноз. Доказано, что ЗГТ существенно снижает риск как общей, так и сердечно-сосудистой смертности. Использование препаратов ЗГТ снижает частоту ССЗ и увеличивает продолжительность жизни. Однако следует помнить, что эффективность ЗГТ коррелирует со временем начала лечения и длительностью приема препаратов, а профиль безопасности гормональной терапии зависит от выбранного гестагенного компонента. Гормональные препараты обладают неодинаковым спектром действия (табл.), поэтому при их выборе (равно как и при определении момента начала терапии) следует учитывать следующие принципы: выбранное средство не должно оказывать негативного влияния на метаболизм, быть хорошо изученным, удобным в приеме, низкодозированным, а также безопасным в отношении ССЗ и вероятности развития рака молочной железы.
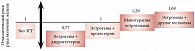
И, наконец, следует помнить, что влияние ЗГТ на риск развития рака молочной железы зависит от гестагена, входящего в состав препарата. Исследование, проведенное A Fournier и соавт. (80 377 женщин в постменопаузе, 12 лет наблюдения), показало, что наиболее безопасной комбинацией является сочетание «эстрогены + дидрогестерон» (рис. 1)3. В заключение И.А. Иловайская еще раз отметила ключевые моменты назначения ЗГТ. Основываясь на данных доказательной медицины, ЗГТ следует применять в рамках стратегии поддержания здоровья женщин в пери- и постменопаузе. Эта стратегия включает рекомендации по питанию, физическим нагрузкам, отказу от курения и потребления алкоголя. Для женщин моложе 45 лет с преждевременной менопаузой (в первую очередь с хирургической менопаузой) ЗГТ рекомендована как минимум до достижения среднего возраста менопаузы. Принимать гормональные препараты целесообразно до достижения возраста 65–68 лет, поскольку в более позднем возрасте эффективность их приема снижается.
Необходимо помнить, что все препараты ЗГТ разные, предпочтительно использование низкодозированных препаратов ЗГТ. Профиль эффективности и безопасности препаратов ЗГТ во многом определяется гестагенным компонентом в его составе. Так, по заключению Международного общества по менопаузе (IMS, 2011), дидрогестерон в комбинации с пероральным или трансдермальным эстрадиолом имеет более благоприятный профиль риска рака молочной железы, чем синтетические прогестагены. Следует также подчеркнуть необходимость индивидуального подхода к назначению ЗГТ: выбор препарата для ЗГТ осуществляется совместно врачом и пациенткой, которая, в свою очередь, должна быть ознакомлена с особенностями различных средств, применяемых для ЗГТ.
Профилактика рецидивов дисбиотических нарушений влагалища
Известно, что нарушения микробиоценоза влагалища тесно связаны с развитием гинекологических заболеваний, а также патологий беременности и родов. При этом сами нарушения состава влагалищной микрофлоры могут быть вызваны разными причинами: эндогенными (сопутствующими заболеваниями) и экзогенными (как правило, связанными с лекарственной терапией). По данным, которые привела д.м.н., профессор кафедры акушерства и гинекологии ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» Т.Н. САВЧЕНКО, в норме микрофлора влагалища состоит преимущественно из лактобацилл (107–109 КОЕ/мл), условно-патогенная микрофлора в ней присутствует в значительно меньших количествах (103–104 КОЕ/мл), а грамотрицательная микрофлора, споры, мицелий и патогенные микроорганизмы отсутствуют. Допустимо наличие единичных (до 10 в поле зрения) лейкоцитов.
Лактобактерии, доминирующие в составе нормальной влагалищной микрофлоры, выполняют целый ряд важных функций (рис. 2). С одной стороны, молочная кислота, которую вырабатывают лактобактерии, создает кислую среду, необходимую для жизнедеятельности самих лактобактерий, а с другой – низкий pH способствует разрушению бактериальных пленок, создаваемых колониями условно-патогенных и патогенных микроорганизмов. Защелачивание среды влагалища приводит к обратному эффекту: количество лактобактерий уменьшается, а условно-патогенные бактерии, напротив, начинают активно размножаться, поскольку оптимальный pH среды для них составляет от 5 до 8 и более.
Наиболее распространенным нарушением микробиоценоза влагалища на сегодняшний день является бактериальный вагиноз: распространенность данной патологии в структуре заболеваний нижних отделов репродуктивного тракта составляет 50%. Бактериальный вагиноз – это инфекционный невоспалительный синдром, связанный с дисбактериозом влагалищного биотопа, характеризующийся снижением или отсутствием молочнокислых бактерий и высокой концентрацией облигатно- и факультативно-анаэробных условно-патогенных микроорганизмов (Gardnerella vaginalis, Mycoplasma hominis, Bacteroides spp., Leptothrix spp. и др.). Патогенез бактериального вагиноза включает нескольких звеньев:
- угнетение роста и жизнедеятельности лактобактерий;
- повышение pH;
- рост анаэробных бактерий;
- синтез веществ, обусловливающих характерный «рыбный» запах и появление «ключевых» клеток.
Общепринятой терапевтической тактикой в отношении бактериального вагиноза на сегодняшний день является последовательное применение противомикробной терапии (метронидазол, клиндамицин, тернидазол) и препаратов, восстанавливающих микробиоценоз влагалища (Ацилакт, Лактобактерин, Бифидумбактерин и т.п.). Противомикробная терапия характеризуется развитием ряда побочных эффектов: во-первых, она может привести к развитию резистентности и появлению лактобацилл, не продуцирующих Н2О2, а во-вторых, антибактериальные препараты небезопасны для беременных. Рецидивы дисбиоза влагалища в течение 9 месяцев после курса противомикробной терапии наблюдаются у 85% пациенток. В настоящее время считают, что высокая частота рецидивов связана, прежде всего, со способностью патогенных микроорганизмов создавать бактериальные пленки, выполняющие защитную функцию. Микроорганизмы, которые находятся в толще биопленок, фактически неуязвимы для антибиотиков, а сами биопленки разрушаются только в кислой среде. Однако ни на одном из этапов классической терапии бактериального вагиноза пациентка не получает препаратов, непосредственно воздействующих на кислотность среды.
Включение в классическую двухэтапную схему лечения бактериального вагиноза препаратов на основе органических кислот позволяет достичь двух важных целей: снижения pH среды влагалища и подавления роста условно-патогенной и патогенной микрофлоры. Учитывая, что повышение pH играет ключевую роль в патогенезе бактериального вагиноза, снижение этого показателя, разумеется, ускоряет обратное развитие патологического процесса. Среди препаратов, влияющих на кислотность среды влагалища, профессор Т.Н. Савченко выделила препарат Вагинорм-С®. Аскорбиновая кислота, входящая в его состав, эффективно снижает pH среды влагалища, что одновременно способствует размножению лактобактерий и угнетает жизнедеятельность болезнетворных микроорганизмов. Особенно чувствительны к закислению среды бактерии (эта особенность генетически обусловлена), что позволяет использовать Вагинорм-С® в качестве эффективного средства для борьбы с гарднереллезом.
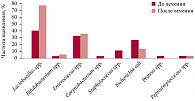
Включение препарата Вагинорм-С® в комплексное лечение бактериального вагиноза (одновременно с системными противомикробными средствами или сразу после окончания местной антибактериальной терапии) позволяет добиться быстрого и устойчивого терапевтического эффекта, что подтверждено рядом клинических испытаний. Результатами одной из работ, посвященных исследованию эффективности препарата Вагинорм-С®, профессор Т.Н. Савченко поделилась с аудиторией (рис. 3). В ходе исследования было установлено, что использование данного препарата снижает частоту выявления целого ряда патогенных и условно-патогенных микроорганизмов, количество же лактобацилл, напротив, увеличивается, что само по себе указывает на нормализацию состояния микрофлоры влагалища и обратное развитие заболевания. Подводя итоги, профессор Т.Н. Савченко еще раз подчеркнула клиническую значимость включения препаратов, влияющих на кислотность среды, таких как Вагинорм-С®, в комплексную терапию бактериальных вагинозов, поскольку использование лекарственных средств на основе органических кислот является патогенетически обусловленным и может широко применяться в гинекологической практике.
Как отметила д.м.н., профессор кафедры акушерства, гинекологии и репродуктивной медицины РУДН А.В. СОЛОВЬЕВА, преждевременные роды – это проблема не только медицинская, но и социальная. Велика вероятность рождения детей с пороками развития (слепотой, глухотой, ДЦП), которые будут пожизненно нуждаться в лечении, пенсиях, помощи социальных и медицинских работников. Очевидно, что профилактика преждевременных родов должна стать первоочередной задачей акушерства и гинекологии. Проблема преждевременных родов осложняется тем, что риск рождения недоношенного ребенка пациентками, у которых в анамнезе уже были преждевременные роды, увеличивается. Кроме того, врачам далеко не всегда удается установить причину невынашивания: исследование, проведенное в Италии доктором G.R. Di Renzo, показало, что в 40% случаев пусковой фактор, вызвавший преждевременные роды, так и остается невыясненным.
Несколько лет назад в научном сообществе обсуждалась гипотеза о наличии связи между определенными мутациями у матери и риском гибели плода или невынашивания беременности. В частности, к таким мутациям была отнесена группа аллелей, ответственных за развитие тромбофилии (мутации фактора V Leiden, протромбина G20210A, MTHFR, A1298C, а также генов, ответственных за дефицит протеина C/S и антитромбина). Однако данные последующих исследований, посвященных этой проблеме, оказались противоречивы. Так, в метаанализе и ретроспективных работах была обнаружена причинно-следственная связь между гетерозиготностью женщин по фактору V Leiden и гибелью плода, а проспективные когортные работы этой связи не выявили. Таким образом, существующие на сегодняшний день данные позволяют однозначно утверждать, что ни мутации фактора V Leiden, ни дефицит протеина C/S, ни другие механизмы, приводящие к развитию врожденной тромбофилии, не являются напрямую причинами преэклампсии, отслойки плаценты, замедления роста плода или невынашивания, хотя и могут рассматриваться как факторы риска развития этих состояний.
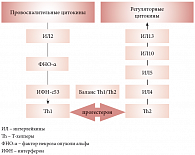
Другой проблемой, тесно связанной с невынашиванием беременности, является иммунный ответ организма матери на антигены, вырабатываемые плодом. Многочисленные исследования показали, что единственным гормоном, повышающим толерантность организма матери к растущему плоду и регулирующим баланс Th1/Th2, является прогестерон (рис. 4). Хорошо известны также проблемы ведения беременности у пациенток, страдающих антифосфолипидным синдромом. Эта системная патология оказывает негативное влияние как на организм матери (вызывая тромбозы мелких и крупных сосудов), так и на развитие плода (акушерский анамнез женщин с антифосфолипидным синдромом, как правило, отягощен привычным невынашиванием – выкидышами и внутриутробной гибелью плода).
На ранних сроках беременности пациентки с антифосфолипидным синдромом должны получать низкомолекулярный гепарин. При этом следует понимать, что препарат назначается не для профилактики тромбозов, а для связывания антифосфолипидных антител, которые представляют опасность для развития плода. Низкомолекулярный гепарин должен назначаться исключительно при наличии показаний, поскольку он увеличивает риск развития кровотечений в родах. Для регуляции иммунного ответа беременных пытались использовать кортикостероиды, однако от этой практики пришлось отказаться из-за частого развития побочных эффектов (прежде всего, артериальной гипертонии, гестационного сахарного диабета и преждевременных родов).
Наиболее важным в ведении пациенток с преждевременными родами в анамнезе, по мнению профессора А.В. Соловьевой, является прегравидарная подготовка и правильное ведение I триместра беременности. В данном случае совершенно оправдано использование гестагенов, например дидрогестерона (Дюфастон®). Последний, в свою очередь, не только способствует коррекции прогестерон-дефицитных состояний до и во время беременности, но и характеризуется иммунотолерантным действием, блокирует действие натуральных киллеров и обладает решающим значением для успешной имплантации и благоприятного течения беременности4. Дидрогестерон обладает высоким профилем безопасности: не влияет на гемостаз и не оказывает нежелательных гормональных эффектов, так как связывается только с рецепторами прогестерона. Профессор А.В. Соловьева подчеркнула, что прогестерон на 35% снижает вероятность преждевременных родов, поэтому препараты прогестерона и его агонистов могут и должны назначаться пациенткам, находящимся в группе высокого риска по данному показателю.
Заключение
В рамках семинара были рассмотрены наиболее актуальные проблемы гинекологии: нарушения менструального цикла в репродуктивном возрасте, принципы назначения ЗГТ в период менопаузы, профилактика воспалительных заболеваний влагалища, предупреждение преждевременных родов. Эксперты в своих докладах подчеркивали необходимость назначения препаратов, эффективность и безопасность которых подтверждена клиническими исследованиями. Так, например, дидрогестерон (Дюфастон®), применяемый для коррекции прогестероновой недостаточности уже на протяжении 40 лет, хорошо зарекомендовал себя в клинической практике. Дюфастон® разрешен для применения как для лечения гинекологических заболеваний, так и во время беременности. Патогенетически обусловлено включение в комплексную терапию бактериальных вагинозов такого препарата на основе органических кислот, как Вагинорм-С®. Такая схема терапии позволяет добиться быстрого и устойчивого терапевтического эффекта, что подтверждено рядом клинических испытаний.
