Влияние гипотензивных препаратов на течение беременности у пациенток с глаукомой: данные экспериментальных и клинических наблюдений
- Аннотация
- Статья
- Ссылки
- English
Всесторонне оценить влияние лекарственных средств на развитие врожденной патологии не представляется возможным, поскольку соответствующие рандомизированные исследования не проводятся и достоверные сведения, касающиеся применения лекарственных средств во время беременности, отсутствуют. Предположительно лекарственные средства являются причиной 1–3% врожденных аномалий. Применением лекарственных препаратов во время беременности могут быть обусловлены эмбриотоксический (гибель эмбрионов) и тератогенный (возникновение различных аномалий развития) эффекты, а также пренатальная дистрофия (замедление роста и развития) [1].
Эпидемиология
Детородный возраст женщин приходится на вторую – пятую декады жизни. Однако благодаря новым прогрессивным репродуктивным технологиям этот возраст существенно увеличился.
Данных о распространенности глаукомы среди беременных нет. Глаукома во время беременности – редкое явление в клинической практике.
К проявлениям глаукомы ошибочно относят такие состояния, как офтальмогипертензия, сужение поля зрения, оптическая нейропатия неглаукомного происхождения. В литературе не описано случаев глаукомы, индуцированной беременностью.
В детородном возрасте у женщин превалирует детская и юношеская форма глаукомы [2]. Кроме того, глаукома в этом возрасте может быть вторичной как осложнение других глазных и системных заболеваний, а также обусловленной анатомическими особенностями строения переднего отрезка глаза. Иногда вторичная глаукома развивается на фоне длительного применения глюкокортикостероидов при воспалительных заболеваниях глаз, после операции или травмы и т.д. Описан случай острого приступа глаукомы во время беременности на фоне стресса [3].
Первичная открытоугольная глаукома (ПОУГ) положительно коррелирует с возрастом и в редких случаях наблюдается при беременности. Как показали результаты исследований, глаукома встречается у 2–3% пациенток в возрасте до 40 лет, причем на долю ПОУГ приходится около 25% [4, 5]. Нередко у молодых женщин ПОУГ выявляется в продвинутых стадиях, когда требуется более активная тактика лечения.
Изменения внутриглазного давления
В организме беременной происходят физиологические изменения, обусловленные прежде всего перестройкой гормонального фона [6]. Как следствие – снижение уровня внутриглазного давления (ВГД). Это связано с постепенным увеличением выработки прогестерона, релаксина и гонадотропина [7, 8]. Повышение уровня релаксина приводит к улучшению оттока внутриглазной жидкости [6], а увеличение уровня бета-человеческого хорионического гонадотропина – к уменьшению ее секреции [9].
Особенно заметно офтальмотонус снижается во втором и третьем триместрах беременности [6, 10–14]. В одном из исследований уровень ВГД у беременных был на 13–18% ниже, чем у небеременных аналогичного возраста, но в группе беременных с артериальной гипертензией – в меньшей степени [11]. При этом сниженный во время беременности уровень офтальмотонуса сохранялся несколько месяцев после родов [15]. Снижение ВГД у беременных объясняют уменьшением давления в эписклеральных венах и усилением оттока внутриглазной жидкости по сравнению с дородовыми показателями [16, 17].
Таким образом, беременность может положительно влиять на течение глаукомы [6, 12, 18]. Если уровень офтальмотонуса не повышается, можно отменить местную гипотензивную терапию или снизить количество применяемых препаратов. Под физиологическим снижением ВГД у беременных может маскироваться глаукома, не диагностированная до беременности. Учитывая, что после родов ВГД возвращается к исходным значениям, женщинам с подозрением на глаукому необходимо контролировать ВГД в послеродовом периоде.
Диагностика глаукомы
Диагностика глаукомы у беременных не отличается от таковой у других групп пациентов. При вторичной форме глаукомы важно определить основное заболевание. Исследование поля зрения у беременных с глаукомой проводится в общеустановленные сроки, поскольку глаукома во время беременности прогрессирует редко [13, 14]. Не исключена возможность появления атипичных изменений полей зрения у беременных без глаукомы, таких как битемпоральные или концентрические сужения [19, 20]. Эти изменения не сопровождаются жалобами и обычно после родов исчезают [12]. Причиной атипичных изменений полей зрения у беременных без глаукомы считается увеличение гипофиза, оказывающего давление на расположенную над ним хиазму зрительных нервов [12]. Однако существует и противоположная точка зрения [20].
Лечение глаукомы
Изучение лекарственного воздействия на течение беременности и развитие плода при глаукоме – задача сложная в силу немногочисленности подобных клинических случаев [21, 22]. Результаты исследований, подтверждающие безопасность гипотензивных препаратов у беременных животных, не могут быть экстраполированы на человека [23]. Отсутствие побочных эффектов при использовании лекарственных препаратов у животных не позволяет с уверенностью оценить риск их воздействия на организм человека. Об этом должны быть проинформированы пациентки, получающие гипотензивное лечение.
Глазные капли абсорбируются через носослезный канал и слизистую оболочку полости носа и способны оказывать системное воздействие. Оценить его степень сложно. Не случайно офтальмолог и пациент в каждом конкретном случае должны анализировать преимущества назначения препарата и риск, связанный с его применением [24].
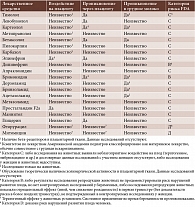
При медикаментозной терапии глаукомы необходимо назначать антиглаукомные капли в максимально низких дозах. При этом следует учитывать данные Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA), располагающего информацией о возможном влиянии лекарственных препаратов на организм человека и регламентирующего их применение в том числе при беременности (таблица).
Аналоги простагландинов
Эндогенные аналоги простагландинов играют важную роль в репродуктивном цикле человека, но механизмы их воздействия до конца не изучены. Простагландины E2 и F2а содержатся в амниотической жидкости. Равномерное соотношение концентрации этих двух типов простагландинов сдерживает сокращение матки, предотвращая угрозу выкидыша на ранних сроках и гипоксию плода в период гестации. Повышение уровня PGF2a вызывает не только сокращение матки [25], но и в ряде случаев вазоконстрикцию в фетоплацентарной сосудистой системе [26–28]. У здоровых женщин накануне родов простагландины накапливаются в амниотической жидкости и сохраняются в ней в течение шести часов. Их концентрация увеличивается до десяти раз. Такое высокое содержание простагландинов обеспечивает хорошую родовую деятельность и быстрое раскрытие шейки матки [29].
Применение аналогов простагландинов у беременных с глаукомой вызывает много вопросов. Латанопрост, аналог PGF2a, в дозе, в 15–80 раз превышающей лечебную, оказывает эмбриотоксический эффект у животных [30], у мышей и крыс вызывает пороки развития [31, 32], но не оказывает тератогенного эффекта у кроликов и хомяков [33, 34].
При использовании капель латанопроста у десяти беременных с глаукомой отрицательного воздействия на беременность и плод не отмечалось. В одном случае зарегистрирован спонтанный выкидыш [35]. Поскольку биологически активная форма латанопроста быстро выводится из плазмы, возможно, этот препарат характеризуется минимальными побочными эффектами [36]. Однако в настоящее время простагландины Е2 и F2a применяются в акушерско-гинекологической практике с целью прерывания беременности в поздние сроки. В связи с этим рекомендуется избегать их назначения во время беременности.
Бета-блокаторы
Известные побочные эффекты бета-блокаторов в отношении сердечно-сосудистой системы и легких могут иметь место в период беременности и лактации [37–39]. Безусловно, побочные эффекты напрямую связаны с дозой препарата.
Бета-адренорецепторы обнаруживаются в плаценте человека уже на ранних сроках беременности [40–42]. Известно также, что некоторые бета-блокаторы проникают через плаценту человека [43]. Например, у животных введение тимолола замедляет тахикардию плода при гипоксии [44]. Поскольку у человека системное применение атенолола в первом триместре беременности может приводить к задержке роста плода [45], существует вероятность подобного воздействия и при использовании других препаратов данной группы [38].
У человека воздействие глазных форм бета-блокаторов на течение беременности и плод не изучено, несмотря на их широкое распространение. По данным некоторых авторов, бета-блокаторы относительно безопасны во время беременности [14, 46–48], но во время грудного вскармливания не применяются [12, 49]. Использовать бета-блокаторы в сроки, близкие к родам, опасно [50–52], поскольку у новорожденных в течение 24–48 часов после родов могут развиться брадикардия и апноэ. Выделяемые в грудное молоко глазные формы тимолола и бетаксолола [47, 49] также могут приводить к серьезным побочным эффектам вплоть до летального исхода у младенцев вследствие апноэ [53, 54]. Несмотря на это, FDA рекомендует тимолол как препарат, совместимый с грудным вскармливанием [55].
Парасимпатомиметики
Парасимпатомиметики в виде глазных капель не оказывают тератогенного воздействия на человеческий плод, но их широкое применение во время беременности не рекомендуется. Особую осторожность следует соблюдать беременным с миастенией в анамнезе, поскольку на фоне применения парасимпатомиметиков у них могут развиться мышечная слабость и менингит [56].
Как известно, плацента обладает холинергической активностью [57]. С функциональной активностью холинергических рецепторов может быть связано высвобождение простагландинов, регулирующих кровоток плаценты [58]. Точные механизмы воздействия холинергических рецепторов на функции плаценты и гормональный фон неизвестны. Исследования на животных показали, что карбохол и пилокарпин негативно влияют на развитие эмбриона. Между тем у человека тератогенного эффекта не выявлено [59, 60]. В отдельных клинических случаях показана безопасность применения пилокарпина в период беременности и лактации [49, 61], но воздействие на плаценту и плод не изучено.
Симпатомиметики
Применение симпатомиметиков в период беременности допустимо, однако опубликованные экспериментальные данные немногочисленны. У животных на фоне применения эпинефрина в первом триместре отрицательных эффектов не зарегистрировано [62]. Но поскольку эпинефрин выделяется эндогенно, выявить и разграничить воздействие лекарственного и эндогенного эпинефрина сложно. Известно, что эпинефрин во время беременности способен снижать перфузию матки. Так, в эксперименте на животных под воздействием эпинефрина кровоток матки снижался на 34% [63]. Дипивефрин подобных отрицательных эффектов в эксперименте на животных не продемонстрировал, но безопасность его применения у человека не изучена. Применять эпинефрин и дипивефрин при грудном вскармливании нужно с осторожностью, поскольку данных об их проникновении в грудное молоко нет.
Эксперименты с альфа-2-адреномиметиком бримонидином на животных не выявили вредного воздействия. Тем не менее известно, что он проходит через плаценту и выделяется в грудное молоко [64]. Высокие дозы апраклонидина в эксперименте на животных оказывали токсическое действие на эмбрион [65]. Альфа-адренергические рецепторы в плаценте не обнаружены [66], но роль системных адреномиметиков в регуляции секреции «молочного» гормона пролактина [67] гипофизом очевидна. Вместе с тем воздействие капельной формы бримонидина на уровень пролактина у животных и человека остается неизвестным.
Поскольку информация о воздействии альфа-2-адренорецепоров на человека отсутствует, рекомендуется с осторожностью применять их у беременных.
Ингибиторы карбоангидразы
Пероральные формы ингибиторов карбоангидразы (ИКА) противопоказаны в период беременности и лактации. Тератогенный эффект ацетазоламида и метазоламида подтвержден у животных [68–70]. При этом ретроспективный анализ данных не показал повышенного риска для плода человека [71, 72]. У животных использование ацетазоламида в первом триместре беременности также не вызывало побочных эффектов [72–74]. Однако описаны случаи неонатальной дегидратации, метаболических нарушений, внутричерепной гипертензии у плода при применении ацетазоламида во время беременности и грудного вскармливания, поскольку препарат выделяется в грудное молоко [75–77]. FDA относит ацетазоламид к лекарственным средствам, совместимым с грудным вскармливанием [55].
Глазные формы ИКА изучены еще меньше. В эксперименте на крысах зафиксировано выделение бринзоламида в молоко. Соответствующих данных в отношении человека нет [78]. В эксперименте на фоне применения дорзоламида в дозах, превышающих лечебные, отмечались пороки развития [79].
Далеко не всегда экспериментальные данные на животных применимы к человеку. Кроме того, данные об отрицательном воздействии ИКА у женщин во время беременности и грудного вскармливания отсутствуют. Исходя из этого, можно с осторожностью рекомендовать препараты этой группы к применению во втором и третьем триместрах беременности с отменой после родов или переходом на искусственное вскармливание.
Гиперосмотические средства
Гиперосмотические препараты (маннитол, глицерин) при лечении глаукомы используются редко, поэтому данных об их побочных эффектах у беременных нет.
В эксперименте на животных введение гиперосмотиков в амниотическую мембрану сопровождалось выкидышем [80]. У крыс при внутривенном введении зафиксированы геморрагии плода. Пороки развития не выявлены [81].
Данные о побочных проявлениях при пероральном применении глицерола у человека отсутствуют. Между тем известно, что в небольшом количестве он проходит через плаценту [82]. В связи с этим гиперосмотические препараты относительно противопоказаны при беременности.
Лазерное и хирургическое лечение глаукомы
В силу потенциального риска, связанного с применением гипотензивных лекарственных средств у беременных, может возникнуть потребность в немедикаментозных методах лечения. Лазерное лечение (лазерная трабекулопластика, иридотомия) по показаниям может быть хорошей альтернативой медикаментозному лечению. Лазерная трабекулопластика у беременных выполняется только при ПОУГ. Хирургическое лечение глаукомы целесообразно проводить заблаговременно, до планирования беременности, особенно при далеко зашедших стадиях болезни, а также в случае угрозы утраты зрительных функций [83–85]. Учитывая высокий риск для матери и ребенка, хирургическое лечение во время беременности проводят в крайнем случае. Сказанное распространяется на анестезиологическое пособие, антиметаболиты, послеоперационные осложнения, требующие дополнительного лечения. Применение антиметаболитов во время беременности недопустимо из-за возможности тератогенного воздействия на плод [2].
Заключение
Чем старше женщина, тем выше вероятность сочетания глаукомы и беременности. Назначение во время беременности лекарственных средств, тератогенность и токсичность которых у человека мало изучены, несет в себе определенный риск.
Глаукома – хроническая болезнь, требующая длительного консервативного лечения. Именно поэтому, планируя беременность, необходимо проконсультироваться с офтальмологом.
Как показывает практический опыт, женщины с хроническими заболеваниями продолжают лечение до момента диагностирования беременности. Соответственно лекарственное воздействие имеет место в период зачатия и органогенеза. Говоря о негативном влиянии лекарственного средства на эмбрион, необходимо обозначить критические для его развития периоды:
- период, предшествующий зачатию (наибольшую опасность представляет прием незадолго до зачатия лекарственных средств, характеризующихся кумулятивными свойствами);
- с момента зачатия до 11-го дня (эмбрион отвечает на неблагоприятные воздействия по принципу «все или ничего», то есть либо погибает, либо выживает без каких-либо повреждений);
- с 11-го дня до третьей недели (после 11-го дня начинается органогенез, поэтому данный период максимально опасен с точки зрения формирования врожденных аномалий);
- с четвертой по девятую неделю (лекарственные средства могут нарушать рост и функционирование нормально сформированных органов);
- с девятой недели до родов (возможно нарушение метаболических процессов и постнатальных функций).
Женщина должна быть информирована о токсическом и тератогенном воздействии лекарственных средств и, планируя беременность, своевременно обсуждать с врачом ее ведение.
Препараты, токсическое и тератогенное действие которых известно, должны быть отменены. Возможно, при глаукоме начальных стадий отмена препаратов на девять месяцев не окажет повреждающего действия на зрительные функции. Если отмена препаратов невозможна, необходимо выбрать наиболее безопасное средство в низких дозах. Минимизировать системное воздействие глазных капель можно, обучив беременную осторожно нажимать пальцем на область внутреннего угла глаза после закапывания [86, 87]. Во время кормления грудью такие препараты, как бета-блокаторы и ИКА, отменяются. Лазерное лечение проводится по показаниям с целью отмены гипотензивной терапии или уменьшения количества препаратов и кратности закапываний. При угрозе прогрессирования глаукомной нейропатии хирургическое лечение целесообразно проводить до наступления беременности. Однако следует учитывать, что хирургическое лечение не всегда позволяет добиться необходимого результата у пациентов молодого возраста.
Приходится констатировать, что консервативное лечение глаукомы во время беременности остается нерешенной проблемой из-за риска тератогенности, побочных эффектов и токсического воздействия препаратов на плод.
O.A. Kiselyova, L.V. Yakubova, S.M. Kosakyan, L.V. Vasilenkova
The Helmholtz Moscow Research Institute of Eye Diseases
Contact person: Liya Vagizovna Yakubova, info@igb.ru, yakoubova@yandex.ru
In the recent years the doctors have become more likely to face with the problems of diagnosis and treatment glaucoma during pregnancy and in the postpartum period. In the modern world more women give birth in adulthood, when pregnancy can be associated with an increased risk of the development and progression of glaucoma. In childbearing age, the children's and youthful form of glaucoma prevails among women, and may also be secondary, as a complication of other eye and systemic diseases. Treatment of glaucoma in women during the pregnancy is still an unresolved problem due to fears of toxic effects, teratogenicity and side effects of drugs on the fetus, as well as on the course of the pregnancy itself. The review discusses diagnostic methods, the possibility of conservative, laser and surgical treatment of glaucoma during pregnancy in women.