Возможности патогенетической терапии при лекарственных поражениях печени
- Аннотация
- Статья
- Ссылки
![Таблица 1. Критерии, позволяющие различить токсические и идиосинкразические поражения печени при действии экзогенных веществ [4]](/upload/resize_cache/iblock/023/195_350_1/ursosan1.jpg)
Одной из актуальных проблем современной медицины является полипрагмазия. Употребление пациентами различных лекарственных средств постоянно растет как в связи с назначениями врачей, так и без них. При этом практически любой лекарственный препарат (ЛП) способен вызвать поверждение печени. Гепатотоксичность лекарственного препарата является причиной желтухи в 2–5% случаев среди всех госпитализированных больных и в 25–50% случаев фульминантной печеночной недостаточности (ФПН). Лекарственные поражения печени (ЛПП) являются причиной развития фульминантного гепатита (ФГ) в 12% случаев. Исключением является парацетамол, который сам по себе является причиной почти половины случаев ФГ [2, 10, 20].
Патогенез лекарственных поражений печени
По гепатотоксичности выделяют две основные группы препаратов (табл. 1).
- Обладающие непосредственной токсичностью, определяемой превышением разовых и курсовых доз (истинная дозозависимая гепатотоксичность).
- Вызывающие повреждение печени у лиц с индивидуальной непереносимостью данного препарата, не зависящие от дозы [20, 23, 27], по типу реакции идиосинкразии.
К первой группе (истинные гепатотоксины) относят гепатотоксины прямого (например, парацетамол) и опосредованного действия (антиметаболиты и родственные соединения). Последние вызывают поражение гепатоцитов в результате метаболичесикх реакций в организме. Среди гепатотоксинов опосредованного действия выделяют препараты с цитотоксическим (тетрациклин), холестатическим (анаболики) и канцерогенным эффектом [1, 2, 10, 12].
Однако большинство лекарственных реакций обусловлено идиосинкразией. Любой лекарственный препарат, независимо от используемой дозы, может вызвать реакцию идиосинкразии, которая возникает, как правило, через определенный промежуток времени и может привести к летальному исходу, если препарат не отменить. Вместе с тем при использовании некоторых ЛП (например, изониазида) может развиться повреждение печени, которое самостоятельно регрессирует даже при продолжении лечения [1, 11, 12, 20].
Мишенью действия препаратов могут быть либо транспортные системы мембран клеток печени, либо эпителий желчных протоков [13, 14, 18]. Для лекарственного гепатита характерно повреждение митохондрий и микросом, некроз гепатоцитов, стеатоз, холестаз. Часто развиваются аутоиммунные повреждения, фиброз, редко – канцерогенез.
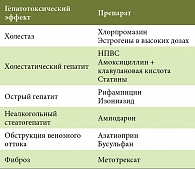
Чаще всего некроз гепатоцитов вызывают диклофенак, парацетамол, ловастатин, изониазид; холестаз – эстрогены, макролиды, хлорпромазин; стеатоз – амиодарон, тамоксифен, ацетилсалициловая кислота, нуклеозидные аналоги, аутоиммунные повреждения – метилдопа, нитрофурантоин, ловастатин, фиброз – метотрексат, ретинол, опухоли – анаболические стероиды, пероральные контрацептивы.
Некоторые типичные гепатотоксические эффекты представлены в таблице 2 [3].
Печень является важнейшим органом метаболизма ЛП, в первую очередь при пероральном приеме.
Большинство лекарственных препаратов проникает через мембрану гепатоцитов посредством диффузии из синусоидов, далее связывается со специфическими внутриклеточными белками, которые транспортируют ЛП в эндоплазматический ретикулум, где осуществляются основные процессы метаболизма, а также в желчные канальцы, транспортные белки которых участвуют в экскреции метаболитов в желчь.
Метаболизм лекарств в печени осуществляется в три этапа:
- гидроксилирование (окисление) с участием ферментов цитохрома Р-450;
- биотрансформация (связывание метаболитов ЛП с глутатионом, сульфатом, глюкуронидом с формированием нетоксичных гидрофильных соединений);
- активный транспорт конъюгированных лекарственных метаболитов и их выделение с желчью и мочой [1, 2, 10, 11, 20].
Особенности метаболизма лекарств в печени определяются индивидуальными отличиями в структуре и функции окислительных систем и систем ацетилирования. Система цитохрома Р-450 имеет в своем составе более 50 изоферментов, которые кодируются различными генами. Изменение активности ферментов может стать причиной развития реакций идиосинкразии к отдельным препаратам. Так, повышение активности цитохромов Р-450 в результате их индукции (например, на фоне алкогольной интоксикации, курения, применения фенобарбитала, фенитоина, употребления грейпфрутового сока) приводит к изменению концентрации препаратов в плазме, что, в свою очередь, сопровождается резким повышением выработки токсичных метаболитов [2, 10, 11, 20].
Известны основные формы повреждения печени лекарственными препаратами: митохондриальная цитопатия, реакции гиперчувствительности, стеатогепатит, холестаз.
Митохондриальная цитопатия возникает в результате непосредственной или опосредованной (через снижение продукции АТФ) ингибиции ферментов дыхательной цепи. Недостаток аэробного окисления в отсутствие метаболизма свободных жирных кислот приводит к накоплению лактата и свободных радикалов. Токсические метаболиты экскретируются желчью и повреждают эпителий желчных канальцев. Митохондриальные цитопатии возникают при приеме антибиотиков тетрациклинового ряда (доксициклин, хлортетрациклин, метациклин), вальпроата натрия, аспирина и антиретровирусных (АРВ) препаратов [2, 5, 9].
Лекарственный стеатогепатит может развиться при приеме синтетических эстрогенов, амиодарона, ацетилсалициловой кислоты, триметоприма/сульфаметоксазола, антагонистов кальция, аминохинолонов (делагил, плаквенил), АРВ-препаратов. Угнетение бета-окисления жирных кислот в митохондриях при токсическом воздействии ЛП нарушает процессы переноса электронов в дыхательной цепи, что способствует активации перекисного окисления липидов. Исходом лекарственного стеатогепатита может быть развитие цирроза печени. В редких случаях, преимущественно на фоне мелкокапельной жировой дистрофии, может развиться фульминантный гепатит [2, 5, 11, 19].
Лекарственное поражение печени по типу реакции гиперчувствительности обычно развивается через 2–4 недели лечения, особенно при повторном назначении препарата (нестероидные противовоспалительные препараты, тиреостатики, препараты хинина, противосудорожные средства, сульфаниламиды). Возможен как гепатоцеллюлярный, так и холестатический тип поражения печени [12, 20, 23].
Развитие лекарственного холестаза обусловлено нарушением транспорта желчи, не зависящего от желчных кислот, подавлением активности Na+-, K+-АТФазы, уменьшением текучести мембран синусоидов, нарушением плотности межклеточных контактов, снижением сократительной способности околоканальцевых микрофиламентов. Внутрипеченочный холестаз сопровождается гепатотоксичностью в связи с выраженными детергентными свойствами желчных кислот (ЖК), необходимыми для растворения желчи и эмульгирования жиров в просвете кишечника.
Накопление в печени ЖК приводит к гибели гепатоцитов в результате двух механизмов:
- некроз клеток из-за снижения резистентности мембран и эмульгации их липидного бислоя;
- апоптоз вследствие активации на мембранах клеточных «рецепторов смерти» Fas, TRAIL-R2, TNF-R1.
Роль апоптоза гепатоцитов в развитии ЛПП возрастает при наличии синдрома эндотоксикоза, который развивается в результате опухолевой интоксикации и массивного лизиса опухолевой ткани в ответ на введение противоопухолевых препаратов, а также у больных с фоновыми вирусными заболеваниями печени (хронические вирусные гепатиты В и С) при проведении противовирусной терапии.
Гепатоцеллюлярный ответ на эндотоксемию проявляется продукцией и высвобождением белков острой фазы, ингибированием глюконеогенеза, выходом кислых органических анионов (лактата) в кровь, снижением белково-синтетической функции печени, стимуляцией синтеза и секреции первичных медиаторов воспаления – провоспалительных цитокинов (фактора некроза опухоли альфа (TNF-α), интерлейкинов IL-6, IL-8). В результате действия TNF-α происходит разобщение процессов окисления и фосфорилирования, что приводит к индукции гепатоцеллюлярного апоптоза. Кроме того, избыточная секреция TNF-α ведет к увеличению объема гепатоцитов, что сопровождается быстрым формированием гепатомегалии.
Основная причина развития канальцевого холестаза – прием гормональных препаратов, содержащих в своем составе циклопентанпергидрофенантреновое кольцо – андрогенов и эстрогенов. Как правило, это пероральные эстроген- и гестагенсодержащие контрацептивы, андрогенные и анаболические стероиды. Степень выраженности холестаза зависит от содержания в препарате активных ингредиентов. Основное повреждающее действие оказывают эстрогены, прогестины могут его потенцировать. В результате приема гормональных препаратов нарушается ток желчи по канальцам, что, по-видимому, вызвано подавлением активности Na+-, К+-АТФазы. Снижается текучесть мембран синусоидов. Нарушение плотности контактов повышает проницаемость стенки канальцев. Поражение цитоскелета приводит к снижению сократительной способности околоканальцевых микрофиламентов и к канальцевому холестазу [16]. Подобное поражение печени может также вызывать циклоспорин А. Канальцевый холестаз как проявление ЛПП встречается в клинической практике наиболее часто.
Паренхиматозно-канальцевый холестаз чаще всего развивается на фоне приема хлорпромазина, сульфаниламидов, полусинтетических и синтетических пенициллинов, макролидов, блокаторов гистаминовых рецепторов 2-го типа, пероральных сахароснижающих препаратов – производных сульфонилмочевины.
Развитие билиарного сладжа на фоне приема некоторых лекарств объясняется изменением физико-химических свойств желчи в результате нарушения транспорта желчных кислот в печени и/или повышенным выделением липидов в желчь. Повышенная экскреция липидов в желчь отмечается при приеме фибратов; сгущение желчи в результате кристаллизации лекарственных веществ, выделяющихся с желчью, возможно при лечении цефтриаксоном и цефтазидимом.
Сосудистые/синусоидальные поражения. Некоторые препараты, в частности алкилирующие агенты, применяемые в онкологии, могут повреждать сосудистый эндотелий с развитием обструкции венозного оттока от печени. Известно, что длительный прием витамина А в чрезмерных дозах может приводить к повреждению синусоидов и развитию фиброза, в единичных случаях – к формированию портальной гипертензии [3].
Клиническая картина ЛПП
Клиническая картина ЛПП характеризуется многообразием симптомов, отсутствием их специфичности и большой вариабельностью проявлений: от изолированного острого гепатита умеренной активности (желтуха, кожный зуд, лихорадка, тошнота, снижение аппетита) до активного гепатита с системными поражениями (геморрагический синдром, васкулиты, слюнотечение, ринит, лимфоаденопатия, миалгии, артралгии, эозинофилия, гемолиз и др.). В некоторых случаях в крови обнаруживаются аутоантитела.
Основным клиническим признаком канальцевого холестаза является кожный зуд. Тяжелое нарушение функции митохондрий сопровождается выраженными нарушениями гомеостаза и такими клиническими проявлениями, как гипераммониемия, лактацидоз, гипогликемия, полинейропатия, диспепсический синдром [2, 5, 9, 22, 23].
Аллергические гепатиты часто ассоциируются с лихорадкой, сыпью, артритом, кожным васкулитом, эозинофилией, гемолизом.
Лабораторная диагностика ЛПП
По типу биохимических изменений выделяют:
- печеночно-клеточный тип поражения, характеризующийся повышением уровня аланиновой аминотрансферазы (АЛТ) более 2 норм;
- холестатический тип, характеризующийся повышением уровня щелочной фосфатазы (ЩФ) более 2 норм;
- смешанный тип, при котором повышен уровень обоих ферментов.
Одним из основных диагностических критериев ЛПП является нормализация биохимических проб после отмены препарата.
Диагностика и дифференциальная диагностика ЛПП
Диагностика медикаментозного поражения печени базируется прежде всего на анамнестических данных: прием гепатотоксичных препаратов или идиосинкразия на медикаменты в анамнезе. Необходимо получить информацию обо всех принимаемых пациентом препаратах (назначенных врачом и принимаемых самостоятельно) и уточнить информацию о гепатотоксичности этих лекарств по данным литературы. Важным моментом является выяснение временного интервала между приемом препарата и началом заболевания – обычно от 4 дней до 8 недель [3]. Необходимо оценить эффект отмены препарата на основании функциональных биохимических проб (при цитолитическом типе поражения – около 2 месяцев, при холестатическом или смешанном – до 6 месяцев). В обязательном порядке исключаются вирусные гепатиты и заболевания желчных протоков. Для диагностики ЛПП и дифференциальной диагностики может потребоваться пункционная биопсия.
Морфологические изменения печени при ЛПП
Наиболее типичные морфологические признаки ЛПП включают гранулемы, значительную примесь эозинофилов в воспалительном инфильтрате, четкую зону демаркации между участком некроза и непораженной паренхимой, а также выраженные «пестрые» некрозы, нередко – вовлечение в процесс желчных канальцев.
Морфологическими характеристиками лекарственного холестаза являются признаки собственно холестаза, в большей степени в III и I зонах ацинуса, повреждение гепатоцитов, выраженная воспалительная инфильтрация (преимущественно в портальных трактах) с большим количеством эозинофилов, образование гранулем [10].
Морфологическая картина при цитолитическом типе лекарственного поражения печени характеризуется наличием некрозов и воспалительной инфильтрации различной степени выраженности с локализацией в дольках и перипортальных областях, высоким содержанием в инфильтрате плазматических клеток.
Японские исследователи опубликовали результаты изучения 26 случаев различных по длительности острых лекарственных гепатитов, вызванных тиопромином, хлорпромазином, диклофенаком. В биоптате были выявлены значительные различия в зависимости от длительности заболевания: незначительно выраженные воспаление и каналикулярный холестаз при коротком анамнезе, по мере увеличения длительности ЛПП холестаз прогрессировал вплоть до исчезновения части желчных протоков [26]. В процессе длительного течения ЛПП формируется выраженный фиброз.
Лечение лекарственных поражений печени
Основа лечения ЛПП – отмена любого потенциально гепатотоксического препарата. В случае гепатоцеллюлярного типа лекарственного гепатита отмена препарата обычно приводит к улучшению биохимических показателей в течение 2–4 недель. При холестатическом или смешанном типе поражения печени процесс восстановления функции органа значительно дольше – положительная динамика обычно отмечается не ранее чем через 4–6 недель.
В патогенетической терапии лекарственных поражений печени важное значение имеет урсодеоксихолевая кислота (УДХК) – гидрофильная нетоксичная третичная желчная кислота, образующаяся под действием бактериальных ферментов из 7-кето-литохолевой кислоты. После перорального приема УДХК абсорбируется за счет неионной диффузии (в основном в тонком кишечнике, в меньшей степени – в ободочной кишке) и поступает в печень по системе воротной вены. При систематическом приеме концентрация УДХК в желчи коррелирует с суточной дозой препарата.
Механизм действия УДХК (Урсосан) обусловлен ее способностью замещать токсичные эндогенные желчные кислоты на нетоксичные гидрофильные. На фоне продолжительной терапии УДХК происходит дозозависимое изменение соотношения солей желчных кислот в желчи: УДХК становится основным компонентом (более 50%), тогда как содержание хенодезоксихолевой, дезоксихолевой, холевой кислот существенно снижается.
УДХК (Урсосан) частично уменьшает всасывание желчных кислот в кишечнике, следствием чего является формирование гидроксильного (нетоксичного) их пула. Прием препарата уменьшает энтерогепатическую циркуляцию гидрофобных желчных кислот, предупреждая их токсический эффект на мембраны гепатоцитов и эпителий желчных протоков.
Показано, что на клеточном уровне УДХК (Урсосан) обеспечивает такие важные при лечении ЛПП процессы, как:
- транскрипционная регуляция каналикулярных транспортных белков;
- стимуляция везикулярного экзоцитоза посредством сложной передачи сигналов и включения белков-переносчиков в апикальную мембрану гепатоцитов;
- модуляция апикальной секреции гепатоцитов путем регуляции фосфорилирования и дефосфорилирования транспортных белков в местах их действия;
- регуляция проницаемости митохондриальной мембраны;
- встраивание в фосфолипидный бислой мембран и защита от эмульгирующего действия гидрофобных ЖК;
- модуляция структуры и состава богатых фосфолипидами смешанных мицелл в желчи;
- угнетение активаторов фиброгенеза (уменьшение освобождения митохондриального цитохрома С, активности звездчатых клеток);
- уменьшение перисинусоидального коллагенообразования [15, 19, 25].
УДХК (Урсосан) обладает также антиоксидантным действием, что способствует снижению иммуносупрессии, опосредованной лекарственным холестазом. Кроме этого, УДХК осуществляет модуляцию клеточного иммунитета – реверсию аберрантной экспрессии молекул HLA класса І на гепатоцитах, значительно снижая уровень циркулирующих медиаторов воспаления и цитокинов. Существует также предположение о возможной роли УДХК в индукции цитохрома Р-450 3А4 (CYP3А4), ферментов, метаболизирующих ЖК, лекарственные препараты и холестерин [24]. Важен и гипохолестеринемический эффект препарата, осуществляемый за счет уменьшения синтеза холестерина в печени, снижения его экскреции в желчь и подавления всасывания его в кишечнике. Антиапоптическая активность и способность УДХК (Урсосан) влиять на основные патогенетические звенья возникновения внутрипеченочного холестаза обусловливают целесообразность ее применения для лечения ЛПП и с целью профилактики холестатического поражения печени, в частности, при онкологических заболеваниях [8].
Применение УДХК (Урсосан) обеспечивает цито- и гепатопротективный, антихолестатический, антифибротический, иммуномодулирующий, антиапоптический эффект.
Терапия УДХК предупреждает возникновение и/или прогрессирование внутрипеченочного холестаза при лечении эстрогенами, особенно у женщин с наследственной предрасположенностью к развитию холестаза беременных. Описаны положительные эффекты УДХК в лечении холестатических поражений печени, вызванных приемом комбинированных оральных контрацептивов, анаболических стероидов, хлорпромазина, изофлурана, каротина, даназола, антибиотиков. УДХК эффективна также в комплексной терапии после трансплантации печени, сердца и костного мозга [6, 8, 15].
Целесообразность и преимущество применения УДХК при ЛПП обусловлено избирательностью ее цитопротекторного действия по отношению к гепатоцитам и холангиоцитам [15, 24].
Целесообразность назначения УДХК в дозе 1000 мг убедительно показана при остром лекарственном гепатите, вызванном приемом 6-меркаптопурина у больных острым миелобластным лейкозом.
Проводились исследования эффективности УДХК (Урсосан) в лечении синдрома холестаза у больных гемобластозами в отдаленном периоде клинико-гематологической ремиссии. После проведения больным патогенетического лечения цитостатиками синдром холестаза выявили более чем у 50% больных [8]. По результатам исследований, проведенных в Новосибирской государственной медицинской академии, установлена высокая эффективность УДХК (Урсосан) в снижении и разрешении симптомов лекарственного холестаза при лечении больных гемобластозами: уменьшение кожного зуда в 60% случаев, содержания билирубина – на 75%, холестерина – на 70%, снижение активности гаммаглутамилтранспептидазы (ГГТП) и ЩФ более чем в 2 раза. Проведение в динамике морфологического исследования ткани печени 10 больным показало исчезновение гистологических признаков холестаза в 100% случаев, отмечено также уменьшение выраженности дистрофии гепатоцитов и лимфогистиоцитарной инфильтрации [8].
В последние годы УДХК все чаще применяется при ЛПП, развивающихся на фоне гиполипидемической терапии, в частности статинами [7]. Получены положительные результаты при одновременном приеме УДХК (Урсосан) и статинов: биохимические проявления цитолиза и холестаза снижаются или полностью регрессируют. Это позволяет рекомендовать УДХК для предупреждения развития ЛПП при проведении агрессивной медикаментозной терапии, направленной на устранение атерогенной дислипидемии.
Терапия препаратами УДХК хорошо переносится. Суточная доза препарата рассчитывается по массе тела (10–15 мг/кг) и принимается три раза в день после еды.
Прогноз ЛПП в разных клинических ситуациях различается, однако при развитии желтухи смертность может достигать 10%. Трансплантацию печени производят в случаях тяжелой острой гепатотоксичности, что позволяет выжить 80% больных при своевременном ее проведении.
