количество статей
6422
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Значение инфекций, обусловленных образованием биопленок, в урологической практике
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4 (37)
- Аннотация
- Статья
- Ссылки
- English
В статье обсуждается роль биопленок в развитии хронического бактериального простатита, рецидивирующего цистита, пиелонефрита. Рассматриваются методы профилактики формирования биопленок, в том числе путем модификации поверхности биоматериалов. Подчеркивается необходимость применения антимикробных препаратов с доказанной эффективностью в отношении бактериальных биопленок.
В статье обсуждается роль биопленок в развитии хронического бактериального простатита, рецидивирующего цистита, пиелонефрита. Рассматриваются методы профилактики формирования биопленок, в том числе путем модификации поверхности биоматериалов. Подчеркивается необходимость применения антимикробных препаратов с доказанной эффективностью в отношении бактериальных биопленок.
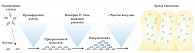
Рис. 1. Создание биопленки из планктонных клеток
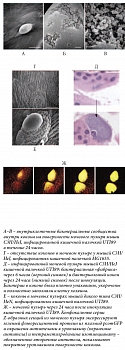
Рис. 2. Внутриклеточные бактериальные сообщества. Инфицированные мочевые пузыри были разрезаны, фиксированы и исследованы с помощью сканирующей электронной микроскопии или световой микроскопии (окраска гематоксилином и эозином)

Рис. 3. Биопленки внутри уретрального катетера
Введение
Около 65% инфекций в настоящее время обусловлено биопленками (англ. biofilm – биофильм) – скоплением микроорганизмов и их внеклеточных продуктов, формирующих структурное сообщество на неживой или живой поверхности [1]. Широкое применение в урологической практике биоматериалов и искусственных материалов (катетеры, дренажи, стенты, сфинктеры, нити, сетки, протезы), на поверхности которых формируются биопленки, повышает риск персистенции инфекции в организме. Этому же способствуют получившие распространение современные методы хирургического лечения. Широкое применение малоинвазивных, высокотехнологичных операций с дроблением камней вместо удаления камня целиком, а также послойное вскрытие инфицированных протоков предстательной железы во время трансуретральной резекции под давлением ирригационной жидкости увеличивает риск выхода микроорганизмов из очагов-биопленок, локализующихся в камнях и простате. Это может привести к развитию синдрома системного воспалительного ответа (уросепсиса) и острого инфекционно-воспалительного заболевания.
Недавно были опубликованы результаты метаанализа работ, посвященных урологическим инфекциям, вызванным образованием биопленок [2]. Из 1350 идентифицированных по ключевым словам работ за период с 1985 по февраль 2011 г. пригодными были признаны 95. Для анализа были отобраны 34 публикации, которые были распределены в соответствии с уровнем доказательств Оксфордского центра доказательной медицины (Oxford Centre for Evidence-based Medicine) [3].
Механизм формирования биопленок
Биопленка – это структурное сообщество микроорганизмов, инкапсулированных в саморазвитом полимерном матриксе, адгезированное к биотической или абиотической поверхности [4].
Начальным этапом формирования биопленки в мочевых путях является отложение мочевых компонентов на биоматериалах. На инородном теле еще до адгезии микробов начинают откладываться гликопротеины Tamm – Horsfall, ионы, полисахариды и т.д. Многие из этих молекул являются протеинами, которые облегчают адгезию, обеспечивая рецепторные места для бактериальных адгезинов. Таким образом создается условная пленка, которая меняет поверхностные характеристики инородных тел. Условная пленка играет важную роль в формировании биопленки, поскольку многие патогены не способны прикрепляться непосредственно к «голым» поверхностям имплантов. Кроме того, наличие условной пленки позволяет прикрепляться микробам даже к имплантам с модифицированными поверхностными характеристиками (покрытия, импрегнация) [2].
Следующий шаг – приближение и прикрепление микроорганизмов. Бактерии начинают реагировать с поверхностью, когда «чувствуют» ее «близость». Планктонные (плавающие) бактериальные клетки высвобождают протоны и сигнальные молекулы. Если плотного контакта с любой поверхностью не произошло, то они рассеиваются прочь от флотирующих клеток. В свою очередь плотный контакт протонов с поверхностью приводит к высокой концентрации протонов и снижению диффузии. При этом бактериальные клетки «чувствуют», что они близко к поверхности, и вслед за этим начинается активный процесс адгезии. Начальная адгезия носит обратимый характер с вовлечением гидрофобных и электростатических сил, после чего идет необратимое прикрепление, обеспечивающееся бактериальными полисахаридами.
Финальная стадия – это формирование структуры биопленки. Развитая биопленка состоит из группы микроорганизмов, отделенных интерстициальными пространствами, которые заполнены окружающей жидкостью. Основной структурной единицей биопленки является микроколония, которая на 10–25% состоит из микробных клеток, а на 75–90% – из экзополисахаридного матрикса, в зависимости от вида вовлеченных микроорганизмов. Биопленка также содержит водные каналы, через которые поступают дополнительные питательные вещества и кислород, необходимые для роста клеток [5]. Развитая биопленка состоит из 3 слоев клеток (рис. 1):
Около 65% инфекций в настоящее время обусловлено биопленками (англ. biofilm – биофильм) – скоплением микроорганизмов и их внеклеточных продуктов, формирующих структурное сообщество на неживой или живой поверхности [1]. Широкое применение в урологической практике биоматериалов и искусственных материалов (катетеры, дренажи, стенты, сфинктеры, нити, сетки, протезы), на поверхности которых формируются биопленки, повышает риск персистенции инфекции в организме. Этому же способствуют получившие распространение современные методы хирургического лечения. Широкое применение малоинвазивных, высокотехнологичных операций с дроблением камней вместо удаления камня целиком, а также послойное вскрытие инфицированных протоков предстательной железы во время трансуретральной резекции под давлением ирригационной жидкости увеличивает риск выхода микроорганизмов из очагов-биопленок, локализующихся в камнях и простате. Это может привести к развитию синдрома системного воспалительного ответа (уросепсиса) и острого инфекционно-воспалительного заболевания.
Недавно были опубликованы результаты метаанализа работ, посвященных урологическим инфекциям, вызванным образованием биопленок [2]. Из 1350 идентифицированных по ключевым словам работ за период с 1985 по февраль 2011 г. пригодными были признаны 95. Для анализа были отобраны 34 публикации, которые были распределены в соответствии с уровнем доказательств Оксфордского центра доказательной медицины (Oxford Centre for Evidence-based Medicine) [3].
Механизм формирования биопленок
Биопленка – это структурное сообщество микроорганизмов, инкапсулированных в саморазвитом полимерном матриксе, адгезированное к биотической или абиотической поверхности [4].
Начальным этапом формирования биопленки в мочевых путях является отложение мочевых компонентов на биоматериалах. На инородном теле еще до адгезии микробов начинают откладываться гликопротеины Tamm – Horsfall, ионы, полисахариды и т.д. Многие из этих молекул являются протеинами, которые облегчают адгезию, обеспечивая рецепторные места для бактериальных адгезинов. Таким образом создается условная пленка, которая меняет поверхностные характеристики инородных тел. Условная пленка играет важную роль в формировании биопленки, поскольку многие патогены не способны прикрепляться непосредственно к «голым» поверхностям имплантов. Кроме того, наличие условной пленки позволяет прикрепляться микробам даже к имплантам с модифицированными поверхностными характеристиками (покрытия, импрегнация) [2].
Следующий шаг – приближение и прикрепление микроорганизмов. Бактерии начинают реагировать с поверхностью, когда «чувствуют» ее «близость». Планктонные (плавающие) бактериальные клетки высвобождают протоны и сигнальные молекулы. Если плотного контакта с любой поверхностью не произошло, то они рассеиваются прочь от флотирующих клеток. В свою очередь плотный контакт протонов с поверхностью приводит к высокой концентрации протонов и снижению диффузии. При этом бактериальные клетки «чувствуют», что они близко к поверхности, и вслед за этим начинается активный процесс адгезии. Начальная адгезия носит обратимый характер с вовлечением гидрофобных и электростатических сил, после чего идет необратимое прикрепление, обеспечивающееся бактериальными полисахаридами.
Финальная стадия – это формирование структуры биопленки. Развитая биопленка состоит из группы микроорганизмов, отделенных интерстициальными пространствами, которые заполнены окружающей жидкостью. Основной структурной единицей биопленки является микроколония, которая на 10–25% состоит из микробных клеток, а на 75–90% – из экзополисахаридного матрикса, в зависимости от вида вовлеченных микроорганизмов. Биопленка также содержит водные каналы, через которые поступают дополнительные питательные вещества и кислород, необходимые для роста клеток [5]. Развитая биопленка состоит из 3 слоев клеток (рис. 1):
- соединительная, связывающая пленка, которая прикреплена к поверхности ткани или биоматериала;
- основная пленка компактных микроорганизмов;
- поверхностная (наружная) пленка, из которой планктонные микроорганизмы могут высвобождаться, свободно плавать и распространяться над поверхностью.
Роль биопленок в развитии инфекции мочевых путей
Хронический бактериальный простатит
Несмотря на принятую классификацию хронического простатита, дифференциация хронического небактериального и бактериального воспаления все еще дискутируется. Планктонные бактерии в результате уретро-простатического рефлюкса попадают в протоки простаты и ацинусы, где могут безопасно размножаться. При персистенции они могут формировать спорадические бактериальные, адгезированные к эпителию протоков микроколонии, вызывая постоянную иммунную стимуляцию и хроническое воспаление [6]. Колонизированные бактерии не проникают в секрет простаты или образцы мочи, что обусловливает трудность диагностики хронического бактериального простатита. Антимикробная терапия способствует эрадикации планктонных бактерий, но не адгезированной бактериальной биопленки, расположенной глубоко в ткани простаты.
Рецидивирующий цистит
Точный механизм бактериальной адгезии и выживания в мочевых путях еще не ясен. Уропатогенная кишечная палочка (uropathogenic Escherichia coli, UPEC) связывается с поверхностными эпителиальными клетками мочевого пузыря, которые распознают бактериальные адгезины и липополисахариды через Толл-подобные рецепторы и стимулируют миграцию нейтрофилов в слизистую мочевого пузыря. Взаимодействия с эпителием, опосредованные фимбриями 1-го типа кишечной палочки, стимулируют отшелушивание поверхностно расположенных эпителиальных клеток, вызывая распространение инфекции и бактериурию. Несмотря на воспалительный ответ и эпителиальное отшелушивание, UPEC способна достичь высоких титров в моче в течение нескольких дней и при хроническом воспалении может персистировать в течение длительного времени.
Было установлено, что бактерии сначала размножаются внутриклеточно, формируя дезорганизованные кластеры-скопления, что подтверждается в экспериментальных моделях [7, 8] и частично исследованиями с участием больных инфекциями мочевых путей (ИМП) [9]. Соответственно бактерии в кластерах делятся без активного роста, преимущественно вследствие изменений в генетических программах. Более того, кластеры становятся компактными и организуются в биопленкоподобные структуры – так называемые внутриклеточные бактериальные сообщества [7]. Бактерии во внутриклеточном бактериальном сообществе удерживаются вместе экзополимерным матриксом, напоминающим структуру биопленки. При этом бактерии, находящиеся на краю сообщества, становятся подвижными и вследствие несостоятельности мембранной неприкосновенности могут покидать инфицированные клетки мочевого пузыря, что обусловливает высокие титры агента в моче. Однако бактерии во внутриклеточных нишах способны создавать и хронический неподвижный резервуар, который может персистировать нераспознанным в течение нескольких месяцев без попадания бактерий в мочу (рис. 2) [8, 10].
Пиелонефрит
Бактерии способны проникать в уротелий почечных лоханок и почечные сосочки. Как было показано в эксперименте на животных, бактерии могут адгезироваться на уротелии, прежде чем инвазируют ткань почки [11]. Антимикробные агенты более эффективны против подобных биопленок по сравнению с биопленками на катетерах [12], что может быть обусловлено синергичным действием антибактериальных препаратов и факторов защиты хозяина [13].
Формирование биопленок на инородных телах в мочевых путях
Уретральные катетеры
Постоянные уретральные катетеры в 30–80% случаев играют роль входных ворот для госпитальных инфекций, при этом нередко катетер-ассоциированная бактериурия не исчезает после удаления катетера. У пациентов с постоянным уретральным катетером часто возникают различные осложнения: острый пиелонефрит, цистит, эпидидимит, абсцессы простаты, бактериемия, септицемия, стриктуры уретры, в связи с чем смертность в этой группе больных увеличивается почти в 3 раза, а у пациентов со спинальными повреждениями этот показатель достигает 20–40% [14].
С момента установки внутренняя и наружная поверхности уретрального катетера становятся мишенью для формирования биопленки. При экстралюминарном пути инфицирования микроорганизмы (как правило, эндогенные микроорганизмы, населяющие желудочно-кишечный тракт) распространяются восходящим путем по уретре во время и после установки катетера. При интралюминарном пути инфицирования бактерии могут восходить по внутреннему просвету катетера (рис. 3). В этом случае микроорганизмы имеют экзогенную природу, например микрофлора кожи рук здорового медицинского персонала.
Чаще всего катетеры инфицированы Enterococcus faecalis, Pseudomonas aeruginosa, Escherichia coli. Наиболее сильными продуцентами биопленок являются Proteus mirabilis, Enterococcus faecalis, Candida tropicalis, Staphylococcus aureus [15].
Клиническое значение инфекций мочевых путей, обусловленных формированием биопленок на уретральных катетерах, огромно. Это связано с возможным развитием непредсказуемых осложнений (от бессимптомной бактериурии до эндотоксического шока) вследствие экзо- и эндотоксинов, вырабатываемых микроорганизмами и попадающих в кровоток через поврежденные ткани мочевого пузыря.
Мочеточниковые стенты
Бактериальные биопленки могут также развиваться на внутренних стентах, установленных в верхние мочевые пути. Было показано, что 68–90% мочеточниковых стентов колонизируются, в то время как бактериурия имеет место только у 27–30% пациентов со стентами [16, 17]. Этот факт обусловливает трудность выявления биопленок в обычных лабораториях. Тем не менее отрицательный культуральный анализ мочи не исключает возможности колонизации стента.
Частой проблемой при использовании медицинских биоматериалов является инкрустация, особенно при уреаза-продуцирующих бактериях, таких как Proteus mirabilis, Pseudomonas aeruginosa, Staphylococcus spp., Staphylococcus aureus, Moraxella catarrhalis, Enterococcus faecalis, Klebsiella pneumoniaе и др. Уреаза-продуцирующие возбудители мочевой инфекции расщепляют мочевину в моче на аммиак и водород, что приводит к изменению состава мочи, повышению pH, оседанию струвита (аммония-магния фосфат) и апатита (кальция фосфат) на эпителий мочевых путей, а также на поверхность катетеров, стентов, камней. Уреаза Proteus mirabilis гидролизирует мочевину мочи в аммиак от 6 до 10 раз быстрее, чем уреаза других видов [18].
Формирование биопленки и инкрустация также ограничивают эффективность применения различных катетеров с антимикробным покрытием, потому что отложение кристаллов на катетерах позволяет бактериям прикрепляться и размножаться без контактирования с защитным покрытием [19].
Инфицированные мочевые камни
Бактерии, инфицирующие мочевые пути, способствуют не только хронизации инфекции в результате повышенной устойчивости к терапии, но и образованию новых камней. Инфицированные камни растут быстро, защищая бактерии, образующие биопленку [20]. При дроблении камней (дистанционном, контактном) необходимо учитывать возможность выхода микроорганизмов и их токсинов из камней, что в условиях повышенного внутрилоханочного давления из-за постоянной ирригации жидкости, особенно при длительной операции, увеличивает риск развития бактериемии, токсинемии, синдрома системной воспалительной реакции и септических осложнений. Остатки конкрементов и биопленок служат основой для быстрого рецидива камнеобразования, поэтому важно полностью удалить все фрагменты инфицированных камней в ходе операции.
В отечественных исследованиях было продемонстрировано различие в результатах бактериологического исследования мочи и камней [21]. У пациентов с мочекаменной болезнью микроорганизмы при исследовании камня выявлялись чаще, чем при исследовании мочи: 59,4% по сравнению с 33,3%. Виды микроорганизмов в моче и камне не различались и были представлены такими уропатогенами, как Enterococcus faecalis, Klebsiella pneumoniae, Pseudomonas aeruginosa, Streptococcus haemolyticus, Proteus mirabilis и Escherichia coli.
Остатки биопленок на слизистой лоханки почки и бактериурия являются основными факторами риска рецидива камнеобразования в послеоперационном периоде. Фрагменты удаленных камней, которые необходимо забирать в стерильных условиях операционной, рекомендуется исследовать бактериологически. Длительное применение антибиотиков с учетом результатов бактериологических анализов мочи и камней, а также метафилактика являются наиболее эффективными методами лечения.
Артифициальные мочевые сфинктеры
Около 3% артифициальных мочевых сфинктеров оказываются инфицированными. Уменьшить риск инфицирования можно путем лечения предшествующей ИМП, предупреждения длительной ретенции мочевых путей и снижения количества остаточной мочи в мочевом пузыре. Первым шагом элиминации инфекции является полное удаление импланта. Реимплантации должна предшествовать полная санация мочевых путей [22].
Пенильные протезы
Инфекция, развивающаяся на пенильных протезах, чаще всего вызвана стафилококками, в особенности Staphylococcus epidermidis, которые имеют повышенную способность продуцировать гликокаликс биопленки. Чаще всего инфекция вторична и определяется по результатам бактериологического анализа мочи во время операции. В этой связи необходимо учитывать наиболее этиологически значимые патогены при выборе антибиотиков для профилактики. Культуральные анализы с выявленным 90%-ным ростом стафилококковой инфекции были положительны у 70% пациентов с клинически неинфицированными пенильными протезами во время ревизии по поводу механического нарушения функции протеза [23].
С целью уменьшения риска развития инфекции были разработаны пенильные протезы с гидрофильным покрытием, которые уменьшали бактериальную адгезию in vitro и в моделях на животных [24]. Покрытие подтвердило способность абсорбировать антибиотики интраоперационно, тем самым содействуя их поступлению в окружающие ткани в послеоперационном периоде и эрадицикации возбудителей инфекции. Однако данные по пенильным протезам с гидрофильным покрытием ограничены.
Применение пенильных протезов с покрытием комбинации рифампицина и миноциклина было одобрено в 2001 г. Использование этих протезов позволило снизить уровень инфицированности на 58% по сравнению с применением имплантов без покрытия [25].
Методы профилактики формирования биопленок в мочевых путях
Методы общей профилактики
Среди наиболее эффективных методов общей профилактики формирования биопленок в мочевых путях следует выделить обязательное мытье рук пациента и медицинского персонала перед каждым контактом с катетером и дренажной системой, а также предупреждение разъединения закрытых дренажных систем и соблюдение их правильного расположения на постели больного [26]. Местная защита на уровне уретры и мочевого пузыря предполагает обработку наружного отверстия уретры, асептический метод введения катетера, использование антимикробных мазей, Катеджеля, Инстиллагеля.
Модификация поверхности биоматериала
Долгое время многообещающей стратегией профилактики формирования бактериальных биопленок считалась модификация поверхности имплантов и катетеров.
Катетеры, импрегнированные антибиотиками. В недавнем Кохрейновском обзоре были представлены данные о значительном снижении уровня бессимптомной бактериурии при использовании катетеров, импрегнированных антибиотиками, по сравнению с катетерами без покрытия (миноциклин, рифампицин и нитрофуразон, срок – менее чем одна неделя катетеризации) [27]. При более длительном сроке катетеризации различия были статистически недостоверными, что авторы связали с малочисленностью данных.
Покрытие сплавом серебра. В том же обзоре отмечено, что покрытые серебряным сплавом катетеры значительно уменьшали риск возникновения бессимптомной бактериурии (катетеризация менее чем в течение одной недели) [27]. При катетеризации дольше недели эффект был ниже, но риск бессимптомной бактериурии был все же меньше у пациентов, которым были установлены катетеры, покрытые серебряным сплавом. В отношении более длительной катетеризации достоверных клинических исследований пока не проводилось.
Гидрофильное покрытие. Катетеры с гидрофильным покрытием широко используются при чистой интермиттирующей катетеризации. В проспективном сравнительном многоцентровом исследовании ИМП при использовании гидрофильно-покрытых катетеров развивались реже (64% по сравнению с 82% в группе контроля) [28]. Однако в недавнем рандомизированном контролируемом исследовании не было получено статистически значимых различий в отношении симптоматической ИМП и результатов микробиологических анализов мочи при использовании катетеров с гидрофильным покрытием и непокрытых уретральных катетеров, установленных на период 6 недель [29].
Гепарин. Гепарин может быть использован для антиадгезивного покрытия стентов благодаря строгой электронегативности, которая позволяет «отбрасывать» клеточные организмы. В 1987 г. M.R. Ruggieri и соавт. установили 90%-ное уменьшение бактериальной адгезии на катетерах, покрытых гепарином [30]. На покрытых гепарином уретральных стентах не было определено органических или анорганических отложений после размещения in situ в течение 6 недель по сравнению с тем, что 33% непокрытых стентов были колонизированы биопленками [31]. Другие данные были получены D. Lange и соавт., которые сравнивали стенты, покрытые гепарином, с высвобождением триклозана и невысвобождаемые контрольные уретральные стенты, установленные на период 7 дней. In vitro стенты, покрытые гепарином, не уменьшали бактериальную адгезию по сравнению с использованием непокрытых стентов [32].
Gendine. Gendine – новый антисептик, содержащий горечавку фиолетовую и хлоргексидин. R. Hachem и соавт. сравнили in vitro антиадгезивную активность мочевых катетеров, покрытых Gendine, и непокрытых катетеров в отношении нескольких полирезистентных бактерий. Gendine-покрытые катетеры уменьшали адгезию всех микроорганизмов. С помощью сканирующей электронной микроскопии было показано, что биопленки покрывают контрольные катетеры, но не Gendine-покрытые катетеры. Авторы подтвердили свои результаты in vivo на моделях кроликов [33]. Однако, несмотря на многообещающие предварительные результаты, клинические данные не признаны достоверными.
Триклозан. Триклозан является антибактериальным соединением, которое известно около 40 лет. Триклозан-высвобождаемый стент уменьшает активность ИМП и рост бактериальных колоний в модели цистита, вызванного протейной инфекцией [34]. Мы уже говорили о том, что триклозан-высвобождаемый стент устойчив ко всем бактериям, за исключением синегнойной палочки и энтерококка [32]. На всех триклозан-высвобождаемых стентах были получены зрелые биопленки с низкой жизнеспособностью.
Использование низкоэнергетичных поверхностных звуковых волн
Концепция использования низкой энергии поверхностных звуковых волн предполагает, что акустические волны, направленные прямо на инородные тела в мочевых путях (например, имплантаты), разрушают биопленки посредством ингибирования адгезии планктонных бактерий на их поверхности. Z. Hazan и соавт. предложили метод, который позволяет акустическим волнам распространяться из портативного датчика, генерирующего пьезоэлектрическую вибрацию с частотой, варьирующей от 100 до 300 кГц [35]. Авторы направляли волны, генерируемые датчиком, на катетеры с текущей жидкостью, содержащей разные уропатогены, в течение 3 дней. Применение волнового метода нарушило формирование биопленок, позволяя катетерам фактически очищаться от адгезированных микроорганизмов. Результаты были подтверждены in vivo на кроликах в течение одной недели лечения.
В двойном слепом контролируемом рандомизированном исследовании, касающемся кратковременной катетеризации, применение волновой терапии предотвращало формирование биопленок на всех катетерах, в то время как в контрольной группе биопленки определялись на катетерах в 63% случаев [36].
P. Tеnke и соавт. провели проспективное сравнительное исследование в параллельных группах, оценивавшее эффективность волновой терапии в случае длительной катетеризации (8 недель) [2]. Волновая терапия снижала уровень клинически значимой бактериурии (33% против 81%), частота формирования биопленок была также ниже в группе волновой терапии по сравнению с контролем [37].
Действие антимикробных препаратов на бактерии в биопленке
Большинство исследователей полагают, что антибиотики могут замедлять формирование биопленки только путем элиминации незащищенных планктонных бактерий. Во время острой фебрильной фазы инфекции антимикробная терапия является достаточной, потому что за фебрильную реакцию ответственны именно планктонные бактерии, а не бактерии в биопленке. Однако из поверхностного слоя зрелой биопленки могут высвобождаться планктонные микроорганизмы, которые свободно плавают и распространяются над поверхностью, вызывая бактериурию, а возможно, и бактериемию, эндотоксинемию и другие острые инфекционно-воспалительные осложнения, вплоть до синдрома системной воспалительной реакции и уросепсиса. Уросепсис представляет собой наиболее сильную манифестацию мочевой инфекции. Лечение уросепсиса, в отличие от простой ИМП, включает не только антибактериальную терапию, но и другие меры: восполнение объема жидкости, назначение стероидов, контроль глюкозы крови, экстракорпоральные методы детоксикации, а также контроль источника инфекции (например, дренирование любой обструкции и/или удаление инородных тел из мочевых путей). Эти меры необходимо предпринимать в течение первых часов заболевания [38]. Адекватная начальная эмпирическая антибактериальная терапия подразумевает сначала назначение препарата широкого спектра действия, а затем препарата с узким спектром действия, учитывая данные бактериологического исследования. При уросепсисе или остром пиелонефрите предпочтительно внутривенное применение высоких доз антибиотиков с целью поддержания их высокой концентрации в сыворотке крови и достижения хорошего тканевого проникновения.
Следует отметить, что антибиотики, эффективные против планктонных бактерий, часто не оказывают необходимого антимикробного действия в отношении бактериальных биопленок. Это связано с тем, что выбор антимикробных препаратов основывается на бактериальной культуре, полученной из планктонных бактерий. Между тем планктонные бактерии отличаются по поведению и фенотипическим формам от бактерий в биопленке. Неэффективность антимикробной терапии в лечении инфекции, обусловленной формированием биопленок, могут быть объяснены также тем, что [39]:
Фторхинолоны способны эрадицировать инфекцию, обусловленную формированием биопленок, при условии создания концентрации, превышающей минимально ингибирующую (МИК) в 32–64 раза [44]. По данным K.G. Naber, у здоровых добровольцев после приема 500 мг ципрофлоксацина или 500 мг левофлоксацина последний создает более высокие концентрации в моче и дольше оказывает антибактериальное действие по сравнению с ципрофлоксацином [45]. Несмотря на то что МИК в отношении грамотрицательных микроорганизмов у ципрофлоксацина ниже по сравнению с левофлоксацином, бактерицидные концентрации в моче левофлоксацина были значительно выше и сохранялись дольше. Следовательно, во-первых, для грамотрицательных уропатогенов доза 500 мг левофлоксацина 1 р/сут сравнима с 500 мг ципрофлоксацина 2 р/сут. Во-вторых, для лечения ИМП, вызванной грамположительными возбудителями, терапия низкими дозами левофлоксацина (500 мг 1 р/сут) была эффективнее, чем применение ципрофлоксацина по 500 мг 2 р/сут.
Таким образом, учитывая данные K.G. Naber об антибактериальной активности, фармакокинетике и фармакодинамике препаратов, а также результаты нескольких опубликованных клинических исследований, можно сделать вывод о том, что 500 мг левофлоксацина 1 р/сут и 500 мг ципрофлоксацина 2 р/сут демонстрируют сходную эффективность в лечении осложненной ИМП [46]. Увеличение дозы левофлоксацина рекомендовано при инфекциях, вызванных менее чувствительными патогенами, например, при биопленке, образованной синегнойной палочкой, которая содержит алгинат. В данном случае алгинат является главным составляющим и выступает в роли барьера, защищающего микробные клетки от гуморальной и клеточной составляющих иммунной системы человека [47]. Левофлоксацин продемонстрировал выраженную бактерицидную активность против формирующих биопленку клеток, тогда как ципрофлоксацин, цефтазидим и гентамицин были малоэффективными [47]. M. Shigeta и соавт. изучали диффузию разных антибиотиков в биопленки и заключили, что проникновение гентамицина строго ингибировалось биопленкой [43]. Они также отметили различия в уровне проникновения левофлоксацина и ципрофлоксацина в биопленку, образованную синегнойной палочкой. Доза 60 мг/кг левофлоксацина по сравнению с ципрофлоксацином была достаточно эффективной для эрадикации клеток синегнойной палочки, что указывает на высокую концентрацию левофлоксацина в биопленке.
В исследовании F. Реа и соавт. [48] было показано, что левофлоксацин экскретируется почками в основном в неизмененном виде (< 75%) и показывает в 2 раза больший уровень почечной экскреции, чем ципрофлоксацин. В этой связи высокие дозы левофлоксацина (500 мг 2 раза в день) достигают очень больших концентраций в моче, в среднем в 50 раз выше, чем МИК для большинства чувствительных уропатогенов. При применении высоких доз левофлоксацина для патогенов с МИК < 16 мг/л можно получить более высокие концентрации, чем МИК₉₀, для большинства мочевых патогенов. Это может улучшить результаты лечения ИМП, вызванных не только чувствительными микроорганизмами, но и бактериями, устойчивыми или демонстрирующими интермиттирующую чувствительность к этому антибиотику.
Наличие двух лекарственных форм левофлоксацина позволяет применять его в качестве «последовательной» терапии, начиная с внутривенного введения и продолжая прием препарата в амбулаторных условиях. Это дает возможность сократить длительность госпитализации и снизить затраты на лечение по сравнению с другими инъекционными формами антибиотиков.
Заключение
С распространением в урологической практике био- и искусственных материалов огромное значение приобрела проблема инфекций, ассоциированных с образованием биопленок. Несмотря на широкое изучение механизма формирования биопленок, разработку подходов к профилактике образования биопленок, получение некоторых обещающих результатов, идеального метода предупреждения формирования биопленок пока не существует. Помимо эффективного механизма профилактики и контроля формирования биопленок, необходимо также выработать простой метод диагностики инфекции, обусловленной формированием биопленок, и найти антимикробные препараты, эффективные против бактерий в биопленках.
Хронический бактериальный простатит
Несмотря на принятую классификацию хронического простатита, дифференциация хронического небактериального и бактериального воспаления все еще дискутируется. Планктонные бактерии в результате уретро-простатического рефлюкса попадают в протоки простаты и ацинусы, где могут безопасно размножаться. При персистенции они могут формировать спорадические бактериальные, адгезированные к эпителию протоков микроколонии, вызывая постоянную иммунную стимуляцию и хроническое воспаление [6]. Колонизированные бактерии не проникают в секрет простаты или образцы мочи, что обусловливает трудность диагностики хронического бактериального простатита. Антимикробная терапия способствует эрадикации планктонных бактерий, но не адгезированной бактериальной биопленки, расположенной глубоко в ткани простаты.
Рецидивирующий цистит
Точный механизм бактериальной адгезии и выживания в мочевых путях еще не ясен. Уропатогенная кишечная палочка (uropathogenic Escherichia coli, UPEC) связывается с поверхностными эпителиальными клетками мочевого пузыря, которые распознают бактериальные адгезины и липополисахариды через Толл-подобные рецепторы и стимулируют миграцию нейтрофилов в слизистую мочевого пузыря. Взаимодействия с эпителием, опосредованные фимбриями 1-го типа кишечной палочки, стимулируют отшелушивание поверхностно расположенных эпителиальных клеток, вызывая распространение инфекции и бактериурию. Несмотря на воспалительный ответ и эпителиальное отшелушивание, UPEC способна достичь высоких титров в моче в течение нескольких дней и при хроническом воспалении может персистировать в течение длительного времени.
Было установлено, что бактерии сначала размножаются внутриклеточно, формируя дезорганизованные кластеры-скопления, что подтверждается в экспериментальных моделях [7, 8] и частично исследованиями с участием больных инфекциями мочевых путей (ИМП) [9]. Соответственно бактерии в кластерах делятся без активного роста, преимущественно вследствие изменений в генетических программах. Более того, кластеры становятся компактными и организуются в биопленкоподобные структуры – так называемые внутриклеточные бактериальные сообщества [7]. Бактерии во внутриклеточном бактериальном сообществе удерживаются вместе экзополимерным матриксом, напоминающим структуру биопленки. При этом бактерии, находящиеся на краю сообщества, становятся подвижными и вследствие несостоятельности мембранной неприкосновенности могут покидать инфицированные клетки мочевого пузыря, что обусловливает высокие титры агента в моче. Однако бактерии во внутриклеточных нишах способны создавать и хронический неподвижный резервуар, который может персистировать нераспознанным в течение нескольких месяцев без попадания бактерий в мочу (рис. 2) [8, 10].
Пиелонефрит
Бактерии способны проникать в уротелий почечных лоханок и почечные сосочки. Как было показано в эксперименте на животных, бактерии могут адгезироваться на уротелии, прежде чем инвазируют ткань почки [11]. Антимикробные агенты более эффективны против подобных биопленок по сравнению с биопленками на катетерах [12], что может быть обусловлено синергичным действием антибактериальных препаратов и факторов защиты хозяина [13].
Формирование биопленок на инородных телах в мочевых путях
Уретральные катетеры
Постоянные уретральные катетеры в 30–80% случаев играют роль входных ворот для госпитальных инфекций, при этом нередко катетер-ассоциированная бактериурия не исчезает после удаления катетера. У пациентов с постоянным уретральным катетером часто возникают различные осложнения: острый пиелонефрит, цистит, эпидидимит, абсцессы простаты, бактериемия, септицемия, стриктуры уретры, в связи с чем смертность в этой группе больных увеличивается почти в 3 раза, а у пациентов со спинальными повреждениями этот показатель достигает 20–40% [14].
С момента установки внутренняя и наружная поверхности уретрального катетера становятся мишенью для формирования биопленки. При экстралюминарном пути инфицирования микроорганизмы (как правило, эндогенные микроорганизмы, населяющие желудочно-кишечный тракт) распространяются восходящим путем по уретре во время и после установки катетера. При интралюминарном пути инфицирования бактерии могут восходить по внутреннему просвету катетера (рис. 3). В этом случае микроорганизмы имеют экзогенную природу, например микрофлора кожи рук здорового медицинского персонала.
Чаще всего катетеры инфицированы Enterococcus faecalis, Pseudomonas aeruginosa, Escherichia coli. Наиболее сильными продуцентами биопленок являются Proteus mirabilis, Enterococcus faecalis, Candida tropicalis, Staphylococcus aureus [15].
Клиническое значение инфекций мочевых путей, обусловленных формированием биопленок на уретральных катетерах, огромно. Это связано с возможным развитием непредсказуемых осложнений (от бессимптомной бактериурии до эндотоксического шока) вследствие экзо- и эндотоксинов, вырабатываемых микроорганизмами и попадающих в кровоток через поврежденные ткани мочевого пузыря.
Мочеточниковые стенты
Бактериальные биопленки могут также развиваться на внутренних стентах, установленных в верхние мочевые пути. Было показано, что 68–90% мочеточниковых стентов колонизируются, в то время как бактериурия имеет место только у 27–30% пациентов со стентами [16, 17]. Этот факт обусловливает трудность выявления биопленок в обычных лабораториях. Тем не менее отрицательный культуральный анализ мочи не исключает возможности колонизации стента.
Частой проблемой при использовании медицинских биоматериалов является инкрустация, особенно при уреаза-продуцирующих бактериях, таких как Proteus mirabilis, Pseudomonas aeruginosa, Staphylococcus spp., Staphylococcus aureus, Moraxella catarrhalis, Enterococcus faecalis, Klebsiella pneumoniaе и др. Уреаза-продуцирующие возбудители мочевой инфекции расщепляют мочевину в моче на аммиак и водород, что приводит к изменению состава мочи, повышению pH, оседанию струвита (аммония-магния фосфат) и апатита (кальция фосфат) на эпителий мочевых путей, а также на поверхность катетеров, стентов, камней. Уреаза Proteus mirabilis гидролизирует мочевину мочи в аммиак от 6 до 10 раз быстрее, чем уреаза других видов [18].
Формирование биопленки и инкрустация также ограничивают эффективность применения различных катетеров с антимикробным покрытием, потому что отложение кристаллов на катетерах позволяет бактериям прикрепляться и размножаться без контактирования с защитным покрытием [19].
Инфицированные мочевые камни
Бактерии, инфицирующие мочевые пути, способствуют не только хронизации инфекции в результате повышенной устойчивости к терапии, но и образованию новых камней. Инфицированные камни растут быстро, защищая бактерии, образующие биопленку [20]. При дроблении камней (дистанционном, контактном) необходимо учитывать возможность выхода микроорганизмов и их токсинов из камней, что в условиях повышенного внутрилоханочного давления из-за постоянной ирригации жидкости, особенно при длительной операции, увеличивает риск развития бактериемии, токсинемии, синдрома системной воспалительной реакции и септических осложнений. Остатки конкрементов и биопленок служат основой для быстрого рецидива камнеобразования, поэтому важно полностью удалить все фрагменты инфицированных камней в ходе операции.
В отечественных исследованиях было продемонстрировано различие в результатах бактериологического исследования мочи и камней [21]. У пациентов с мочекаменной болезнью микроорганизмы при исследовании камня выявлялись чаще, чем при исследовании мочи: 59,4% по сравнению с 33,3%. Виды микроорганизмов в моче и камне не различались и были представлены такими уропатогенами, как Enterococcus faecalis, Klebsiella pneumoniae, Pseudomonas aeruginosa, Streptococcus haemolyticus, Proteus mirabilis и Escherichia coli.
Остатки биопленок на слизистой лоханки почки и бактериурия являются основными факторами риска рецидива камнеобразования в послеоперационном периоде. Фрагменты удаленных камней, которые необходимо забирать в стерильных условиях операционной, рекомендуется исследовать бактериологически. Длительное применение антибиотиков с учетом результатов бактериологических анализов мочи и камней, а также метафилактика являются наиболее эффективными методами лечения.
Артифициальные мочевые сфинктеры
Около 3% артифициальных мочевых сфинктеров оказываются инфицированными. Уменьшить риск инфицирования можно путем лечения предшествующей ИМП, предупреждения длительной ретенции мочевых путей и снижения количества остаточной мочи в мочевом пузыре. Первым шагом элиминации инфекции является полное удаление импланта. Реимплантации должна предшествовать полная санация мочевых путей [22].
Пенильные протезы
Инфекция, развивающаяся на пенильных протезах, чаще всего вызвана стафилококками, в особенности Staphylococcus epidermidis, которые имеют повышенную способность продуцировать гликокаликс биопленки. Чаще всего инфекция вторична и определяется по результатам бактериологического анализа мочи во время операции. В этой связи необходимо учитывать наиболее этиологически значимые патогены при выборе антибиотиков для профилактики. Культуральные анализы с выявленным 90%-ным ростом стафилококковой инфекции были положительны у 70% пациентов с клинически неинфицированными пенильными протезами во время ревизии по поводу механического нарушения функции протеза [23].
С целью уменьшения риска развития инфекции были разработаны пенильные протезы с гидрофильным покрытием, которые уменьшали бактериальную адгезию in vitro и в моделях на животных [24]. Покрытие подтвердило способность абсорбировать антибиотики интраоперационно, тем самым содействуя их поступлению в окружающие ткани в послеоперационном периоде и эрадицикации возбудителей инфекции. Однако данные по пенильным протезам с гидрофильным покрытием ограничены.
Применение пенильных протезов с покрытием комбинации рифампицина и миноциклина было одобрено в 2001 г. Использование этих протезов позволило снизить уровень инфицированности на 58% по сравнению с применением имплантов без покрытия [25].
Методы профилактики формирования биопленок в мочевых путях
Методы общей профилактики
Среди наиболее эффективных методов общей профилактики формирования биопленок в мочевых путях следует выделить обязательное мытье рук пациента и медицинского персонала перед каждым контактом с катетером и дренажной системой, а также предупреждение разъединения закрытых дренажных систем и соблюдение их правильного расположения на постели больного [26]. Местная защита на уровне уретры и мочевого пузыря предполагает обработку наружного отверстия уретры, асептический метод введения катетера, использование антимикробных мазей, Катеджеля, Инстиллагеля.
Модификация поверхности биоматериала
Долгое время многообещающей стратегией профилактики формирования бактериальных биопленок считалась модификация поверхности имплантов и катетеров.
Катетеры, импрегнированные антибиотиками. В недавнем Кохрейновском обзоре были представлены данные о значительном снижении уровня бессимптомной бактериурии при использовании катетеров, импрегнированных антибиотиками, по сравнению с катетерами без покрытия (миноциклин, рифампицин и нитрофуразон, срок – менее чем одна неделя катетеризации) [27]. При более длительном сроке катетеризации различия были статистически недостоверными, что авторы связали с малочисленностью данных.
Покрытие сплавом серебра. В том же обзоре отмечено, что покрытые серебряным сплавом катетеры значительно уменьшали риск возникновения бессимптомной бактериурии (катетеризация менее чем в течение одной недели) [27]. При катетеризации дольше недели эффект был ниже, но риск бессимптомной бактериурии был все же меньше у пациентов, которым были установлены катетеры, покрытые серебряным сплавом. В отношении более длительной катетеризации достоверных клинических исследований пока не проводилось.
Гидрофильное покрытие. Катетеры с гидрофильным покрытием широко используются при чистой интермиттирующей катетеризации. В проспективном сравнительном многоцентровом исследовании ИМП при использовании гидрофильно-покрытых катетеров развивались реже (64% по сравнению с 82% в группе контроля) [28]. Однако в недавнем рандомизированном контролируемом исследовании не было получено статистически значимых различий в отношении симптоматической ИМП и результатов микробиологических анализов мочи при использовании катетеров с гидрофильным покрытием и непокрытых уретральных катетеров, установленных на период 6 недель [29].
Гепарин. Гепарин может быть использован для антиадгезивного покрытия стентов благодаря строгой электронегативности, которая позволяет «отбрасывать» клеточные организмы. В 1987 г. M.R. Ruggieri и соавт. установили 90%-ное уменьшение бактериальной адгезии на катетерах, покрытых гепарином [30]. На покрытых гепарином уретральных стентах не было определено органических или анорганических отложений после размещения in situ в течение 6 недель по сравнению с тем, что 33% непокрытых стентов были колонизированы биопленками [31]. Другие данные были получены D. Lange и соавт., которые сравнивали стенты, покрытые гепарином, с высвобождением триклозана и невысвобождаемые контрольные уретральные стенты, установленные на период 7 дней. In vitro стенты, покрытые гепарином, не уменьшали бактериальную адгезию по сравнению с использованием непокрытых стентов [32].
Gendine. Gendine – новый антисептик, содержащий горечавку фиолетовую и хлоргексидин. R. Hachem и соавт. сравнили in vitro антиадгезивную активность мочевых катетеров, покрытых Gendine, и непокрытых катетеров в отношении нескольких полирезистентных бактерий. Gendine-покрытые катетеры уменьшали адгезию всех микроорганизмов. С помощью сканирующей электронной микроскопии было показано, что биопленки покрывают контрольные катетеры, но не Gendine-покрытые катетеры. Авторы подтвердили свои результаты in vivo на моделях кроликов [33]. Однако, несмотря на многообещающие предварительные результаты, клинические данные не признаны достоверными.
Триклозан. Триклозан является антибактериальным соединением, которое известно около 40 лет. Триклозан-высвобождаемый стент уменьшает активность ИМП и рост бактериальных колоний в модели цистита, вызванного протейной инфекцией [34]. Мы уже говорили о том, что триклозан-высвобождаемый стент устойчив ко всем бактериям, за исключением синегнойной палочки и энтерококка [32]. На всех триклозан-высвобождаемых стентах были получены зрелые биопленки с низкой жизнеспособностью.
Использование низкоэнергетичных поверхностных звуковых волн
Концепция использования низкой энергии поверхностных звуковых волн предполагает, что акустические волны, направленные прямо на инородные тела в мочевых путях (например, имплантаты), разрушают биопленки посредством ингибирования адгезии планктонных бактерий на их поверхности. Z. Hazan и соавт. предложили метод, который позволяет акустическим волнам распространяться из портативного датчика, генерирующего пьезоэлектрическую вибрацию с частотой, варьирующей от 100 до 300 кГц [35]. Авторы направляли волны, генерируемые датчиком, на катетеры с текущей жидкостью, содержащей разные уропатогены, в течение 3 дней. Применение волнового метода нарушило формирование биопленок, позволяя катетерам фактически очищаться от адгезированных микроорганизмов. Результаты были подтверждены in vivo на кроликах в течение одной недели лечения.
В двойном слепом контролируемом рандомизированном исследовании, касающемся кратковременной катетеризации, применение волновой терапии предотвращало формирование биопленок на всех катетерах, в то время как в контрольной группе биопленки определялись на катетерах в 63% случаев [36].
P. Tеnke и соавт. провели проспективное сравнительное исследование в параллельных группах, оценивавшее эффективность волновой терапии в случае длительной катетеризации (8 недель) [2]. Волновая терапия снижала уровень клинически значимой бактериурии (33% против 81%), частота формирования биопленок была также ниже в группе волновой терапии по сравнению с контролем [37].
Действие антимикробных препаратов на бактерии в биопленке
Большинство исследователей полагают, что антибиотики могут замедлять формирование биопленки только путем элиминации незащищенных планктонных бактерий. Во время острой фебрильной фазы инфекции антимикробная терапия является достаточной, потому что за фебрильную реакцию ответственны именно планктонные бактерии, а не бактерии в биопленке. Однако из поверхностного слоя зрелой биопленки могут высвобождаться планктонные микроорганизмы, которые свободно плавают и распространяются над поверхностью, вызывая бактериурию, а возможно, и бактериемию, эндотоксинемию и другие острые инфекционно-воспалительные осложнения, вплоть до синдрома системной воспалительной реакции и уросепсиса. Уросепсис представляет собой наиболее сильную манифестацию мочевой инфекции. Лечение уросепсиса, в отличие от простой ИМП, включает не только антибактериальную терапию, но и другие меры: восполнение объема жидкости, назначение стероидов, контроль глюкозы крови, экстракорпоральные методы детоксикации, а также контроль источника инфекции (например, дренирование любой обструкции и/или удаление инородных тел из мочевых путей). Эти меры необходимо предпринимать в течение первых часов заболевания [38]. Адекватная начальная эмпирическая антибактериальная терапия подразумевает сначала назначение препарата широкого спектра действия, а затем препарата с узким спектром действия, учитывая данные бактериологического исследования. При уросепсисе или остром пиелонефрите предпочтительно внутривенное применение высоких доз антибиотиков с целью поддержания их высокой концентрации в сыворотке крови и достижения хорошего тканевого проникновения.
Следует отметить, что антибиотики, эффективные против планктонных бактерий, часто не оказывают необходимого антимикробного действия в отношении бактериальных биопленок. Это связано с тем, что выбор антимикробных препаратов основывается на бактериальной культуре, полученной из планктонных бактерий. Между тем планктонные бактерии отличаются по поведению и фенотипическим формам от бактерий в биопленке. Неэффективность антимикробной терапии в лечении инфекции, обусловленной формированием биопленок, могут быть объяснены также тем, что [39]:
- препараты не проникают на всю глубину биопленки из-за барьерной функции гликокаликса, покрывающего их снаружи;
- матрикс биопленки выводит антимикробные препараты наружу (эффлюкс, или наружная резистентность);
- микроорганизмы в биопленке растут медленнее, поэтому они более устойчивы к антимикробным препаратам, которые действуют на активно размножающиеся бактерии;
- протеины, связывающие антимикробные препараты, плохо экспрессируются у бактерий в биопленке;
- бактерии в биопленке активируют многие гены, которые изменяют клеточную оболочку, молекулярные мишени и чувствительность к антимикробным препаратам (внутренняя резистентность);
- бактерии в биопленке могут выживать в присутствии антимикробных препаратов в концентрации в 1000–1500 раз выше той, которая необходима для эрадикации планктонных клеток того же вида бактерий (клетки-персистеры) [40].
Фторхинолоны способны эрадицировать инфекцию, обусловленную формированием биопленок, при условии создания концентрации, превышающей минимально ингибирующую (МИК) в 32–64 раза [44]. По данным K.G. Naber, у здоровых добровольцев после приема 500 мг ципрофлоксацина или 500 мг левофлоксацина последний создает более высокие концентрации в моче и дольше оказывает антибактериальное действие по сравнению с ципрофлоксацином [45]. Несмотря на то что МИК в отношении грамотрицательных микроорганизмов у ципрофлоксацина ниже по сравнению с левофлоксацином, бактерицидные концентрации в моче левофлоксацина были значительно выше и сохранялись дольше. Следовательно, во-первых, для грамотрицательных уропатогенов доза 500 мг левофлоксацина 1 р/сут сравнима с 500 мг ципрофлоксацина 2 р/сут. Во-вторых, для лечения ИМП, вызванной грамположительными возбудителями, терапия низкими дозами левофлоксацина (500 мг 1 р/сут) была эффективнее, чем применение ципрофлоксацина по 500 мг 2 р/сут.
Таким образом, учитывая данные K.G. Naber об антибактериальной активности, фармакокинетике и фармакодинамике препаратов, а также результаты нескольких опубликованных клинических исследований, можно сделать вывод о том, что 500 мг левофлоксацина 1 р/сут и 500 мг ципрофлоксацина 2 р/сут демонстрируют сходную эффективность в лечении осложненной ИМП [46]. Увеличение дозы левофлоксацина рекомендовано при инфекциях, вызванных менее чувствительными патогенами, например, при биопленке, образованной синегнойной палочкой, которая содержит алгинат. В данном случае алгинат является главным составляющим и выступает в роли барьера, защищающего микробные клетки от гуморальной и клеточной составляющих иммунной системы человека [47]. Левофлоксацин продемонстрировал выраженную бактерицидную активность против формирующих биопленку клеток, тогда как ципрофлоксацин, цефтазидим и гентамицин были малоэффективными [47]. M. Shigeta и соавт. изучали диффузию разных антибиотиков в биопленки и заключили, что проникновение гентамицина строго ингибировалось биопленкой [43]. Они также отметили различия в уровне проникновения левофлоксацина и ципрофлоксацина в биопленку, образованную синегнойной палочкой. Доза 60 мг/кг левофлоксацина по сравнению с ципрофлоксацином была достаточно эффективной для эрадикации клеток синегнойной палочки, что указывает на высокую концентрацию левофлоксацина в биопленке.
В исследовании F. Реа и соавт. [48] было показано, что левофлоксацин экскретируется почками в основном в неизмененном виде (< 75%) и показывает в 2 раза больший уровень почечной экскреции, чем ципрофлоксацин. В этой связи высокие дозы левофлоксацина (500 мг 2 раза в день) достигают очень больших концентраций в моче, в среднем в 50 раз выше, чем МИК для большинства чувствительных уропатогенов. При применении высоких доз левофлоксацина для патогенов с МИК < 16 мг/л можно получить более высокие концентрации, чем МИК₉₀, для большинства мочевых патогенов. Это может улучшить результаты лечения ИМП, вызванных не только чувствительными микроорганизмами, но и бактериями, устойчивыми или демонстрирующими интермиттирующую чувствительность к этому антибиотику.
Наличие двух лекарственных форм левофлоксацина позволяет применять его в качестве «последовательной» терапии, начиная с внутривенного введения и продолжая прием препарата в амбулаторных условиях. Это дает возможность сократить длительность госпитализации и снизить затраты на лечение по сравнению с другими инъекционными формами антибиотиков.
Заключение
С распространением в урологической практике био- и искусственных материалов огромное значение приобрела проблема инфекций, ассоциированных с образованием биопленок. Несмотря на широкое изучение механизма формирования биопленок, разработку подходов к профилактике образования биопленок, получение некоторых обещающих результатов, идеального метода предупреждения формирования биопленок пока не существует. Помимо эффективного механизма профилактики и контроля формирования биопленок, необходимо также выработать простой метод диагностики инфекции, обусловленной формированием биопленок, и найти антимикробные препараты, эффективные против бактерий в биопленках.
1. Сosterton J.W. Cystic fibrosis pathogenesis and the role of biofilms in persistent infection // Trends Microbiol. 2001. Vol. 9. № 2. P. 50–52.
2. Tenke P., Köves B., Nagy K. et al. Update on biofilm infections in the urinary tract // World. J. Urol. 2012. Vol. 30. № 1. P. 51–57.
3. Levels of Evidence. Oxford Centre for Evidence-based Medicine / Produced by B. Phillips, Ch. Ball, D. Sackett et al. // www.cebm.net/index.aspx?o=1025.
4. Сosterton J.W., Cheng K.-J., Geesey G.G. et al. Bacterial biofilms in nature and disease // Annu. Rev. Microbiol. 1987. Vol. 41. P. 435–464.
5. Denstedt J.D., Reid G., Sofer M. Advances in ureteral stent technology // World J. Urol. 2000. Vol. 18. № 4. P. 237–242.
6. Nickel J.C., Olson M.E., Barabas A. et al. Pathogenesis of chronic bacterial prostatitis in an animal model // Br. J. Urol. 1990. Vol. 66. № 1. P. 47–54.
7. Justice S.S., Hung C., Theriot J.A. et al. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis // Proc. Natl. Acad. Sci. USA. 2004. Vol. 101. № 5. P. 1333–1338.
8. Mysorekar I.U., Hultgren S.J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract // Proc. Natl. Acad. Sci. USA. 2006. Vol. 103. № 38. P. 14170–14175.
9. Rosen D.A., Hooton T.M., Stamm W.E. et al. Detection of intracellular bacterial communities in human urinary tract infection // PLoS Med. 2007. Vol. 4. № 12. P. e329.
10. Anderson G.G., Palermo J.J., Schilling J.D. et al. Intracellular bacterial biofilm-like pods in urinary tract infections // Science. 2003. Vol. 301. № 5629. P. 105–107.
11. Nickel J.C., Olson M., McLean R.J. et al. An ecological study of infected urinary stone genesis in an animal model // Br. J. Urol. 1987. Vol. 59. № 1. P. 21–30.
12. Nickel J.C., Costerton J.W., McLean R.J. et al. Bacterial biofilms: influence on the pathogenesis, diagnosis and treatment of urinary tract infections // J. Antimicrob. Chemother. 1994. Vol. 33. Suppl. A. P. 31–41.
13. Nickel J. The battle of the bladder: the pathogenesis and treatment of uncomplicated cystitis // Int. Urogynecol. J. 1990. № 1. P. 218–222.
14. Warren J.W. Catheter-associated urinary tract infections // Int. J. Antimicrob. Agents. 2001. Vol. 17. № 4. P. 299–303.
15. Holá V., Ruzicka F., Horka M. Microbial diversity in biofilm infections of the urinary tract with the use of sonication techniques // FEMS Immunol. Med. Microbiol. 2010. Vol. 59. № 3. P. 525–528.
16. Reid G., Denstedt J.D., Kang Y.S. et al. Microbial adhesion and biofilm formation on ureteral stents in vitro and in vivo // J. Urol. 1992. Vol. 148. № 5. P. 1592–1594.
17. Farsi H.M., Mosli H.A., Al-Zemaity M.F. et al. Bacteriuria and colonization of double-pigtail ureteral stents: long-term experience with 237 patients // J. Endourol. 1995. Vol. 9. № 6. P. 469–472.
18. Morris N.S., Stickler D.J., McLean R.J. The development of bacterial biofilms on indwelling urethral catheters // World J. Urol. 1999. Vol. 17. № 6. P. 345–350.
19. Stickler D.J., Feneley R.C. The encrustation and blockage of long-term indwelling bladder catheters: a way forward in prevention and control // Spinal Cord. 2010. Vol. 48. № 11. P. 784–790.
20. Nickel J.C., Olson M., McLean R.J. et al. An ecological study of infected urinary stone genesis in an animal model // Br. J. Urol. 1987. Vol. 59. № 1. P. 21–30.
21. Эгамбердиев Д.К. Роль инфекции мочевых путей в генезе камней почек: дис. … канд. мед. наук. М., 2013. 120 с.
22. Licht M.R., Montague D.K., Angermeier K.W. et al. Cultures from genitourinary prostheses at reoperation: questioning the role of Staphylococcus epidermidis in periprosthetic infection // J. Urol. 1995. Vol. 154. № 2. Pt. 1. P. 387–390.
23. Henry G.D., Wilson S.K., Delk J.R. 2nd et al. Penile prosthesis cultures during revision surgery: a multicenter study // J. Urol. 2004. Vol. 172. № 1. P. 153–156.
24. Rajpurkar A., Fairfax M., Li H. et al. Antibiotic soaked hydrophilic coated bio-flex: a new strategy in the prevention of penile prosthesis infection // J. Sex. Med. 2004. Vol. 1. № 2. P. 215–220.
25. Carson C.C. 3rd. Efficacy of antibiotic impregnation of inflatable penile prostheses in decreasing infection in original implants // J. Urol. 2004. Vol. 171. № 4. P. 1611–1614.
26. Kunin C. Detection, prevention, and management of urinary tract infections. 4th edition. Philadelphia: Lea&Febiger, 1987. 431 p.
27. Schumm K., Lam T.B. Types of urethral catheters for management of short-term voiding problems in hospitalised adults // Cochrane Database Syst. Rev. 2008. Vol. 16. № 2. CD004013.
28. De Ridder D.J., Everaert K., Fernández L.G. et al. Intermittent catheterisation with hydrophilic-coated catheters (SpeediCath) reduces the risk of clinical urinary tract infection in spinal cord injured patients: a prospective randomised parallel comparative trial // Eur. Urol. 2005. Vol. 48. № 6. P. 991–995.
29. Sarica S., Akkoc Y., Karapolat H. et al. Comparison of the use of conventional, hydrophilic and gel-lubricated catheters with regard to urethral micro trauma, urinary system infection, and patient satisfaction in patients with spinal cord injury: a randomized controlled study // Eur. J. Phys. Rehabil. Med. 2010. Vol. 46. № 4. P. 473–479.
30. Ruggieri M.R., Hanno P.M., Levin R.M. Reduction of bacterial adherence to catheter surface with heparin // J. Urol. 1987. Vol. 138. № 2. P. 423–426.
31. Riedl C.R., Witkowski M., Plas E. et al. Heparin coating reduces encrustation of ureteral stents: a preliminary report // Int. J. Antimicrob. Agents. 2002. Vol. 19. № 6. P. 507–510.
32. Lange D., Elwood C.N., Choi K. et al. Uropathogen interaction with the surface of urological stents using different surface properties // J. Urol. 2009. Vol. 182. № 3. P. 1194–1200.
33. Hachem R., Reitzel R., Borne A. et al. Novel antiseptic urinary catheters for prevention of urinary tract infections: correlation of in vivo and in vitro test results // Antimicrob. Agents Chemother. 2009. Vol. 53. № 12. P. 5145–5149.
34. Cadieux P.A., Chew B.H., Knudsen B.E. et al. Triclosan loaded ureteral stents decrease proteus mirabilis 296 infection in a rabbit urinary tract infection model // J. Urol. 2006. Vol. 175. № 6. P. 2331–2335.
35. Hazan Z., Zumeris J., Jacob H. et al. Effective prevention of microbial biofilm formation on medical devices by low-energy surface acoustic waves // Antimicrob. Agents Chemother. 2006. Vol. 50. № 12. P. 4144–4152.
36. Ikinger U., Zillich S., Weber C. Biofilm Prevention by Surface Acoustic Nanowaves: a new approach to urinary tract Infections? : poster // 25th World Congress of Endourology and SWL. Mexico: Cancun, 2007.
37. Nagy K., Koves B., Tenke P. The effectiveness of acoustic energy induced by UroShield device in the prevention of bacteriuria and the reduction of patients’ complaints related to long-term indwelling urinary catheters: poster // 26th Annual EAU Congress. Austria: Vienna, 2011.
38. Wagenlehner F.M., Weidner W., Naber K.G. Pharmacokinetic characteristics of antimicrobials and optimal treatment of urosepsis // Clin. Pharmacokinet. 2007. Vol. 46. № 4. P. 291–305.
39. Tenke P., Kovacs B., Jäckel M. et al. The role of biofilm infection in urology // World J. Urol. 2006. Vol. 24. № 1. P. 13–20.
40. Lewis K., Spoering A.L., Kaldalu N. et al. Persisters: specialized cells responsible for biofilm tolerance // Biofilms, infection and antimicrobial therapy / Ed. by J.L. Pace, M. Rupp, R.G. Finch. Taylor & Francis Group, 2005. P. 241–257.
41. Shigeta M., Tanaka G., Komatsuzawa H. et al. Permeation of antimicrobial agents through Pseudomonas aeruginosa biofilms: a simple method // Chemotherapy. 1997. Vol. 43. № 5. P. 340–345.
42. Reid G., Habash M., Vachon D. et al. Oral fluoroquinolone therapy results in drug adsorption on ureteral stents and prevention of biofilm formation // Int. J. Antimicrob. Agents. 2001. Vol. 17. № 4. P. 317–319.
43. Shigeta M., Komatsuzawa H., Sugai M. et al. Effect of the growth rate of Pseudomonas aeruginosa biofilms on the susceptibility to antimicrobial agents // Chemotherapy. 1997. Vol. 43. № 2. P. 137–141.
44. Goto T., Nakame Y., Nishida M. et al. In vitro bactericidal activities of beta-laktamases, amikacin and fluoroquinolones against Pseudomonas aeruginosa biofilm in artificial urine // Urology. 1999. Vol. 53. № 5. P. 1058–1062.
45. Naber K.G. Which fluoroquinolones are suitable for the treatment of urinary tract infections // Int. J. Antimicrob. Agents. 2001. Vol. 17. № 4. P. 331–341.
46. Drago L., De Vecchi E., Mombelli B. et al. Activity of levofloxacin and ciprofloxacin against urinary pathogens // J. Antimicrob. Chemother. 2001. Vol. 48. № 1. P. 37–45.
47. Ishida H., Ishida Y., Kurosaka Y. et al. In vitro and in vivo activities of levofloxacin against biofilm-producing Pseudomonas aeruginosa // Antimicrob. Agents Chemother. 1998. Vol. 42. № 7. P. 1641–1645.
48. Pea F., Pavan F., Di Qual E. et al. Urinary pharmacokinetics and theoretical pharmacodynamics of intravenous levofloxacin in intensive care unit patients treated with 500 mg b.i.d. for ventilator-associated pneumonia // J. Chemother. 2003. Vol. 15. № 6. P. 563–567.
The value of infections with the formation of biofilms in urology
T.S. Perepanova
Scientific-Research Institute of Urology of the Ministry of Health of Russia
Сontact person: Tamara Sergeyevna Perepanova, perepanova2003@mail.ru
The article consides the role of biofilms in chronic bacterial prostatitis, recurrent cystitis, pyelonephritis. The methods of prophylaxis of formation of biofilms, including by modifying the surface of biomaterials are discribed. The need for antimicrobial drugs with proven efficacy against bacterial biofilms is emphasized.
Key words: planktonic bacteria, biofilms, urinary tract infections, implants, catheters, antimicrobial therapy
T.S. Perepanova
Scientific-Research Institute of Urology of the Ministry of Health of Russia
Сontact person: Tamara Sergeyevna Perepanova, perepanova2003@mail.ru
The article consides the role of biofilms in chronic bacterial prostatitis, recurrent cystitis, pyelonephritis. The methods of prophylaxis of formation of biofilms, including by modifying the surface of biomaterials are discribed. The need for antimicrobial drugs with proven efficacy against bacterial biofilms is emphasized.
Key words: planktonic bacteria, biofilms, urinary tract infections, implants, catheters, antimicrobial therapy
Новости на тему
17.02.2023
08.12.2022
12.09.2022 01:00:00
СТАТЬИ по теме
19.10.2022
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье обсуждается роль биопленок в развитии хронического бактериального простатита, рецидивирующего цистита, пиелонефрита. Рассматриваются методы профилактики формирования биопленок, в том числе путем модификации поверхности биоматериалов. Подчеркивается необходимость применения антимикробных препаратов с доказанной эффективностью в отношении бактериальных биопленок.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
