Диабетическая ретинопатия: два взгляда на одну проблему
- Аннотация
- Статья
- Ссылки
- English
В статье рассмотрен патогенез диабетической ретинопатии и диабетического макулярного отека с позиции эндокринолога и офтальмолога. Сравниваются подходы к их терапии и обозначены наиболее рациональные.
В статье рассмотрен патогенез диабетической ретинопатии и диабетического макулярного отека с позиции эндокринолога и офтальмолога. Сравниваются подходы к их терапии и обозначены наиболее рациональные.





Сахарный диабет (СД) занимает лидирующее место среди заболеваний эндокринной системы в мире, в том числе в России. Количество вновь выявленных случаев неуклонно возрастает и к 2030 г. может достичь 568 млн [1]. В настоящее время сахарным диабетом страдает 9,3% населения в возрасте от 20 до 79 лет [1].
Эксперты подчеркивают, что распространенность СД, прежде всего СД 2 типа, увеличивается с огромной скоростью и опережает все прогнозы. Для уточнения данного феномена и выявления причин роста заболеваемости специалисты Эндокринологического научного центра под контролем со стороны экспертов Международной федерации диабета с 2013 по 2015 г. провели первое эпидемиологическое исследование распространенности СД 2 типа среди взрослого населения России NATION. До настоящего времени это самое крупное эпидемиологическое исследование. В нем приняли участие 26 620 человек в возрасте от 20 до 79 лет из 63 регионов России [2, 3]. Диагноз СД 2 типа устанавливали на основании рекомендаций Всемирной организации здравоохранения 2011 г. Так, уровень гликированного гемоглобина (HbA1c) менее 5,7% соответствует нормальному углеводному обмену, более 5,7% и менее 6,5% – предиабету, или высокому риску развития СД 2 типа, 6,5% и более – СД 2 типа [4].
Диагноз СД 2 типа был установлен 1437 (5,4%) лицам, у 773 (54%) – впервые. При этом у каждого пятого с впервые выявленным СД 2 типа уровень HbA1c был более 9%, что свидетельствует о выраженной декомпенсации и большой вероятности наличия осложнений данного заболевания. У 19,3% диагностирован предиабет.
Согласно проведенным расчетам, в России истинное число больных СД 2 типа в возрасте от 20 до 79 лет могло составлять не менее 6,5 млн, с предиабетом – около 23,7 млн [2, 3].
На 1 января 2019 г., согласно данным федерального регистра сахарного диабета, в Российской Федерации на учете состояло лишь 4,5 млн больных, или 3,12% населения.
Сахарный диабет прежде всего опасен развитием осложнений, таких как нефропатия, ретинопатия, невропатия, синдром диабетической стопы, ускоренный атеросклероз магистральных сосудов. Все они ассоциируются с высокой инвалидизацией и смертностью. Среди осложнений СД 1 и 2 типов второе место по частоте встречаемости во всех возрастных группах занимает диабетическая ретинопатия (ДР) [5, 6]. Так, она диагностируется у каждого третьего пациента с сахарным диабетом [1]. Тяжесть изменений глазного дна четко коррелирует с длительностью СД и степенью его компенсации. При ДР болевой синдром может быть слабо выражен либо отсутствовать. Диабетическая ретинопатия является основной причиной слепоты. Больные СД слепнут в 25 раз чаще, чем в общей популяции [6].
Установлено, что снижение зрения оказывает более сильное влияние на качество жизни пациента, чем инсульт, артериальная гипертензия и инфаркт миокарда [7]. От остроты зрения нередко зависят физические возможности индивидуума, способность выполнять те или иные социальные функции, психоэмоциональное состояние.
В настоящее время предложено несколько определений ДР. Согласно одному из них, диабетическая ретинопатия представляет собой микрососудистое осложнение СД, характеризующееся поражением сетчатки в результате ишемии, повышения проницаемости и эндотелиальной дисфункции сосудов, приводящее к значительному снижению зрения вплоть до его потери [8]. Согласно другому определению, это специфичное позднее нейромикрососудистое осложнение СД, развивающееся, как правило, последовательно от изменений, связанных с повышенной проницаемостью и окклюзией ретинальных сосудов, до образования новых сосудов и фиброглиальной ткани, что является одним из проявлений генерализованной микроангиопатии [9, 10].
Существует также несколько классификаций ДР. Так, в Алгоритмах специализированной медицинской помощи больным сахарным диабетом 2019 г. ДР предложено подразделять на три стадии в зависимости от изменений глазного дна (табл. 1) [8].
Самой полной признана классификация ETDRS 1991 г. (табл. 2) [11]. Данная классификация используется как в клинических исследованиях, так и в клинической практике.
Не достигнуто единого мнения и по частоте офтальмологических осмотров больных СД (табл. 3–5) [8, 10].
Почему эндокринологам так важно знать частоту осмотров пациентов с СД офтальмологами?
Диабетическая ретинопатия развивается у трети пациентов с СД [12]. Однако фактическая распространенность ДР в несколько раз может превышать регистрируемую по обращаемости [13]. Длительное отсутствие жалоб и нерегулярные осмотры приводят к тому, что заболевание прогрессирует и диагностируется уже на поздних стадиях, когда появляются клинические признаки.
Необходимо отметить, что при появлении жалоб и длительном стаже заболевания рекомендации эндокринологов и офтальмологов в отношении частоты осмотра пациентов практически совпадают.
Причины снижения зрения при сахарном диабете
Причинами снижения зрения у пациентов с СД являются пролиферативная диабетическая ретинопатия и диабетический макулярный отек (ДМО) [14]. Частота их встречаемости при некомпенсированном СД увеличивается в два раза [6, 15, 16] и коррелирует с длительностью заболевания [6, 12, 15, 16].
Патогенез диабетической ретинопатии
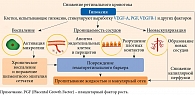
Патогенез ДР обусловлен рядом биохимических процессов, которые, вероятнее всего, инициируются гипергликемией (рис. 1) [17–20]. Гипергликемия приводит к эндотелиальному стрессу с образованием конечных продуктов гликирования и активных форм кислорода, которые вызывают повреждение сосудистой стенки и гибель эндотелиальных клеток. В результате оксидативного стресса индуцируется экспрессия воспалительных цитокинов (интерлейкинов 6, 8, 1β и фактора некроза опухоли), хемокинов, молекул клеточной адгезии (молекулы клеточной адгезии 1, васкулярной молекулы клеточной адгезии 1), которые способствуют миграции лейкоцитов и лейкостазу. Повреждение эндотелия, усиление агрегации элементов крови, активация факторов коагуляции приводят к окклюзии капилляров и ретинальной ишемии, которая запускает повышенную экспрессию эндотелиального фактора роста сосудов (Vascular Endothelial Growth Factor – VEGF). Как следствие, формируются ДМО и ДР. В ответ на значительное снижение кровоснабжения происходит открытие шунтов – интраретинальных микрососудистых аномалий и перераспределение кровотока в обход неперфузируемой сетчатки [17, 18]. Увеличение выработки VEGF ассоциируется с повышением проницаемости сосудов. Это происходит за счет воздействия на эндотелиальные белки плотных межклеточных контактов. В результате повышается экссудация и накопление экстрацеллюлярной жидкости и белков в ткани сетчатки. В норме жидкость, которая проходит через стенку капилляров, реабсорбируется пигментным эпителием (наружным гематоретинальным барьером) и соседними капиллярами сетчатки. При превышении возможности пигментного эпителия и капилляров реабсорбировать жидкость появляются клинические признаки макулярного отека. ДМО усиливается при выработке провоспалительных цитокинов сверх критического уровня и активации клеток Мюллера [19, 20].
В развитии ДР выделяют пять основных процессов:
- формирование микроаневризм;
- патологическая сосудистая проницаемость;
- сосудистая окклюзия;
- неоваскуляризация и фиброзная пролиферация;
- сокращение фиброваскулярной ткани и стекловидного тела.
Для эндокринологов важно помнить, что диабетическая макулопатия (поражение области желтого пятна), ДМО могут развиться на любой стадии ДР.
Критериями клинически значимого ДМО являются [21]:
- утолщение сетчатки и/или твердые экссудаты, захватывающие центр макулы;
- утолщение сетчатки и/или твердые экссудаты, расположенные ближе 500 мкм от центра макулы, но на него не распространяющиеся;
- утолщение сетчатки площадью одного диска зрительного нерва или более, расположенное хотя бы частично ближе одного диаметра диска от центра макулы.
Клиническая картина состояния глазного дна
Поражение глазного дна происходит от периферии к центру, именно поэтому в течение некоторого периода времени пациенты не предъявляют жалоб.
В настоящее время для состояния, развивающегося у пациентов с выраженной декомпенсацией СД и напрямую связанного с резким снижением гликемии, в офтальмологии введено понятие «транзиторная диабетическая ретинопатия». Субъективно пациенты могут отмечать снижение остроты зрения, появление перед глазами мушек и облачка. Объективно обнаруживаются или увеличиваются ретинальные геморрагии в поверхностных слоях сетчатки по краю диска зрительного нерва, ватные экссудаты и макулярный отек. Одним из тяжелых проявлений транзиторной ретинопатии считается ишемическая макулопатия. Как правило, она характеризуется доброкачественным течением и самопроизвольным регрессом в течение нескольких месяцев, поэтому не требует специфического лечения [22].
Эндокринологам необходимо помнить о более раннем появлении и более интенсивном прогрессировании катаракты у пациентов с СД, особенно на фоне декомпенсации углеводного обмена. Возможно также развитие мононейропатии, проявляющейся поражением глазодвигательных и отводящих нервов. Субъективно пациенты жалуются на отклонение глазного яблока, двоение и опущение верхнего века. При нарушении иннервации роговицы может развиться эпителиопатия, приводящая к рецидивирующим эрозиям роговицы.
Методы лечения
Основой хорошего и длительного ответа на терапию ДР является стабилизация и нормализация углеводного обмена. Для этого необходимы постоянный самоконтроль глюкозы, соблюдение режима питания и физических нагрузок, своевременное и правильное применение рекомендованных препаратов.
При лечении ДР используют междисциплинарный подход. Выбор терапии зависит от комплаентности пациентов.
Лечение можно быть консервативным, оперативным (лазерное и хирургическое вмешательство) и комбинированным.
Консервативное лечение
Для терапии ДР применяют разные группы препаратов: ангиопротекторы, антиоксиданты, витамины, ферменты и др. Необходимо отметить, что ранее данные препараты широко использовали для профилактики развития ДР.
На сегодняшний день в отношении консервативного лечения эндокринологи высказываются категорично: ангиопротекторы, антиоксиданты, ферменты и витамины при ДР малоэффективны и не рекомендуются [8]. Позиция офтальмологов не столь однозначна: консервативное лечение не рекомендуется пациентам с диабетической ретинопатией, прежде всего с ДМО [10, 12, 23, 24]. Решение о ее необходимости врачи-офтальмологи принимают в зависимости от клинической картины [25]. Пациентам с диабетическим поражением сетчатки могут быть назначены препараты из групп антиоксидантов, антигипоксантов, дезагрегантов, гемостатиков и ангиопротекторов.
Прогрессирование ДР может замедлять фенофибрат, применяемый для коррекции липидного статуса [26–28].
Лазерная коагуляция сетчатки
Начиная с 1985 г. лазерная коагуляция сетчатки (ЛКС) является самым известным методом лечения ДР и ДМО [21]. Однако в исследовании ETDRS было показано, что только у 12% пациентов с клинически значимым макулярным отеком при фоновой непролиферативной диабетической ретинопатии легкой и средней степени ЛСК позволяла предотвратить умеренное снижение остроты зрения [21]. При диффузном ДМО данный метод терапии малоэффективен [29–31].
Относительным показанием для проведения панретинальной ЛКС является препролиферативная ДР при невозможности регулярного мониторинга состояния пациента [10, 32]. Таковая направлена на подавление экспрессии VEGF и профилактику неоваскуляризации. Абсолютным показанием для незамедлительного проведения ЛКС является пролиферативная ДР в сочетании с неоваскуляризацией сетчатки, размер которой превышает половину площади диска зрительного нерва, неоваскуляризацией диска зрительного нерва, размер которой превышает треть его площади, витреальной или преретинальной геморрагией [10]. Указанные состояния связаны с высоким риском снижения зрения.
В настоящий момент времени остается открытым вопрос о степени компенсации углеводного обмена при проведении данного вида лечения. В Алгоритмах специализированной медицинской помощи больным сахарным диабетом 2019 г. указано, что ЛКС должна проводиться вне зависимости от степени достижения целевой гликемии. При этом уточняется, что снижение гликемии при необходимости следует осуществлять постепенно и параллельно с выполнением ЛКС [8]. В рекомендациях по лечению пациентов офтальмологического профиля отмечено, что панретинальная ЛКС проводится, не дожидаясь существенного улучшения контроля гликемии, при пролиферативной ДР и уровне HbA1c более 10% с обязательной оценкой «польза/риск» и потенциальных побочных эффектов.
Лазерная коагуляция сетчатки, как правило, выполняется, когда уже имеются новообразованные сосуды или риск их появления крайне высок. Известно, что при появлении новых сосудов значительно возрастает вероятность развития слепоты, поэтому, несмотря на побочные эффекты, применение лазерного лечения оправданно [23, 33, 34].
В качестве терапии первого выбора ЛКС может быть рекомендована пациентам с ДМО, когда толщина центральной зоны сетчатки менее 350 мкм [10, 35], а также женщинам в период беременности и грудного вскармливания.
Хирургическое лечение
Хирургическое лечение ДМО и ДР включает интравитреальные инъекции ингибиторов ангиогенеза (анти-VEGF-препаратов) и/или стероидов, витрэктомию.
У эндокринологов и офтальмологов тактика ведения и выбор препарата для лечения клинически значимого ДМО совпадают. Интравитреальные инъекции ингибиторов ангиогенеза (анти-VEGF-препараты) являются терапией первой линии [26]. Ингибиторы ангиогенеза влияют не только на функциональные и анатомические показатели, но и на степень фоновой ретинопатии, которая определяет риски развития слепоты [36].
Необходимо отметить, что препараты данной группы применяются с начала XXI в. Кроме того, были проведены прямые сравнительные исследования ЛКС и анти-VEGF-препаратов при ДМО.
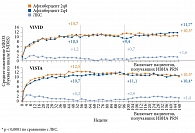
Для эндокринологов особый интерес могут представлять результаты 148-недельных исследований VIVID/VISTA. В них сравнивали эффективность и безопасность интравитреального введения афлиберцепта в разных режимах и ЛКС у пациентов с тяжелым ДМО. В группе афлиберцепта проводили пять загрузочных (ежемесячных) инъекций. После ее разделили на две подгруппы: подгруппа 2q4 получала афлиберцепт в дозе 2 мг каждые четыре недели, подгруппа 2q8 – каждые восемь недель. В группе ЛКС процедура выполнялась при наличии показаний, но не чаще одного раза в 12 недель. С 24-й недели при недостаточном эффекте могла проводиться терапия спасения: для группы ЛКС – введение афлиберцепта, для группы афлиберцепта – ЛКС. Результаты исследования позволили сделать следующий вывод: ЛКС значительно уступает афлиберцепту по динамике функциональных и анатомических показателей, а также по влиянию на степень ДР [37, 38]. В отличие от лазерной коагуляции сетчатки анти-VEGF-терапия улучшала зрение пациентов с последующим поддержанием достигнутого эффекта (рис. 2).
Отсроченное, на третьем году проведения исследований VIVID/VISTA, добавление афлиберцепта пациентам группы ЛКС способствовало улучшению анатомических показателей. Однако положительная динамика функциональных показателей была менее выраженной, чем у пациентов группы афлиберцепта. Так, в исследовании VIVID к концу 148-й недели лечения среднее изменение максимально корригируемой остроты зрения (МКОЗ) достигло +11,7 буквы в группе афлиберцепта 2q8, +10,3 буквы в группе афлиберцепта 2q4 и +1,6 буквы в группе ЛКС (р < 0,0001). Аналогичные результаты получены в исследовании VISTA (см. рис. 2) [38].
Согласно результатам рандомизированных исследований фазы III RISE и RIDE, у пациентов с имитацией инъекций, которые перешли на терапию ранибизумабом после 24 месяцев, МКОЗ улучшилась, но не так значительно, как у изначально получавших ранибизумаб. Это указывает на важность более раннего применения ингибиторов ангиогенеза [39].
Анти-VEGF-терапия улучшает зрительные функции и уменьшает толщину центральной зоны сетчатки. Кроме того, она положительно влияет на течение диабетической ретинопатии. Так, в исследовании VISTA к 148-й неделе доля пациентов с уменьшением тяжести диабетической ретинопатии на две ступени и более по шкале DRSS в группах афлиберцепта 2q4, афлиберцепта 2q8 и ЛКС составила 29,9 и 34,4 против 20,1%. В исследовании VIVID рассматриваемый показатель составил 44,3, 47,8 и 17,7% соответственно [38]. В рамках клинических исследований RISE/RIDE [39, 40], Protocol S [41–43] и Protocol Т DRCR.net [44] также продемонстрировано положительное влияние анти-VEGF-препаратов на течение ДР.
Важно подчеркнуть, что анти-VEGF-терапия может проводиться при любой степени компенсации СД, исключая острые осложнения диабета [45, 46].
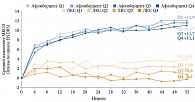
При субанализе результатов исследований VIVID/VISTA данные групп интравитреального введения ингибиторов ангиогенеза (ИВИА) (афлиберцепта) были объединены для увеличения мощности анализа. Пациентов из группы афлиберцепта и группы ЛКС разделили в зависимости от исходного уровня HbA1c. Квартили HbA1c были определены с использованием доступных исходных данных: Q1 – от 4,5 и менее 6,7%, Q2 – от 6,7 и менее 7,4%, Q3 – от 7,4 и менее 8,6%, Q4 – от 8,6 и менее 14,7%. После этого оценивали связь между исходным уровнем HbA1c и изменением МКОЗ на фоне лечения. Пациенты в группах афлиберцепта в отличие от пациентов группы ЛКС достигали улучшения остроты зрения вне зависимости от исходного уровня HbA1c. После 12 месяцев лечения афлиберцептом показатель среднего МКОЗ составил +11,9, +11,7, +11,7 и +11,1 буквы в подгруппах Q1, Q2, Q3 и Q4 соответственно. В группе ЛКС отмечена корреляция между высоким уровнем HbA1c и изменением МКОЗ. Через 12 месяцев в этой группе МКОЗ была очень низкой (рис. 3) [46]. По функциональным результатам ЛКС проигрывала ингибиторам ангиогенеза.
В исследовании Protocol T DRCR.net показано, что при исходно высокой остроте зрения (20/40–20/32) ранибизумаб и афлиберцепт не различались по эффективности. При низкой (20/50 и менее) применение афлиберцепта привело к более значимому улучшению остроты зрения, согласно показателю площади под кривой (AUC) (рис. 4) [47, 48].
Терапия анти-VEGF предполагает ежемесячные загрузочные дозы (от трех до пяти), далее курсами. Частоту контрольных осмотров и временной интервал между инъекциями устанавливает офтальмолог в зависимости от особенностей клинической картины.
Интравитреальные инъекции ингибиторов ангиогенеза в сочетании с отсроченной (24 недели и более) лазерной коагуляцией сетчатки при клинически значимом ДМО улучшают зрительные функции [49].
Интравитреальное введение стероидов (кортизона) применяется в течение 20 лет [50]. В настоящее время в нашей стране используется имплант для интравитреального введения, содержащий 0,7 мг дексаметазона. Основной механизм действия импланта основан на постепенном высвобождении препарата. Дексаметазон подавляет воспаление, снижает отек, отложение фибрина, проницаемость капилляров и миграцию фагоцитов к месту воспаления, подавляет экспрессию фактора роста эндотелия сосудов, предотвращает высвобождение простагландинов, часть из которых является медиаторами кистовидного макулярного отека [51, 52]. Высвобождение активного препарата в витреальной полости происходит в течение шести месяцев, что определяет частоту проведения терапии.
Однако, согласно результатам крупного рандомизированного клинического исследования MEAD, после введения имплантата достигнутое повышение остроты зрения не сохранялось в течение шести месяцев [52].
В ретроспективном исследовании в условиях клинической практики CHROME показано, что повторная установка имплантата с дексаметазоном требуется раньше, чем истекает рекомендованный интервал между инъекциями. В среднем таковой составил 2,3–4,9 месяца [53]. Таким образом, можно сделать предположение о том, что введение импланта с интервалом даже в четыре месяца может быть недостаточным. Данный факт в дополнение к известным нежелательным явлениям не позволяет сделать вывод о снижении бремени терапии при использовании импланта. Основными побочными эффектами такого лечения являются повышение внутриглазного давления, развитие катаракты. Именно поэтому пациентам, находящимся на терапии дексаметазоном, рекомендован регулярный мониторинг внутриглазного давления и биомикроскопия.
В отношении данного вида лечения мнение офтальмологов и эндокринологов совпадает. Его рекомендуют в качестве второй линии терапии при наличии клинически значимого ДМО, в качестве первой линии у пациентов, неспособных соблюдать график визитов для проведения анти-VEGF-терапии, резистентных к анти-VEGF-терапии и ЛКС, с высоким сердечно-сосудистым риском [26].
Решение о необходимости проведения витрэктомии принимает офтальмолог. Витрэктомия рекомендуется при ДМО тракционного генеза, пролиферативной ДР, осложненной организовавшимся гемофтальмом, тракционной или тракционно-гематогенной отслойкой сетчатки с захватом области макулы. Данная манипуляция относится к микроинвазивной хирургии и требует подготовки пациента совместно с эндокринологом, нефрологом (при нарушении функции почек), кардиологом (при наличии осложнений со стороны сердечно-сосудистой системы), подиатром и/или хирургом (при синдроме диабетической стопы), терапевтом.
Выводы
Приведенные в статье данные позволяют сделать следующие выводы.
- Пациент должен быть осмотрен офтальмологом сразу же или как можно раньше после установления диагноза «сахарный диабет».
- Эндокринологи должны быть осведомлены о современных методах терапии ДР и ДМО.
- Регулярные осмотры глазного дна помогают сохранить зрение и улучшить качество жизни пациентов.
- Необходимо четко соблюдать протокол ведения пациентов с ДМО. Больные должны быть осведомлены, что улучшение качества зрения в начале лечения не является поводом для прекращения или прерывания терапии.
- При ДР, особенно у пациентов с ДМО, возможно проведение ЛКС не ранее чем через 24 недели с начала проведения анти-VEGF-терапии.
- Пациент должен владеть информацией о необходимости нормализации гликемии, артериального давления и показателей липидного обмена, а врач – контролировать своевременность проведения обследований и подбора оптимальной терапии.
Публикация при поддержке AO «Байер». Компания поддерживала техническую редакцию статьи и обеспечивала взаимодействие между авторами настоящей публикации.
A.N. Oranskaya, PhD, K.G. Gurevitch, MD, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Alevtina N. Oranskaya, anor2004@list.ru
Diabetic retinopathy (DR) has long been the second most common complication of type 1 and type 2 diabetes in all age groups. Blindness resulting from diabetic macular edema (DME) significantly impairs the quality of patient’s vision. The article describes the pathogenesis, methods of treatment of DR, DME from the position of endocrinologists and ophthalmologists. A comparison is made and the emphasis on the rationality of approaches to DR therapy is highlighted.

