количество статей
6422
Пожалуйста, авторизуйтесь:
Исследования
Эффективность применения Ксефокама при цервикокраниалгии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология и Психиатрия" №3 (32)
- Аннотация
- Статья
- Ссылки
- English

Таблица 1. Характеристика пациентов, принимавших участие в исследовании
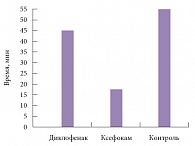
Рис. 1. Время наступления обезболивающего эффекта на фоне приема диклофенака, Ксефокама и в группе контроля
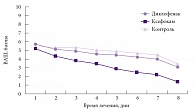
Рис. 2. Выраженность болевого синдрома на фоне приема диклофенака, Ксефокама и в группе контроля
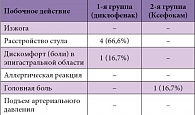
Таблица 2. Нежелательные явления, зарегистрированные на фоне приема диклофенака и Ксефокама
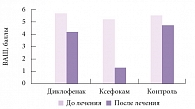
Рис. 3. Динамика интенсивности болевого синдрома по ВАШ к концу исследования на фоне приема диклофенака, Ксефокама и в группе контроля
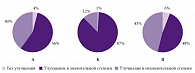
Рис. 4. Субъективное впечатление пациентов о лечении в группах: А – диклофенак, Б – Ксефокам, В – группа контроля
Введение
Лечение болевого синдрома, и в частности локализованного в области «голова – шея», представляет собой весьма актуальную проблему, которая часто обсуждается в литературе, посвященной вопросам лечения дорсалгий, вертеброгенных болевых синдромов и др. Цервикокраниалгический болевой синдром характеризуется достаточной стойкостью и длительностью, что влечет за собой развитие психоэмоциональных расстройств и снижение качества жизни [1].
Патофизиология боли
Боль в любом отделе позвоночника – это симптом, а не нозологическая форма, поэтому термины, относящиеся к шейной локализации («цервикалгия», «цервикобрахиалгия» и т.д.) и не только, чаще подразумевают мышечно-тонические болевые синдромы [2, 3]. Избыточный вес, гиподинамия, тяжелая физическая работа, длительные «тонические» нагрузки, связанные с профессиональной деятельностью, могут быть причиной развития цервикокраниалгических болевых синдромов. Обычно интенсивная боль проходит в течение 1–2 недель, но незначительные боли у 66–70% пациентов сохраняются еще в течение приблизительно месяца.
У большинства пациентов цервикокраниалгия обусловлена морфологическими и функциональными изменениями в опорно-двигательном аппарате. Патологические морфологические изменения локализуются в межпозвонковых дисках, телах позвонков. С возрастом межпозвонковые диски теряют воду и протеогликаны, что приводит к снижению высоты диска. Фасеточные суставы испытывают большую нагрузку, уменьшается натяжение связок, что сопровождается гипермобильностью позвонково-двигательного сегмента. Это приводит к раздражению болевых рецепторов синовиальных оболочек межпозвонковых суставов и, как следствие, к возникновению болевого синдрома. При этом изменения в шейном отделе позвоночника, выявляемые с помощью рентгенограмм, компьютерной и магнитно-резонансной томографий, слабо коррелируют с наличием и интенсивностью цервикалгии. Кроме того, нет четкой корреляции между наличием боли и дискогенными изменениями в определенном отделе позвоночника. Чаще боль возникает при морфо-анатомических изменениях, типичных для спондилолистеза, остеохондроза и других дегенеративно-дистрофических изменений позвоночника.
Наряду с морфологическими изменениями важную роль в развитии боли играет функциональное обратимое блокирование межпозвонковых суставов в результате статических или динамических нагрузок, микротравм, нефизиологических поз. На появление болевой импульсации мышцы практически всегда реагируют тонической рефлекторной реакцией. Напряжение мышц задней группы шеи, в том числе и перикраниальных, необходимо для создания мышечного корсета с целью иммобилизации пораженного сегмента. Однако при длительном тоническом напряжении мышц последние в конечном итоге сами становятся источниками болевой импульсации. Кроме того, во многих случаях мышцы могут страдать первично. Избыточное напряжение ряда мышечных групп, обусловленное различными причинами, приводит к дисфункции миофасциальных тканей с формированием болевого синдрома. Миофасциальные болевые синдромы могут наблюдаться как вне зависимости от вертеброгенной патологии, так и осложнять вертеброгенные боли.
Таким образом, источниками боли в спине могут быть: капсулы суставов, связки и фасции, мышцы, позвонки (болевые рецепторы обнаружены в надкостнице и кровеносных сосудах), межпозвонковые диски (болевые рецепторы обнаружены в наружной трети фиброзного кольца). От болевых рецепторов – ноцицепторов – вышеперечисленных структур болевой импульс поступает в центральную нервную систему (спинной и головной мозг). В головном мозге происходит процесс перцепции – пришедший импульс трансформируется в понятие «боль». Боль, которая формируется по такому патофизиологическому механизму, называется ноцицептивной.
Реже причиной боли в спине является компрессия или ишемия корешка, нерва, спинального ганглия (компрессионная радикулопатия). Это патологическое состояние приводит к более тяжелому и длительному (часто хроническому) болевому синдрому. При повреждении нервной ткани в ней изменяются количество и функционирование ионных каналов. Такая боль часто сопровождается целым рядом других симптомов: парестезией, аллодинией и т.п. Боль, возникающая вследствие подобных патофизиологических процессов, называется нейропатической.
Кроме того, боли в спине могут иметь чисто психогенную природу, например, у пациентов, страдающих депрессией, когда психические факторы играют основную роль в возникновении, тяжести, усилении и сохранении боли, а собственно боль является продуктом измененного восприятия пациентом окружающего мира [4, 5]. Понимание ведущего патофизиологического механизма боли (ноцицептивная, нейропатическая, психогенная) очень важно для правильного выбора тактики ее медикаментозного лечения.
Лечение
Одним из главных принципов терапии болевого синдрома является скорейшее обезболивание, поскольку чем раньше начато лечение и быстрее достигнут значимый анальгетический эффект, тем меньше вероятность хронизации боли и лучше общий прогноз.
Для лечения боли в спине чаще всего применяют нестероидные противовоспалительные препараты (НПВП), опиоиды, миорелаксанты, антиконвульсанты, антидепрессанты, местные анестетики, препараты витаминов группы В. НПВП, опиоиды, миорелаксанты наиболее эффективны при ноцицептивной боли, а антиконвульсанты, антидепрессанты, местные анестетики, препараты витаминов группы В – при нейропатической боли [6–8].
Общепризнана эффективность обезболивания ноцицептивных болей в различных отделах позвоночника с помощью НПВП. Препараты этой группы способны влиять на болевую импульсацию на всех уровнях афферентной передачи – от периферических ноцицепторов до таламических центров мозга [9]. Основной механизм действия НПВП заключается в нарушении продукции простагландинов благодаря ингибированию ключевого фермента их синтеза – циклооксигеназы (ЦОГ). В конце ХХ в. были открыты различные изоформы ЦОГ, что дало толчок к пониманию механизмов развития лечебного и побочного эффектов НПВП. Было установлено, что в патологических условиях активация ЦОГ второго типа (ЦОГ-2) определяет продукцию провоспалительных и проалгогенных простагландинов. Синтезированные при участии ЦОГ-2 в очаге повреждения тканей простагландины повышают чувствительность ноцицепторов к различным стимулам, переводя ноцицепторы в состояние, когда они легко возбуждаются при различном воздействии. НПВП, блокируя образование простагландинов в очаге повреждения тканей, прекращают или ослабляют болевую импульсацию.
Понимание различной роли изоформ ЦОГ в воспалении и генезе побочных эффектов препаратов группы НПВП привело к созданию и внедрению в клиническую практику, наряду с «классическими», относительно селективных и высокоселективных ЦОГ-2-ингибиторов. Эти препараты имеют меньшую гастроэнтерологическую токсичность. Дискуссии о том, всегда ли хороша высокая селективность в отношении ЦОГ-2 и не может ли она носить чрезмерный и нежелательный для организма пациента характер, начались после получения данных о кардиоваскулярных рисках использования высокоселективных ЦОГ-2-ингибиторов. Знаковыми стали результаты клинического исследования VIGOR (Vioxx Gastrointestinal Outcomes Research Trial), в котором сопоставлялась эффективность и безопасность напроксена и рофекоксиба в симптоматической терапии ревматоидного артрита. Данные о существенном увеличении риска кардиоваскулярных осложнений при использовании рофекоксиба были получены и в исследовании APPROVe (Adenomatous Polyp Prevention on Vioxx).
В этой связи актуальным является назначение препаратов, которые обладают сбалансированным эффектом в отношении ЦОГ-1 и ЦОГ-2, таких как препарат из группы оксикамов – лорноксикам [10]. Лорноксикам (Ксефокам) – один из наиболее мощных анальгетиков в группе НПВП. Выраженное противовоспалительное и обезболивающее действие лорноксикама определяется его фармакокинетическими и фармакодинамическими свойствами. Он мощно ингибирует обе изоформы циклооксигеназы, тормозит образование интерлейкина-6 и синтез индуцибельного оксида азота. Кроме того, препарат стимулирует опиоидергические системы, усиливая выработку эндогенного динорфина и эндорфина, что способствует физиологической активации антиноцицептивной системы организма. Эффективность лорноксикама (Ксефокама) при острой боли потенцируется лекарственными формами препарата. При острой боли для парентерального введения препарат применяется в форме лиофилизата, из которого приготавливается раствор для внутривенного и внутримышечного введения. Возможность внутривенного введения выгодно отличает лорноксикам от других НПВП, так как многие из них или вообще не имеют формы для парентерального введения, или могут вводиться только внутримышечно.
Цель, материалы и методы исследования
Нами было проведено исследование с целью сравнения эффективности, а также времени наступления и длительности обезболивающего эффекта препаратов Ксефокам и диклофенак. В исследование было включено 36 больных, страдающих цервикокраниалгией (средний возраст составил 44,6 лет), которые были разделены на 3 группы. Все группы были сопоставимы по полу, возрасту, локализации болевого синдрома и степени его выраженности (табл. 1). Пациенты первой группы (n = 12) получали диклофенак 75 мг (3 мл) в/м 2 р/сут, пациентам второй группы (n = 12) был назначен Ксефокам в дозе 8 мг/сут парентерально, пациенты контрольной группы (n = 12) обезболивающий препарат не получали. Лечение проводилось в условиях неврологического отделения в течение 7 дней и включало назначение миорелаксантов, средств, улучшающих периферическое кровообращение, витаминов группы В. Пациентам также проводились физиотерапия, лечебная физкультура, массаж. Интенсивность боли оценивалась через час, а также через 2, 3, 4, 5 и 6 часов после применения первой дозы препарата. Кроме того, на 2, 3, 4, 5, 6, 7-й дни приема препаратов регистрировалась интенсивность болевого синдрома по ВАШ, степень ее уменьшения по 10-балльной шкале (по данным субъективной оценки пациентом).
Результаты
Достоверное снижение интенсивности цервикалгии в группе, получавшей диклофенак, отмечалось на 45-й минуте после введения первой дозы препарата, в то время как в группе, получавшей Ксефокам, снижение уровня болевого синдрома отмечалось к 23-й минуте, а в контрольной группе – к 55-й минуте (рис. 1).
Стабильный регресс неврологической симптоматики наблюдался у 84% больных, которые получали Ксефокам, и только у 47% и 32% пациентов в группе диклофенака и контрольной группе. На третьи сутки терапии у пациентов, получавших Ксефокам (65%), увеличился объем активных движений в шейном отделе позвоночника, отмечалось усиление мотивации к выздоровлению, наблюдалась тенденция к улучшению в психоэмоциональной сфере.
Достоверное снижение интенсивности болевого синдрома в группе Ксефокама отмечалось уже к 3-му дню (рис. 2). Наиболее выраженное снижение динамики интенсивности болевого синдрома было отмечено в группе Ксефокама: оно составило 4,3 балла, в то время как в группе диклофенака и в контрольной группе – 3,74 и 2,97 балла соответственно.
К концу курса лечения значительное снижение цервикокраниалгии субъективно и пальпаторно (мягкость мышц, отсутствие болевого синдрома при пальпации) отмечалось в группе Ксефокама. Динамика интенсивности болевого синдрома по ВАШ к концу исследования представлена на рисунке 3. Общее впечатление пациентов о препаратах оценивалось исключительно по их субъективным ощущениям (рис. 4).
Среди всех участников исследования 6 пациентов (5 из которых были включены в группу диклофенака и 1 в группу Ксефокама) отметили нежелательные побочные действия в период лечения (чувство дискомфорта в эпигастральной области, расстройство стула, головная боль). Нежелательные явления не требовали медикаментозной коррекции и разрешились выздоровлением пациентов в большинстве случаев на момент завершения ими программы исследования (табл. 2).
Обсуждение результатов
Полученные в нашей работе результаты подтвердили эффективность и безопасность применения парентеральных форм НПВП для лечения миофасциального болевого синдрома цервикокраниальной области. Сравнивая в целом эффективность лечения в изучаемых группах, можно отметить значительное и последовательное уменьшение боли в течение всех дней терапии. Однако в первые дни терапии на фоне применения Ксефокама было продемонстрировано более быстрое и выраженное снижение проявлений цервикокраниалгии, что особенно важно в период обострения заболевания. Если оценивать степень обезболивания, то обращает на себя внимание положительный эффект Ксефокама в первый день терапии: его достоверное анальгетическое действие отмечается в течение первых 23 минут.
Больным также предлагалось самостоятельно оценить результат применения препаратов по шкале субъективных ощущений (рис. 4.). В целом по итогам 7-дневного лечения наибольшее число пациентов отдали свое предпочтение Ксефокаму. О том, что боли уменьшились незначительно, сообщили 45% больных в контрольной группе и 40% в группе диклофенака. Наибольшая продолжительность противоболевого эффекта была отмечена также в группе пациентов, получавших Ксефокам, – она составила 7 часов.
В группах, получавших диклофенак и Ксефокам, были отмечены нежелательные побочные эффекты, не требующие медикаментозной коррекции. В целом данный факт не отразился на профиле безопасности препаратов. Однако стоит отметить, что отмеченные нежелательные реакции в группе Ксефокама не затрагивали желудочно-кишечный тракт.
Таким образом, учитывая полученные экспериментальные данные, можно сказать, что Ксефокам занимает одно из достойных мест среди НПВП ввиду его быстрого и выраженного противоболевого эффекта и высокого профиля безопасности.
Выводы
Проведенное исследование подтверждает удобство и эффективность применения парентеральных форм НПВП. Эффективным и безопасным НПВП для лечения болевых синдромов цервикальной и перикраниальной локализации является Ксефокам. Препарат не уступает по анальгетической активности самым эффективным НПВП, что является несомненным преимуществом перед другими препаратами этой группы. Существенным отличием Ксефокама является также безопасность использования, подтвержденная в ходе исследования. Таким образом, Ксефокам превосходит диклофенак по скорости наступления обезболивающего действия и по профилю безопасности, что связано с его фармакокинетическими особенностями. Ксефокам может эффективно применяться как в виде короткого курса монотерапии в первые дни заболевания, так и в комплексном лечении болевых синдромов другой локализации, в которых присутствует мышечно-тонический компонент. Вероятно, что комбинированная терапия НПВП в сочетании с традиционной терапией позволит в значительной степени улучшить качество жизни пациентов, препятствуя хронизации болевого синдрома.
1. Аверочкин А.И., Мозолевский Ю.В., Штульман Д.Р. Заболевания периферической нервной системы // Болезни нервной системы: руководство для врачей / под ред. Н.Н. Яхно, Д.Р. Штульмана. М.: Медицина, 2001. С. 500–506.
2. Вознесенская Т.Г. Миофасциальные болевые синдромы // Consilium Medicum. 2002. Т. 4. № 8. С. 432–436.3.
3. Кукушкин М.Л., Табеева Г.Р., Подчуфарова Е.В. Болевой синдром: патогенез, клиника, лечение. М.: ИМА-ПРЕСС, 2011. С. 34–40.
4. Михайлов М.К., Хитров В.Ю., Силантьева Е.Н. Миофасциальный болевой дисфункциональный синдром при шейном остеохондрозе. Казань: Чара, 1997. 128 с.
5. Пчелинцев М.В. Применение анальгетиков и высоких доз витаминов группы В для лечения болей в спине // Лечащий врач. 2012. № 9. С. 44–48.
6. Данилов А.Б. Нейропатическая боль. М.: Нейромедиа, 2003. 60 с.
7. Simpson R.K. Jr., Edmondson E.A., Constant C.F. et al. Transdermal fentanyl as treatment for chronic low back pain // Pain Symptom Manage. 1997. Vol. 14. № 4. P. 218–224.
8. Staunstrup H., Ovesen J., Larsen U.T. et al. Efficacy and tolerability of lornoxicam versus tramadol in postoperative pain // J. Clin. Pharmacol. 1999. Vol. 39. № 8. P. 834–841.
9. Воробьева О.В. Боли в спине // Русский медицинский журнал. 2003. Т. 11. № 10. С. 594–597.
10. Румянцева С.А. Современные концепции терапии Ксефокамом радикулярных болевых синдромов // Русский медицинский журнал. 2003. Т. 11. № 25. С. 1385–1389.
Efficacy of Xefocam in head and neck pain
M.N. Sharov, O.N. Fischenko
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov, Neurology Department of the Dentistry Faculty
Contact person: Olga Nikolayevna Fischenko, of177@bk.ru
The authors assessed efficacy of parenteral lornoxicam (Xefocam) and diclofenac in patients with cervical and pericranial pain. Compared to diclofenac, Xefocam had faster onset of analgesic action and better safety profile. Thus, Xefocam is recommended for short-term initial therapy of head and neck pain and as part of combination treatment for other myogenic pain syndromes.
Key words: pain syndrome, head and neck pain, nonsteroidal anti-inflammatory drugs, lornoxicam, diclofenac
M.N. Sharov, O.N. Fischenko
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov, Neurology Department of the Dentistry Faculty
Contact person: Olga Nikolayevna Fischenko, of177@bk.ru
The authors assessed efficacy of parenteral lornoxicam (Xefocam) and diclofenac in patients with cervical and pericranial pain. Compared to diclofenac, Xefocam had faster onset of analgesic action and better safety profile. Thus, Xefocam is recommended for short-term initial therapy of head and neck pain and as part of combination treatment for other myogenic pain syndromes.
Key words: pain syndrome, head and neck pain, nonsteroidal anti-inflammatory drugs, lornoxicam, diclofenac
Новости на тему
09.02.2023
СТАТЬИ по теме
Отправить статью по электронной почте
Ваш адрес электронной почты:
Авторами было проведено сравнительное исследование эффективности парентеральных форм лорноксикама (препарат Ксефокам) и диклофенака в терапии пациентов с болями цервикальной и перикраниальной локализации.
Исследование показало, что Ксефокам превосходит диклофенак по скорости наступления обезболивающего действия и по профилю безопасности. Таким образом, Ксефокам может быть рекомендован к применению как в виде короткого курса монотерапии в первые дни лечения цервикокраниалгии, так и в комплексном лечении других болевых синдромов, в которых присутствует мышечно-тонический компонент.
Исследование показало, что Ксефокам превосходит диклофенак по скорости наступления обезболивающего действия и по профилю безопасности. Таким образом, Ксефокам может быть рекомендован к применению как в виде короткого курса монотерапии в первые дни лечения цервикокраниалгии, так и в комплексном лечении других болевых синдромов, в которых присутствует мышечно-тонический компонент.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.

