Фосфомицин в лечении мультирезистентной энтеробактериальной инфекции, в том числе продуцирующей бета-лактамазы расширенного спектра: систематический обзор
- Аннотация
- Статья
- Ссылки
- English

Введение
Рост антибактериальной резистентности энтеробактерий ограничивает выбор достоверно эффективных антибиотиков [1–3]. Особое значение для общественного здравоохранения имеет распространение агентов, продуцирующих бета-лактамазы расширенного спектра (БЛРС), как среди негоспитальных, так и среди госпитальных штаммов энтеробактерий [4–5]. Активность данного фермента обусловливает резистентность к цефалоспоринам третьего и четвертого поколений и монобактамам, а также часто связана с резистентностью к другим антибиотикам: фторхинолонам, ко-тримоксазолу, тетрациклину и аминогликозидам [6]. С возрастающей частотой среди изолятов Enterobacteriaceae также выявляются другие типы бета-лактамаз, такие как AmpC бета-лактамазы, сериновые карбапенемазы или металло-бета-лактамазы, которые ответственны за резистентность к цефалоспоринам широкого спектра или даже карбапенемам [7].
Несмотря на это, в течение последних нескольких лет отмечено уменьшение количества используемых в клинической практике антибактериальных препаратов со значительной антибактериальной активностью против изолятов энтеробактерий, устойчивых к широко применяемым препаратам. Тигециклин, первый представленный на рынке антибиотик класса глицилциклинов, является одним из исключений, прежде всего из-за его активности в отношении Escherichia coli, а также Klebsiella pneumoniae, продуцирующих БЛРС или имеющих полирезистентный фенотип [8]. Вместе с тем пример полимиксинов демонстрирует, что более ранние препараты, не используемые в рутинной клинической практике, сохранили активность против мультирезистентных в иных случаях изолятов [9, 10].
Фосфомицин, известный уже на протяжении четырех десятилетий, имеет уникальный механизм антимикробного воздействия, включающий в себя ингибирование УДФ-N-ацетилглюкозамин-энолпрувил-трансферазы (MurA), фермента, который катализирует первый этап внутриклеточного синтеза клеточной стенки [11]. Фосфомицин обладает широким спектром антибактериального воздействия, включая также грамположительные и грамотрицательные аэробные бактерии [12–15].
Методы
Отбор исследований
Произведен систематический обзор публикаций, касающихся изолятов энтеробактерий с повышенной резистентностью и чувствительностью к фосфомицину, а также клинической эффективности использования фосфомицина при инфекциях, вызванных данными патогенами. В рамках данного обзора под повышенной резистентностью подразумевалась мультирезистентность (согласно определению внутри каждого отдельного исследования), устойчивость к карбапенемам или продукция БЛРС, AmpC бета-лактамаз, сериновых карбапенемаз или металло-бета-лактамаз. Поиск производился до января 2009 г., включая библиографию избранных исследований, в следующих базах данных: PubMed, Scopus, Central (Кокрановский центральный регистр контролируемых исследований).
Стратегия поиска заключалась в комбинации термина «фосфомицин» (fosfomycin, phosphomycin или phosphonomycin) с другими терминами, касающимися антибактериальной устойчивости («лекарственная резистентность», «бета-лактамазы», «бета-лактамазы расширенного спектра», «БЛРС», «CTX-M», «AmpC», «резистентность к карбапенемам», «металло-бета-лактамазы» или «М-бета-Л»), или терминами, касающимися соответствующих бактерий («Enterobacteriaceae», «Escherichia», «Klebsiella», «Proteus», «Enterobacter», «Morganella», «Salmonella» или «Shigella»). Были исключены публикации, написанные на языках кроме английского, испанского, французского, немецкого, итальянского и греческого, а также исследования, представленные в виде тезисов различных конференций.
Извлечение данных и обобщение
Данные о чувствительности к фосфомицину определялись согласно результатам исследований или исходя из релевантных таблиц или графиков чувствительности, в соответствии с критериями и методами в каждом исследовании. Для исследований, в которых использовалось более одного способа определения чувствительности, извлекались данные, предпочтительно полученные при использовании методов разведения агара, диффузии дисков, Etest или микроразведения питательного бульона [16–18].
Для сопоставления данных различных исследований об антибактериальной чувствительности за пограничное значение активной чувствительности к фосфомицину была принята восприимчивость 90% изолятов, а за слабую чувствительность – значение 50% и ниже. В качестве пороговых значений были выбраны показатели 90% и 50% минимальной ингибирующей концентрации (МИК), обычно используемые для описания антибактериальной активности препаратов против группы изолятов. Более того, предварительные суммарные данные по чувствительности к фосфомицину были рассчитаны с использованием наиболее релевантных критериев Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institut, CLSI), которые апеллируют к изолятам Escherichia coli из образцов мочи [16].
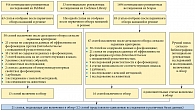
На рисунке показан процесс отбора исследований и статей для включения в обзор. Всего было включено 21 исследование [18–38], из них 17 исследований касались данных антибактериальной чувствительности [18–34], а 4 – клинических данных [35–38].
Антибактериальная активность фосфомицина
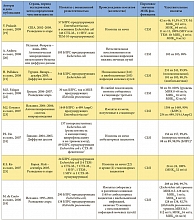
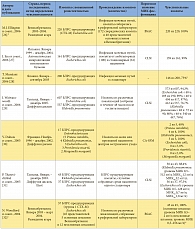
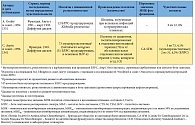
В таблице 1 приведены данные, полученные при обработке всех 17 микробиологических исследований, включенных в обзор, согласно паттерну резистентности к антибиотикам, авторам, источнику изолята, а также чувствительности изученных изолятов Enterobacteriaceae к фосфомицину. Из 17 исследований 4 включали изоляты из Испании [18, 20, 23, 27], 3 – из Франции [30, 33, 34], 2 – из Великобритании [26, 32] и 2 – из Таиланда [29, 31]. Оставшиеся 6 исследований проводились на изолятах из Греции [22], Гонконга [24], Японии [28], Кореи [25], Турции [21] и США [19]. Большинство включенных исследований проводились с изолятами, полученными после 2000 г. [19–26, 28, 29, 31, 32].
В 11 из 17 рассматриваемых исследований использовались критерии, соответствующие критериям CLSI для мочевых изолятов Escherichia coli (чувствительность при МИК ≤ 64 мг/л [16]) [18–25, 27, 29, 31]. В 2 исследованиях использовались критерии Британского общества по антимикробной химиотерапии (British Society for Antimicrobial Chemotherapy, BSAC) для грамотрицательных штаммов, полученных у пациентов с инфекцией мочевых путей (чувствительность при МИК ≤ 128 мг/л [39]) [26, 32]; еще два исследования основывались на критериях Комитета по антибиотикам французского общества микробиологов (Comité de l’Antibiogramme de la Société Française de Microbiologie, CA-SFM) для Enterobacteriaceae (чувствительность при МИК ≤ 32 мг/л [40]) [30, 34]. В оставшихся двух исследованиях из Франции и Японии используемые пороговые показатели чувствительности для фосфомицина не указывались. В основном для определения чувствительности к фосфомицину в исследованиях, включенных в обзор, использовались методы диффузии дисков [20, 21, 24, 29–31, 33, 34] и разведения в агаре [18, 19, 22, 25, 26].
В таблице 2 представлены данные об исследованиях, включавших в себя изоляты Enterobacteriaceae, где чувствительность к фосфомицину составляла более 90% согласно использованным критериям. Кроме того, указаны суммарные показатели чувствительности к фосфомицину согласно критериям CLSI для мочевых изолятов Escherichia coli в исследованиях, где подобные данные получить не представлялось возможным. Произведена стратификация этих данных по разным типам патогенов, паттернам резистентности и происхождению изолятов.
В целом в 17 включенных в обзор исследованиях приводятся данные о чувствительности к фосфомицину 5057 изолятов Enterobacteriaceae с повышенной резистентностью к антибиотикам. Изоляты были в основном представлены Escherichia coli (2205 изолятов), Klebsiella pneumoniaе (764 изолята) и Enterobacter spp. (73 изолята); в двух исследованиях тип патогена не был указан [19, 23]. В 11 из 17 исследований 90% или более изолятов Enterobacteriaceae с повышенной резистентностью к антибиотикам были чувствительны к фосфомицину [18–22, 24–27, 31, 32]. Напротив, лишь в двух исследованиях [33, 34] менее 50% изолятов (Enterobacter aerogenes и Klebsiella pneumoniae соответственно) были чувствительны к фосфомицину.
Из 5057 изолятов с повышенной резистентностью к антибиотикам 4448 (88,0%) изолятов Enterobacteriaceae продуцировали БЛРС. В 11 из 17 исследований со специфичными и релевантными данными 90% и более из 4448 изолятов, в сумме, были чувствительны к фосфомицину [18–22, 24–27, 31, 32]. Согласно наиболее релевантным критериям CLSI, в 11 исследованиях [18, 19, 20–25, 27, 29, 31], где можно было извлечь соответствующие данные, суммарная чувствительность к фосфомицину изолятов Enterobacteriaceae, продуцирующих БЛРС, составила 91,3% (3569 из 3911). При разграничении изолятов, полученных от амбулаторных и стационарных пациентов, данные о чувствительности более 90% изолятов получены в 3 из 3 [20, 21, 24] и 4 из 8 исследований соответственно, тогда как показатель чувствительности в данных группах пациентов, согласно критериям CLSI, составил 98,3% (292 из 297) [20, 21, 24] и 88,5% (1344 из 1519) [21, 22, 25, 29, 31] соответственно.
Клиническая эффективность фосфомицина
В таблице 3 представлены данные исследований, в которых производилась оценка эффективности фосфомицина в лечении инфекционных заболеваний, вызванных Enterobacteriaceae с повышенной резистентностью к антибиотикам [35–38]. Два исследования посвящены пероральному применению фосфомицина трометамола при лечении инфекций нижних мочевых путей, вызванных БЛРС-продуцирующей Escherichia coli, у пациентов с различными факторами риска [35, 36]. В итоге лечение фосфомицином было эффективно у 75 из 80 (93,8%) пациентов, принявших участие в данных исследованиях. Однако в одном из этих исследований клиническая эффективность была менее выраженной (41 из 52; 78,8%) [36]. В последнем исследовании [35] однократное применение фосфомицина трометамола равнялось по эффективности 5–7-дневному курсу приема ко-амоксиклава при чувствительности патогенов. Два дополнительных исследования [37, 38] показали, что использование фосфомицина было эффективно при лечении двух случаев инфекции, вызванной мультирезистентной Salmonella spp.
Обсуждение
Проведенный обзор позволил сделать главный вывод – фосфомицин обладает высоким уровнем антибактериальной активности против изолятов Enterobacteriaceae, продуцирующих БЛРС. Escherichia coli, вероятно, обладают самой высокой чувствительностью к фосфомицину среди Enterobacteriaceae, продуцирующих БЛРС. Фосфомицин в особенности высокоактивен в отношении БЛРС-продуцирующих Escherichia coli как внебольничного, так и внутрибольничного происхождения. Кроме того, антибактериальная активность фосфомицина, как предполагается, не зависит от места, откуда были изъяты патогены – из мочевых путей или других источников. Более того, некоторые предварительные клинические данные говорят в пользу применения фосфомицина в лечении инфекций мочевых путей, вызванных БЛРС-продуцирующими Escherichia coli.
Низкий уровень перекрестной резистентности к фосфомицину, отмеченный у Enterobacteriaceae, продуцирующих БЛРС, не наблюдается среди препаратов, которые традиционно используются в борьбе с данными патогенами [6]. Это связано с тем, что резистентность Enterobacteriaceae к фосфомицину не опосредована в первую очередь плазмидами, но закодирована в хромосомах [41, 42]. Однако сопередача резистентности к фосфомицину и другим антибиотикам была также обнаружена в других работах [43–45]. Более того, на эффективность фосфомицина не влияют различные шаблоны формирования мультирезистентности ввиду уникальности его химической формулы и механизма действия [12, 46]. Помимо Enterobacteriaceae, продуцирующих БЛРС, рассмотренных в данном обзоре, также сообщалось о высокой активности фосфомицина по отношению к Enterobacteriaceae, резистентным к фторхинолонам [25, 47–49].
Проведенный обзор также позволил установить, что фосфомицин является надежным активным препаратом в лечении инфекций, вызванных Enterobacteriaceae, продуцирующих БЛРС, особенно Escherichia coli. Эти данные могут быть полезны при выборе тактики терапии внебольничных инфекций мочевых путей, ассоциированных с БЛРС, в основном Escherichia coli [5, 50]. Пероральный однократный прием фосфомицина трометамола является эффективным средством в лечении неосложненных инфекций мочевых путей [51]. Прочие традиционные эмпирические схемы с использованием фторхинолонов и ко-тримоксазола могут быть неэффективны против патогенов, продуцирующих БЛРС [6, 52], что приводит к неоптимальным результатам [53, 54].
Помимо фосфомицина для лечения неосложненных инфекций мочевых путей, вызванных патогенами, продуцирующими БЛРС, возможно пероральное применение нитрофурантоина, пивмециллинама и ко-амоксиклава [52, 55]. Исследования, оценивающие чувствительность Escherichia coli, продуцирующих БЛРС, к нитрофурантоину, приводят различные данные [19, 20, 24, 25, 27, 28, 58, 59]. Была обнаружена также резистентность изолятов Escherichia coli к нитрофурантоину и фторхинолонам [60]. Нитрофурантоин не является достоверно активным в отношении таких уропатогенов, как Klebsiella pneumoniae и Proteus mirabilis [56, 57]. Кроме того, продукция БЛРС связана со снижением чувствительности Klebsiella pneumoniae к нитрофурантоину [61].
Пивмециллинам, пероральный бета-лактам, также используется при острых неосложненных циститах, особенно в Северной Европе [62]. In vitro пивмециллинам обладает высокой активностью в отношении распространенных патогенов, в особенности Escherichia coli [56, 57]. Пивмециллинам, видимо, также обладает устойчивостью к гидролитическому воздействию AmpC бета-лактамаз [63]; однако доказательств активности пивмециллинама против Enterobacteriaceae, продуцирующих БЛРС, меньше, и они не так убедительны [64]. Тем не менее есть данные о том, что лечение пивмециллинамом было успешным в случае с рецидивирующим пиелонефритом, вызванным БЛРС-продуцирующей Escherichia coli, когда прочие препараты оказались бессильны [65].
Ко-амоксиклав in vitro обладает умеренной активностью против БЛРС-продуцирующих Escherichia coli [19, 25, 27–29, 66]. Хотя клиническая эффективность использования бета-лактамов в сочетании с ингибиторами бета-лактамаз остается до конца не ясной [52], применение ко-амоксиклава у 37 пациентов с циститом, вызванным БЛРС-продуцирующими Enterobacteriaceae, привело к удовлетворительным результатам (84% излечения) [35]. Несмотря на это, эффективность ко-амоксиклава вероятно ниже в подгруппе пациентов, инфицированных патогенами, для лечения которых необходима повышенная МИК препарата. Данные in vitro также показывают, что комбинация цефалоспоринов третьего поколения и клавулановой кислоты может нивелировать резистентность, обусловленную БЛРС [19, 67]. Однако клиническая эффективность подобной методики до конца не известна.
Точное количество внутривенно вводимого фосфомицина (доступен в Германии, Франции, Испании, Италии и Японии), необходимого для элиминации изолятов Enterobacteriaceae с повышенной резистентностью, следует еще установить. В одном из обзоров [10] указано, что применение фосфомицина в лечении инфекций, не относящихся к мочевому и желудочно-кишечному тракту, связано с такими же показателями излечения. Однако уровень доказательности был недостаточно высок. В настоящем обзоре данные об использовании фосфомицина внутривенно не рассматривались подробно. Тем не менее фосфомицин проявил высокую активность против инфекций различных локализаций. В соответствии с этим внутривенное применение фосфомицина может быть резервным вариантом при лечении энтеробактериальной инфекции, когда прочие препараты малоактивны или противопоказаны.
Однако определение антибактериальной активности фосфомицина зависит от специфических критериев определения чувствительности. Строгие критерии являются более подходящими для системных инфекций, нежели для тех, что вызывают инфекции нижних мочевых путей, поскольку фосфомицин достигает высоких концентраций в моче. Наиболее релевантные критерии CLSI чувствительности к фосфомицину (≤ 64 мг/л) ссылаются на специальные изоляты Escherichia coli [16]. Однако Европейский комитет по тестированию антимикробной чувствительности недавно принял новые контрольные показатели для чувствительности Enterobacteriaceae к фосфомицину, равные ≤ 32 мг/л, вне зависимости от локализации инфекции [68].
Кроме этого, использование фосфомицина в лечении системных инфекций может привести к высокому риску возникновения резистентности во время терапии. In vitro уровень спонтанных мутаций Enterobacteriaceae на фоне фосфомицина весьма высок [26, 69]. Тем не менее данные заключения никак не коррелируют с низким уровнем резистентности к фосфомицину в странах, где он используется в повседневной клинической практике [45, 70, 71]. Это может быть объяснено тем, что появление подобных мутаций влечет за собой биологические последствия, которые снижают общую способность штаммов к выживанию [69, 72].
Данный систематический обзор имеет ряд ограничений. Некоторые потенциально релевантные исследования выполнены в странах, где фосфомицин широко используется на практике, а результаты исследований были опубликованы на местных языках, что ограничивает их включение в данный обзор. Более того, отмечались существенные вариации в выборе критериев чувствительности (в том числе МИК) к фосфомицину [16, 39, 40] и методах определения чувствительности, что затрудняло их сравнение в едином обзоре.
Метод разведения агара является более предпочтительным в определении чувствительности микроорганизмов к фосфомицину [16], тогда как метод разведения питательного бульона может привести к противоречивым результатам [71, 74]. Определение чувствительности к фосфомицину рекомендуется выполнять с добавлением в питательную среду глюкозо-6-фосфата – вещества, присутствующего в человеческих клетках, которое повышает чувствительность к фосфомицину большинства энтеробактерий in vitro [73]. Эта деталь не была отдельно обговорена в исследованиях, включенных в данный обзор.
Заключение
Согласно имеющимся доказательствам, фосфомицин обладает высоким уровнем активности против БЛРС-продуцирующих изолятов энтеробактерий с повышенной резистентностью к антибиотикам. Это утверждение более справедливо в отношении изолятов Escherichia coli, продуцирующих БЛРС. Хотя клинические данные до сих пор ограничены, фосфомицин может быть ценным препаратом в лечении внебольничных инфекций нижних мочевых путей. Это особенно важно, когда показатели резистентности к прочим пероральным антибиотикам возрастают, что делает выбор препарата для эмпирической терапии затруднительным. Рекомендованы дальнейшие исследования, посвященные использованию фосфомицина в лечении осложненных инфекций мочевых путей или направленные на поиск дополнительных показаний.
Fosfomycin for the treatment of multidrug-resistant, including extended-spectrum β-lactamase producing, Enterobacteriaceae infections: a systematic review
M. Falagas1, 2, 3, A. Kastoris1, A. Kapaskelis1, 2, D. Karageorgopoulos1
1 Alfa Institute of Biomedical Sciences, Athens, Greece
2 Department of Medicine, Henry Dunant Hospital, Athens, Greece
3 Department of Medicine, Tufts University School of Medicine, Boston, USA
Contact person: Matthew Falagas, m.falagas@aibs.gr
Rising rates of resistance to antimicrobial drugs among Enterobacteriaceae limit the choice of reliably active forms of these drugs. We evaluated the evidence on fosfomycin as a treatment option for infections caused by members of the family Enterobacteriaceae with advanced resistance to antimicrobial drugs, including producers of extended-spectrum β-lactamase (ESBL). We systematically reviewed studies evaluating the antimicrobial activity, or the clinical effectiveness of fosfomycin. 17 antimicrobial-susceptibility studies were found and included in our Review, accounting for 5057 clinical isolates of Enterobacteriaceae with advanced resistance to antimicrobial drugs (4448 were producers of ESBL); 11 of the 17 studies reported that at least 90% of the isolates were susceptible to fosfomycin. Using a provisional minimum inhibitory concentration susceptibility breakpoint of 64 mg/L or less, 1604 (96,8%) of 1657 Escherichia coli isolates producing ESBL were susceptible to fosfomycin. Similarly, 608 (81,3%) of 748 Klebsiella pneumoniae isolates producing ESBL were susceptible to fosfomycin. In two clinical studies, oral treatment with fosfomycin-trometamol was clinically effective against complicated or uncomplicated lower urinary tract infections caused by ESBL-producing Escherichia coli in, cumulatively, 75 (93,8%) of the 80 patients evaluated. Initial clinical data support the use of fosfomycin for the treatment of urinary tract infections caused by these pathogens, although further research is needed.

