Гепатоцеллюлярный рак печени. Современные методы диагностики и лечения
- Аннотация
- Статья
- Ссылки

До последнего десятилетия рак печени считался фатальным злокачественным новообразованием [1]. В настоящее время гепатоцеллюлярный рак (ГЦР) занимает шестое место среди всех злокачественных опухолей и третье место по смертности от рака в мире [2]. В России в 2008 г. было выявлено 6473 случая рака печени. Однако распространенность ГЦР широко варьирует в различных регионах России. Общая заболеваемость ГЦР в России составляет 4,4 случаев у мужчин и 1,9 у женщин (на 100 тыс. населения) [3]. В то же время в Центральном регионе России этот показатель составляет 3,5 у мужчин и 1,6 у женщин, в районе Дальнего Востока – 8,4 и 3,5 случаев соответственно, а в Республике Саха возрастает до 17,2 случаев на 100 тыс. населения [4].
ГЦР в большинстве случаев развивается у больных, страдающих циррозом печени. Наиболее частыми причинами развития цирроза являются гепатиты В или С, алкогольный цирроз, наследственный гемохроматоз, тирозинемия, а также другие виды хронических заболеваний печени, которые влияют на развитие ГЦР, но ввиду их относительной редкости доля случаев рака, возникающего на их фоне, сравнительно невелика. В настоящее время не вызывает сомнения тот факт, что более чем в 80% случаев ГЦР развивается на фоне цирроза печени и является главной причиной смертности у этой группы больных [5]. Эффективная профилактика смертности от ГЦР заключается в устранении влияния на организм факторов риска и, в частности, проведении вакцинации против вирусов В или С, отказе от приема алкоголя, лечении метаболических нарушений, исключении продуктов, содержащих афлатоксины, ведении здорового образа жизни.
Успех в лечении ГЦР может быть достигнут только в случае диагностики заболевания в ранней (бессимптомной) стадии. В связи с этим всем больным циррозом печени следует проводить скрининг для выявления ГЦР в ранней стадии. До сих пор не имеется достоверных сведений о скорости роста ГЦР. По данным L. Barbara и соавт., двукратное увеличение объема опухоли происходит в течение 2–4 месяцев [6]. Таким образом, учитывая время удвоения опухоли, целесообразно проведение скрининга два раза в год [7]. Для скрининга применяются методики лучевой и серологической диагностики. Из методик лучевой диагностики в настоящее время наиболее часто используется УЗИ брюшной полости, чувствительность которого при ранних стадиях колеблется от 60 до 80% , а специфичность составляет 90% [8].
Для серологической диагностики ГЦР до последнего времени было рекомендовано определение онкомаркера альфафетопротеина (АФП). Однако результаты проспективных клинических исследований, в которых изучалась диагностическая ценность различных методов скрининга, показали: чувствительность АФП составила менее 25%, а специфичность – около 79% [9]. На сегодня установлено, что он является только маркером распространенного ГЦР. В настоящее время вместо АФП предложена панель других маркеров, в частности, лектин-реактивная фракция АФП, дез-гамма-карбоксипротромбин, глипикан. Тем не менее все предложенные онкомаркеры имеют те же недостатки, что и АФП, и ни один из них не может сравниться с УЗИ в диагностической достоверности [10, 11].
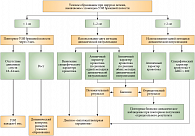
Для диагностики ГЦР следует использовать современные методы, которые применяются в онкологической практике. К ним относятся: УЗИ, спиральная или мультиспиральная РКТ, МРТ, ПЭТ, ПЭТ/КТ-сканирование, ангиография. На рисунке 1 представлен современный диагностический комплекс при выявлении узлового образования в печени на фоне цирроза [11]. ГЦР имеет некоторые клинические особенности, которые не характерны для солидных опухолей. Так как в большинстве случаев ГЦР диагностируется у больных на фоне цирроза печени, развитие печеночной недостаточности в этой группе больных в значительной степени определяет тактику лечения, его эффективность и выживаемость. Важное прогностическое значение имеет наличие патологической симптоматики, поскольку выбор противоопухолевых препаратов осуществляется с учетом функциональных резервов печени.
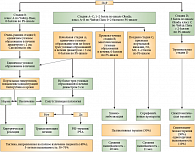
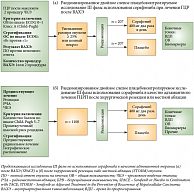
За последние 10 лет было предложено несколько систем определения стадии ГЦР, в которых учитывались как распространенность опухоли в печени, так и функциональное состояние органа [5, 13]. Единственной классификацией, принятой клиническими исследователями в этой области, является система BCLC (Barcelona Clinic Liver Cancer stading system), которая учитывает не только клиническую стадию опухоли, но и функциональное состояние печени, наличие патологической симптоматики, а также методы лечения [14]. Кроме того, при использовании данной классификации представляется возможным определить стадии, для каждой из которых может быть предложен соответствующий алгоритм лечения (рис. 2) [5].
Так, при ранней стадии ГЦР (стадия 0), которая рассматривается как опухоль in situ и характеризуется отсутствием патологических проявлений цирроза печени, использование хирургического метода лечения или радиочастотной аблации (РЧА) позволяет добиться показателя 5-летней выживаемости на уровне 80%. При стадии А, наличии не более трех узловых образований диаметром менее 3 см и отсутствии патологической симптоматики цирроза печени также удается добиться значительных успехов. Выполнение радикальной операции или РЧА приводит к 5-летней выживаемости у 50–75% больных.
При промежуточной стадии В, когда выявляются множественные опухолевые образования размером более 3 см и функциональное состояние печени соответствует классу А по Чайлд-Пью, может быть использована химиоэмболизация. Продолжительность жизни у этой группы больных составляет 20 месяцев. В случаях диагностики ГЦР в стадии С общее состояние больных соответствует средней степени тяжести. В настоящее время единственным методом лечения этой группы больных является лекарственная противоопухолевая терапия. Терминальная стадия D характеризуется развитием печеночной недостаточности, в этих случаях проводится только симптоматическая терапия. Средняя продолжительность жизни в этой группе больных составляет около 3 месяцев [5].
При одиночном опухолевом узле и отсутствии признаков цирроза наиболее эффективным методом излечения является хирургическая резекция печени [15]. У больных ГЦР в стадии A после хирургических вмешательств при сроках наблюдения свыше 5 лет более чем в 70% случаев диагностируется рецидив заболевания. Оказалось, что у 2/3 больных после операции развиваются метастазы в оставшихся долях печени, а у 30–40% возникает ГЦР de novo [16].
Метастазы, как правило, выявляются в первые два года после резекции печени. Поражение носит мультифокальный характер, что указывает на истинное метастазирование. Появление новообразований в печени при более поздних сроках наблюдения трактуется как развитие опухоли de novo [17]. В связи с высоким риском метастазирования после оперативного лечения были предприняты попытки использования адъювантной терапии. К настоящему времени изучено несколько видов послеоперационной терапии, в том числе химиоэмболизация, липидолизация, внутрипеченочное облучение, химиотерапия, иммунотерапия [18, 19]. К сожалению, убедительных данных об эффективности адъювантной терапии при ГЦР не получено. В связи с этим послеоперационная терапия при ГЦР не может быть рекомендована в рутинной практике.
В настоящее время в ведущих клиниках мира используется трансплантация печени при ГЦР. Более чем 20-летний мировой опыт показывает: удаление печени, пораженной ГЦР, с последующей трансплантацией донорской печени возможно у ограниченного числа больных [20]. Подобная лечебная процедура оказалась эффективной у больных при единичном опухолевом узле диаметром до 5 см, при отсутствии признаков прорастания в опухоли кровеносных сосудов и внепеченочной диссеминации. В этих случаях 4-летняя выживаемость достигается у 75% больных, а частота рецидивирования составляет 8% [21, 22]. Радиочастотная чреcкожная аблация является одним из методов выбора лечения больных с начальными стадиями ГЦР при невозможности выполнения резекции печени или при наличии противопоказаний для выполнения трансплантации печени, обусловленных сопутствующими заболеваниями.
Наилучшие клинические результаты при использовании аблации были получены у больных с единичными опухолевыми узлами ГЦР диаметром менее 2 см при нормальной функции печени, особенно в тех случаях, когда достигается полный некроз опухоли [23]. Разрушение опухоли может достигаться различными методами, в частности, путем инстилляции в опухоль химических веществ – этанола или уксусной кислоты, изменения температуры в опухолевых очагах с использованием РЧА и криоаблации. Чрескожное введение этанола позволяет добиться полного некроза опухоли в 80% случаев, когда размер образования не превышает 3 см. Пятилетняя выживаемость в этой группе больных составляет около 50% [24].
Радиочастотная аблация чаще всего используется у больных с ранними стадиями ГЦР, имеющих противопоказания к хирургическому методу лечения. Метаанализ сравнения эффективности РЧА и инстилляции этанола подтвердил преимущество РЧА в выживаемости при опухолях до 2 см. Пятилетняя выживаемость составила 70% и сопоставима с результатами при хирургической резекции печени [25]. При более распространенном опухолевом процессе в промежуточной стадии В широко используется химиоэмболизация кровеносных сосудов опухоли. В настоящее время химиоэмболизация является единственным методом, который увеличивает выживаемость у этой группы больных.
В основе трансартериальной химиоэмболизации (ТАХЭ) лежит воздействие на артериальные сосуды, кровоснабжающие опухолевый очаг ГЦР. При проведении ТАХЭ выполняется селективная катетеризация печеночной артерии, в которую вводится противоопухолевый препарат в специальной транспортной среде (чаще всего используется липоидол). В результате такой процедуры достигается окклюзия артериальных сосудов. Наиболее часто для химиоэмболизации используются адриамицин (доксорубицин) или цисплатин [26].
При проведении ТАХЭ некроз опухоли достигается более чем у 50% пациентов. Кроме того, у 2% больных регистрируется полная регрессия опухоли, определяемая с помощью КТ и МРТ. Улучшение двухлетней выживаемости отмечено у 20–60% больных [11, 27]. В течение многих лет изучались различные противоопухолевые препараты для лечения ГЦР. Однако ни один из этих препаратов и их сочетания не позволили добиться ни улучшения непосредственных результатов, ни увеличения продолжительности жизни [28].
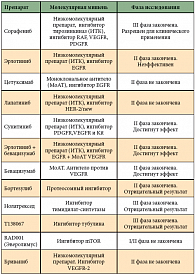
Успехи в расшифровке механизмов внутриклеточной передачи сигналов в злокачественных клетках позволили разработать новые препараты направленного действия для лечения злокачественных опухолей, в том числе ГЦР. В настоящее время идентифицированы внутриклеточные белки, участвующие в развитии и прогрессировании ГЦР. К ним относятся: RAS/RAF/MEK/ERK/PI3K/AKT/mTOR; Wnt/B-катенин, сигнальный путь C-MET, сигнальный путь Hedgehog; ангиогенный сигнальный путь; рецепторы эпидермального фактора роста (EGFR); инсулиноподобный фактор роста (IGF-1); теломераза. В таблице 1 представлены таргетные препараты, которые изучаются при ГЦР.
В настоящее время единственным препаратом для лечения ГЦР является сорафениб (Нексавар®) , относящийся к группе мультикиназных ингибиторов тирозинкиназ). Сорафениб является препаратом с низкомолекулярной массой и высокой биодоступностью. Механизм его действия заключается в блокировании сигнального каскада опухолевой клетки. Он воздействует на сигнальный путь RAf/MEK/ERK путем ингибирования RAf-киназы и различных тирозинкиназ, рецептора VEGF 2-го типа (VEGFR-2), рецептора тромбоцитарного фактора роста, рецепторов C-Kit. Препарат применяется перорально [29, 30]. Вторая фаза клинических исследований при ГЦР была проведена у 137 больных с сопутствующим циррозом печени класса А или В по Чайлд-Пью. Непосредственный частичный эффект был зарегистрирован у 5% больных. При этом медиана общей выживаемости составила 9,2 месяца, а медиана времени до прогрессирования – 5,5 месяца.
Так как при проведении II фазы клинического исследования cорафениба при ГЦР включались не только больные с циррозом класса А и В по Чайлд-Пью, был проведен анализ эффективности cорафениба у более тяжелой группы больных с выраженными симптомами функциональной недостаточности печени. Из 137 больных, включенных в исследование, 98 (72%) были отнесены к группе А по Чайлд-Пью и 39 (28%) к группе В. Было отмечено, что общая выживаемость и время до прогрессирования в этих группах имеют существенные различия. Так, общая выживаемость у больных со статусом А составила 9,4 месяца, а в группе В – всего 3,2 месяца. Время до прогрессирования – 4,8 и 3,0 месяца соответственно. Также в группе В приходилось чаще уменьшать дозу сорафениба – в 31% случаев, по сравнению с 21% в группе А. Из тяжелых токсических реакций наиболее часто встречался ладонно-подошвенный синдром, который наблюдался у 30% группы В и в 13% случаев в группе A [31].
Полученные результаты II фазы клинического изучения cорафениба при ГЦР легли в основу большого мультицентрового Европейского рандомизированного плацебоконтролируемого исследования SHARP. Рандомизация проводилась в соотношении 2:1. Сорафениб назначался по 400 мг перорально дважды в день, лечение проводилось до прогрессирования заболевания. В исследование было включено 602 больных, из них 299 пациентов получали cорафениб и 303 пациента – плацебо. Критериями включения больных были: общий статус по шкале ECOG не выше 2 баллов, функция печени по Чайлд-Пью – класс А, отсутствие предшествующей системной химиотерапии. Основными показателями эффективности сорафениба являлись общая выживаемость, время до появления симптомов прогрессирования опухоли. Вторичными параметрами были время до прогрессирования, контроль заболевания и переносимость препарата.
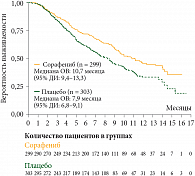
Во втором промежуточном анализе было принято решение о прекращении исследования в связи со статистически значимым увеличением показателей общей выживаемости в группе больных, получавших сорафениб; больные группы плацебо были переведены на лечение сорафенибом. Общая выживаемость составила 10,7 месяца у больных, леченных сорафенибом, и 7,9 месяца в группе плацебо (HR = 0,69; 95% ДИ = 0,55–0,87; р < 0,001). Таким образом, отмечается снижение риска смерти на 31% в группе больных, получавших сорафениб. Одногодичная выживаемость наблюдалась в 44% и 33% случаев в группе сорафениба и плацебо соответственно [32]. Результаты общей выживаемости представлены на рисунке 3 [33].
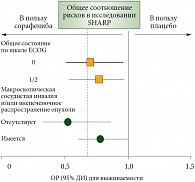
Сорафениб также статистически значимо удлиняет медиану времени до прогрессирования. В сравниваемых группах она составила 5,5 и 2,8 месяца (HR = 0,58; 95% ДИ = 0,45–0,74; p < 0,001). Контроль заболевания был выше в группе больных, получавших сорафениб, – 43% против 32% на плацебо (p = 0,002). Показатели времени до появления клинической симптоматики и прогрессирования заболевания не различались в обеих группах больных. Анализ эффективности сорафениба в различных группах больных показал, что препарат наиболее эффективен у больных с ECOG 0 при отсутствии макроскопической инвазии сосудов печени и экстрапеченочных зон опухолевого поражения. На рисунке 4 показаны преимущества сорафениба в зависимости от различных факторов развития болезни [33].
Эффективность сорафениба значительно выше в так называемой благоприятной группе больных, у которой отсутствуют общие проявления болезни, не выявляется вовлечения в опухолевый процесс кровеносных сосудов и отсутствуют внепеченочные опухолевые поражения. Сорафениб хорошо переносится больными. При применении сорафениба наиболее часто встречались тяжелые токсические реакции III/IV степени в виде ладонно-подошвенного синдрома и диареи, которые были отмечены в 8% случаев. Отмена сорафениба и плацебо в связи с развитием побочных реакций имела место в 38 и 37% случаев соответственно. В другом аналогичном Азиатско-Тихоокеанском исследовании участвовало 226 больных ГЦР. Рандомизация производилась в соотношении 2:1 (сорафениб/плацебо). Однако критерии включения больных в этом исследовании значительно отличались от исследования SHARP.
В Азиатско-Тихоокеанском исследовании преимущественно участвовали больные, у которых был диагностирован гепатит В, – 73% (для сравнения: в исследовании SHARP этот показатель составил 18%). Кроме того, статус по ECOG 1–2 также чаще наблюдался в азиатской группе – 74% против 46% в европейской группе. Экстрапеченочные проявления болезни были диагностированы у большего числа больных – 69 и 31% соответственно. Общая выживаемость была значительно меньше и составила 6,5 месяца по сравнению с 10,7 месяца в европейском исследовании. Сравнительный анализ токсичности сорафениба показал, что у больных с нарушенной функцией печени в группе В по Чайлд-Пью значительно чаще приходилось редуцировать дозу препарата – 31% против 21% в группе А. Кроме того, ладонно-подошвенный синдром также чаще наблюдался у больных в группе B, чем в группе А, – 30 и 13% соответственно. Чаще фиксировалось повышение билирубина, развитие асцита и энцефалопатии у больных с циррозом класса В по Чайлд-Пью [32].
В таблице 2 представлены данные эффективности сорафениба по сравнению с плацебо в Европейском и Азиатско-Тихоокеанском исследованиях [31, 32]. Авторы объясняют снижение эффективности сорафениба в азиатской группе больных тем, что в исследование были включены преимущественно пациенты, страдающие гепатитом В, при котором больше поражаются гепатоциты, что приводит к более выраженному нарушению функции печени, более тяжелому общему состоянию, а также распространению опухолевого процесса за пределы первичного очага в печени. Таким образом, сорафениб на сегодняшний день остается пока единственным эффективным препаратом при ГЦР. В настоящее время запланированы исследования по изучению эффективности сорафениба в нео- и адъювантном режимах лечения ГЦР (рис. 5) [33].
Заключение
Сорафениб (Нексавар®) является единственным противоопухолевым препаратом, эффективным при ГЦР. Применение его в клинической практике позволило достичь выраженного эффекта у больных с ГЦР, ранее считавшимся резистентным ко всем лекарственным средствам, используемым в онкологии. Дальнейшие успехи в области молекулярно-генетических исследований, расшифровке механизмов сигнальных путей передачи информации в опухолевых клетках позволяют надеяться на излечение этой болезни, еще несколько лет назад считавшейся неизлечимой.

