Инозитол: от накопленных знаний к новациям*
- Аннотация
- Статья
- Ссылки
- English


Введение: обзор инозитола
История открытия и биологическая роль инозитола
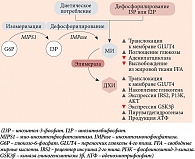
Интерес научного сообщества к инозитолу, особенно в области гинекологии и эндокринологии, возник только в последние 20 лет, хотя вещество было открыто исследователями достаточно давно. В 1850 г. немецкий врач и химик J.J. Scherer выделил гексагидроксициклогексан из мышечных клеток и назвал молекулу «инозитол» по комбинации греческих терминов (ìς («сухожилие, волокно»), ose (обозначение углевода), ite («сложный эфир»), ol («спирт»)), а также из-за его сладкого вкуса [1]. Лишь через много лет L. Maquenne установил структуру инозитол-циклогексанола, выделив его из листьев растений [2]. Столетие спустя в блестящей работе T. Posternak была описана конфигурация основного изомера инозитола в тканях эукариот мио-инозитола (МИ) [3]. Структура гексагидроксициклогексана существует в форме девяти различных стереоизомеров: цис-, эпи-, алло-, мио-, нео-, сцилло-, L-хиро-, D-хиро- и муко-инозитол (рис. 1) [4].
МИ – это органический осмолит, регулирующий клеточный ответ на окружающую гипертоническую среду. При повышении внеклеточного давления МИ поступает в клетки как путем простой диффузии, так и с помощью сложной системы транспортеров: натриевых транспортеров МИ (SMIT1 и SMIT2) и H+-связанных транспортеров МИ (HMIT) [5–7]. Транспортеры инозитола были обнаружены в нескольких тканях, включая почки, мозг, печень, поджелудочную железу, плаценту, сердце и скелетные мышцы [8, 9].
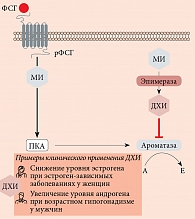
Инозитол является важным компонентом структурных липидов, а именно фосфатидилинозитола (PI) и его различных фосфатов, включая липиды фосфатидилинозитол фосфата (PIP) [10]. МИ в основном встроен в мембраны эукариотических клеток в виде фосфатидил-миоинозитола, предшественника инозитол-3-фосфата (I3P), который действует как вторичный мессенджер в передаче нескольких эндокринных сигналов, включая фолликулостимулирующий гормон (ФСГ), тиреотропный гормон и инсулин.
В организм человека МИ поступает с пищей в количестве около 1 г в день. Его источниками являются злаки, бобовые, масличные семена и орехи [11]. Но значительная часть суточной потребности синтезируется самим организмом (около 4 г в день). При этом основным органом, производящим МИ, являются почки.
Физиологически МИ синтезируется из глюкозо-6-фосфата (G6P), который изомеризуется в инозитол-3-фосфат (I3P) с помощью фермента D-3-мио-инозитол-фосфатсинтазы (инозитолсинтаза, Ino1 или MIPS1) [12], затем дефосфорилируется с помощью инозитолмонофосфатазы-1 (IMPA-1) в свободный МИ [13]. Свободный МИ также образуется путем дефосфорилирования инозитол-1,4,5-трифосфата (I3P) и инозитол-1,4-бисфосфата (I2P).
Когда эндогенная продукция МИ недостаточна для выполнения биологических функций в организме, появляется необходимость восполнения инозитола через определенные продукты питания и/или биологические добавки [14] (рис. 2).
МИ активирует внутриклеточное перемещение транспортера глюкозы GLUT4 к клеточной мембране, обеспечивая поступление глюкозы внутрь клетки, а также ингибирует аденилатциклазу, тем самым снижая образование свободных жирных кислот из жировой ткани [15, 16]. Не случайно ткани с высоким уровнем потребления глюкозы, такие как мозг, сердце и яичники, содержат большое количество МИ [17].
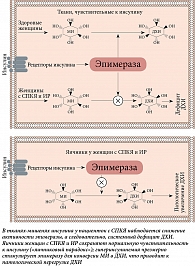
При стимуляции инсулином тканеспецифичного фермента эпимераза МИ конвертируется в другой стереоизомер инозитола – ДХИ [18]. Это однонаправленная реакция, которая позволяет каждому органу и ткани регулировать определенное физиологическое соотношение между МИ и ДХИ для обеспечения нормальных метаболических процессов и, следовательно, физиологического состояния. ДХИ стимулирует гликогенсинтазу, поэтому его концентрация высока в тканях, депонирующих гликоген, таких как печень и скелетные мышцы [16]. Помимо этого ДХИ увеличивает экспрессию мРНК и экспрессию белков IRS2, PI3K и AKT, повышает уровень белка P-AKT и подавляет GSK3β [19], таким образом играя ключевую роль в передаче сигналов инсулина и других гормонов. Посредством данных реакций ДХИ снижает количество цитозольной глюкозы, создавая градиент концентрации, который активирует транспортеры GLUT4 в клеточной мембране и стимулирует их к клеточному поглощению глюкозы. Данные транспортеры экспрессируются во внутриклеточных везикулах и под влиянием ДХИ перемещаются к клеточной мембране [20]. ДХИ также индуцирует гликолиз, активируя пируватдегидрогеназу для включения глюкозы в цикл Кребса с образованием аденозинтрифосфорной кислоты (АТФ) [21, 22]. Благодаря перечисленным механизмам МИ и ДХИ оказывают инсулин-сенсибилизирующее действие, снижая потребность тканей в инсулине с последующим снижением его концентрации в крови [23].
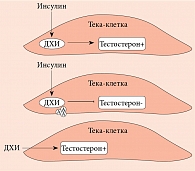
Впервые использовать добавки инозитола в качестве медиаторов инсулина предложили J. Larner и соавт. [22–25]. Они выделили и очистили два гликана, содержащих ДХИ и МИ. Оба гликана проявляли свойства миметика инсулина при введении in vivo. Так, при внутривенном введении эти соединения дозозависимо снижали гипергликемию у крыс с индуцированным стрептозотоцином диабетом. В то же время при внутрибрюшинном введении они стимулировали включение меченой глюкозы в гликоген в мышцах диафрагмы крыс [26]. Одновременно J.E. Nestler и соавт. подтвердили инсулино-миметическое воздействие гликана, содержащего ДХИ (названного INS-2), на тека-клетки яичников человека [27, 28]. Они установили, что и инсулин, и ДХИ стимулировали биосинтез тестостерона, который блокировался антителом, направленным против этого гликана (рис. 3).
Открытие инсулинсенсибилизирующих свойств инозитола вызвало большой резонанс в научном сообществе. Вместе с тем значительно возросло количество исследований, связанных с их использованием в клинической практике.
Инозитол и репродукция человека
Стало также известно, что помимо участия в метаболизме глюкозы инозитол тесно связан с репродуктивной функцией как у женщин, так и у мужчин. В частности, у женщин МИ является вторичным мессенджером ФСГ (рис. 4) и непосредственно участвует в фолликуло- и оогенезе [29]. Он регулирует пролиферацию и созревание гранулезных клеток в яичниках, опосредует ФСГ-индуцированную выработку антимюллерова гормона (АМГ), играет ключевую роль в развитии и транспортировке зрелых ооцитов, а также положительно влияет на качество эмбрионов [29].
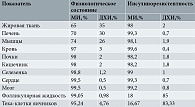
Яичники, как и другие органы и ткани, характеризуются определенным соотношением МИ и ДХИ, поддерживающим их здоровое состояние и необходимые функции (таблица) [18, 30, 31]. Принимая во внимание указанные свойства стереоизомеров инозитола, логично предположить, что концентрация МИ в репродуктивных органах женщины значительно выше концентрации ДХИ и имеет ключевое значение в здоровье яичников. В то же время высокая концентрация ДХИ, наоборот, способна негативно влиять на качество ооцитов и бластоцист [30].
Рассматривая влияние инозитола на репродуктивную функцию, необходимо учитывать и другой эффект инозитола, а точнее, его влияние на стероидогенез, хотя данный вопрос остается не до конца изученным. Известно, что МИ и ДХИ оказывают непосредственное, но противоположное влияние на уровень андрогенов и эстрогенов в организме.
J. Larner и J.E. Nestler сфокусировали внимание прежде всего на ДХИ, сделав вывод о том, что этот стереоизомер инозитола влияет на стероидогенез, стимулируя выработку андрогенов тека-клетками яичников. Позднее S. Sacchi и соавт. предложили второй механизм, с помощью которого ДХИ может влиять на стероидогенез, а именно путем модуляции экспрессии фермента ароматазы и прямого подавления образования эстрогенов [32]. Принимая во внимание роль соотношения стереоизомеров инозитола для функционирования тканей, становится понятно, что нарушение физиологической пропорции МИ/ДХИ способно вызывать дисбаланс половых гормонов, наблюдаемый, например, при СПКЯ, или возникнуть вторично при приеме некоторых фармакологических препаратов в результате нарушения абсорбции в кишечнике или конкуренции с глюкозой в продуктах питания и напитках.
С учетом возрастающего интереса со стороны медицинского сообщества к клиническому применению инозитола, а также полученных доказательств о новых эффектах ДХИ целью настоящей публикации стало представление наиболее достоверных данных о применении инозитола в клинической практике, а также презентация новых терапевтических подходов к возможному применению инозитола в новых областях медицины.
Несистематический обзор был проведен на основе следующих баз данных: MEDLINE, EMBASE, Global Health, The Cochrane Library (Cochrane Database of Systematic Reviews, Cochrane Central Register of Controlled Trials, Cochrane Methodology Register), Health Technology Assessment Database, а также Web of Science.
Рассматривались статьи исключительно на английском языке, без ограничений по году публикации. Ключевые слова, используемые для поиска данных: мио-инозитол; D-хиро-инозитол; эпимераза; ФСГ; СПКЯ; стероидогенез; ароматаза; тестостерон; ГСД; ДНТ (дефекты нервной трубки).
Найденные публикации просматривались двумя независимыми экспертами на предмет совпадения с клиническим вопросом данного несистематического обзора. Далее два других независимых члена экспертной группы тщательно рассматривали полный текст отобранных статей. В случае возникновения разногласий между двумя проверяющими привлекался третий независимый эксперт. При отборе публикаций оба автора независимо друг от друга извлекли из них данные об особенностях исследования, группах населения, типах вмешательства и терапевтических результатах. Все разногласия разрешались путем обсуждения (с привлечением при необходимости третьего автора). С учетом особенностей отбора был проведен повествовательный синтез результатов из отобранных исследований.
Терапия инозитолом, с учетом его физиологической роли в организме и негативных последствий в случае нарушения физиологического соотношения МИ и ДХИ, преследует две основные цели: восстановление физиологического соотношения инозитола и контролируемое изменение соотношения для достижения конкретного терапевтического эффекта.
Эффективность применения инозитола в репродукции человека
Применение инозитола и женская репродукция (СПКЯ, метаболизм и овуляция)
СПКЯ – наиболее распространенное эндокринное заболевание среди женщин репродуктивного возраста. Согласно Роттердамским критериям, для постановки диагноза требуется не менее двух из следующих критериев: хроническая овуляторная дисфункция (олиго- или ановуляция, аменорея), эхографические признаки поликистозных яичников и гиперандрогения [33].
Инсулинорезистентность (ИР) и компенсаторная гиперинсулинемия играют центральную роль в патогенезе СПКЯ [34, 35], оказывая прямое и косвенное влияние на развитие гиперандрогении и связанных с ней клинических проявлений. Инсулин способен напрямую стимулировать тека-клетки яичников к выработке повышенных уровней андрогенов и подавлять продукцию глобулина, связывающего половые стероиды (ГСПГ), что приводит к повышению уровня свободных андрогенов в крови. Эффективность инсулин-сенсибилизирующих препаратов, таких как метформин и тиазолидиндионы, в улучшении овуляторной функции и снижении избытка андрогенов у пациенток с СПКЯ является дополнительным доказательством патогенной роли ИР при СПКЯ [36].
В этом контексте инозитол, с учетом его метаболической и гормональной активности, может быть предложен в качестве эффективной и хорошо переносимой альтернативы данным препаратам.
На Первой международной консенсусной конференции в 2013 г., посвященной роли МИ и ДХИ в акушерстве и гинекологии, было признано, что оба стереоизомера инозитола участвуют в патогенезе СПКЯ, а клинические исследования доказали их широкие терапевтические возможности в улучшении метаболических параметров и репродуктологии [37]. Примечательно, что для таких заболеваний, как сахарный диабет 2-го типа, характерно снижение чувствительности рецепторов многих тканей к инсулину, что приводит к уменьшению активности эпимеразы и продукции ДХИ [18, 38]. Однако в отличие от большинства тканей яичники могут сохранять нормальную чувствительность к инсулину, даже несмотря на наличие системной ИР. Действительно, согласно так называемому парадоксу яичников, последние никогда не становятся инсулинорезистентными, и поэтому компенсаторная гиперинсулинемия чрезмерно стимулирует активность эпимеразы яичников, вызывая избыточный синтез ДХИ за счет конвертации из МИ [39, 40] (рис. 5). В результате возникающее нарушение соотношения МИ и ДХИ в яичниках может участвовать в патогенезе СПКЯ у инсулинорезистентных пациенток. Фактически увеличение концентрации ДХИ способствует синтезу андрогенов, в то время как снижение уровня МИ ухудшает передачу сигналов ФСГ и качество ооцитов [21, 40]. Два независимых исследования показали, что в яичниках здоровых женщин количество МИ значительно превышает ДХИ (в соотношении примерно 100:1). Напротив, в яичниках пациенток с СПКЯ были обнаружены выраженный недостаток уровня МИ и повышенное содержание ДХИ (соотношение снизилось до 0,2:1). Теория «парадокса яичников» объясняет, почему употребление ДХИ, особенно в высоких дозах (> 1200 мг) и в течение длительного периода времени (свыше трех месяцев), не дает эффективных результатов в лечении СПКЯ, несмотря на некоторые обнадеживающие результаты, полученные в 1999 г. [41]. В данном исследовании пациенткам с СПКЯ, страдавшим избыточным весом и гиперинсулинемией, назначали 1200 мг ДХИ в день в течение 6–8 недель. В результате лечения снизился уровень свободного тестостерона, улучшились овуляторная функция и метаболические параметры. Предположительно лечение ДХИ снижало системные уровни инсулина, что приводило к увеличению концентрации МИ в яичниках, а соответственно улучшало чувствительность к ФСГ и восстанавливало овуляцию в краткосрочной перспективе. Та же группа исследователей попыталась воспроизвести свои результаты, назначив женщинам с СПКЯ 2400 мг ДХИ в течение шести недель [42]. Авторы исследования установили, что, хотя чувствительность к инсулину и метаболические параметры значительно улучшились, уровни тестостерона не показали тенденции к снижению, которая наблюдалась ранее. Уровень тестостерона после лечения ДХИ не снизился. Напротив, его средние значения незначительно увеличились (общий тестостерон +14,7% по сравнению с базальным уровнем, свободный тестостерон +29%). Когда доза ДХИ превысила 2400 мг/день, улучшения ни метаболической, ни гормональной картины не наблюдалось, что подтвердило возможность различных доз ДХИ вызывать разнонаправленные эффекты.
В отношении МИ, наоборот, несколько независимых исследований подтвердили его эффективность и безопасность в улучшении клинической картины при лечении симптомов СПКЯ [43]. При этом наиболее многообещающие результаты наблюдались при лечении женщин с СПКЯ в сочетании с ожирением и ИР комбинированной терапией МИ и ДХИ в соотношении 40:1 [44–50], тогда как ни одно другое соотношение не показало такой клинической состоятельности [51]. Соотношение 40:1 считается наиболее близким к физиологическому соотношению в плазме у здоровых женщин [51–54], что демонстрирует целесообразность его назначения для восстановления физиологического баланса МИ и ДХИ. Между тем в другом исследовании [55] количество ДХИ в соотношении 40:1 рассматривалось как слишком низкое и предлагалось увеличить количество ДХИ в соотношении. Однако использование ДХИ в высоких дозах и в течение длительного времени вызывает определенные опасения [56].
Инозитол и течение беременности (профилактика ДНТ у фолат-резистентных женщин и ГСД)
Повышенная во время беременности ИР в сочетании с гипергликемией формирует клиническую картину ГСД. ГСД ассоциирован с осложнениями как для будущей матери (гестационная гипертензия, риск кесарева сечения и развитие диабета 2-го типа в долгосрочной перспективе), так и для ребенка (преждевременные роды, врожденные аномалии, макросомия, микросомия, неонатальная гипогликемия и респираторный дистресс-синдром) [57]. Кроме того, дети, родившиеся от женщин с ГСД, находятся в группе риска развития нарушения регуляции глюкозы в более позднем возрасте, а также наследуют риск развития диабета и ожирения [58]. Поэтому всем беременным рекомендовано проходить скрининг ГСД [59] на ранних сроках и между 24-й и 28-й неделями беременности.
В современной научной литературе представлены три основных подхода к лечению ГСД: изменение образа жизни (диета и физическая активность), терапия метформином или инсулином и употребление инозитола в форме биологически активной добавки. Соответствующая диета и физическая активность являются первой линией терапии по снижению уровня сахара в крови. Если изменение образа жизни не дает желаемых результатов, рекомендуется фармакологическая терапия. Метформин все чаще назначается во время беременности из-за его гипогликемического эффекта [60–64]. Однако демонстрируемый в более ранних клинических исследованиях [65–67] эффект метформина в снижении риска развития ГСД не был подтвержден в последующих исследованиях [68]. И хотя в целом прием метформина во время беременности считается безопасным, убедительных данных о долгосрочной безопасности у потомства нет [60–62].
Наряду с этим в ряде клинических исследований убедительно продемонстрированы эффективность и хорошая переносимость инозитола, главным образом МИ, в профилактике и лечении ГСД. Результаты двух метаанализов исследований показали, что именно МИ, даже в большей степени, чем ДХИ или их комбинация, снижает частоту ГСД, улучшает показатели гликемии, липидного профиля и ИР, а также уменьшает потребность в инсулиновой терапии в случае развития ГСД [69, 70]. Другие независимые обзоры также подтвердили потенциал МИ в предотвращении ГСД у отдельных групп женщин [71–73].
Интересные результаты лечения ГСД получены в недавнем исследовании R. D’Anna и соавт. [74]. Ученые исследовали группу из 120 пациенток с ГСД, которая была рандомизирована на две подгруппы: 60 женщин группы лечения получали добавку 2 г МИ, 50 мг альфа-лактальбумина (α-LA) и 200 мкг фолиевой кислоты два раза в день, 60 женщин контрольной группы – 200 мкг фолиевой кислоты два раза в день. В группе женщин, получавших лечение комбинацией МИ и α-LA, наблюдались снижение ИР, уменьшение количества пациенток, нуждающихся в инсулине, сокращение окружности талии у плода и толщины подкожной жировой ткани новорожденных по сравнению с контрольной группой. Кроме того, в группе лечения отсутствовали случаи преждевременных родов, в то время как в контрольной группе их насчитывалось 15,2% от общего числа родов.
Примерно в тот же период было опубликовано международное многоцентровое двойное слепое рандомизированное контролируемое исследование (NiPPeR) [75], в котором представлено независимое от предыдущих исследований мнение. В данном исследовании авторы изучали влияние на гестационную гликемию биологических добавок, содержащих МИ, пробиотики и несколько микронутриентов, принимаемых с преконцепционного периода и на протяжении всей беременности. Авторам не удалось воспроизвести результаты предыдущих исследований: не выявлено каких-либо существенных изменений гестационной гликемии, частоты ГСД и макросомии. Они предположили, что отсутствие эффекта в отношении снижения гликемии обусловлено в первую очередь дизайном исследования, в котором в основном участвовали здоровые женщины (многие из них не имели повышенного риска ГСД), а также возможным конкурирующим действием компонентов в комбинации. Кроме того, значительная часть испытуемых принадлежала к азиатской расе (китаянки и др.). Не исключено, что, если бы МИ принимался отдельно, результаты были бы наиболее приближены к предыдущим исследованиям.
В целом, несмотря на обнадеживающие данные в различных группах риска, таких как женщины с ожирением и/или СПКЯ, полученных результатов все еще недостаточно для включения МИ в качестве рутинной биологической добавки в клинические рекомендации по ведению ГСД. Тем не менее члены экспертной группы сходятся во мнении, что назначение МИ на ранних сроках беременности является эффективной профилактикой ГСД. Не исключено, что в скором времени добавки МИ будут включены в протоколы по ГСД.
Предполагается также, что дефицит инозитола в организме беременной связан с ДНТ и некоторыми другими пороками развития спинного и головного мозга плода [76]. Полученные в исследованиях данные подтверждают высокую потребность в инозитоле при заращении нервной трубки у плода, а также связь между недостатком инозитола и развитием ДНТ на фоне ГСД.
Прямая потребность в инозитоле при закрытии нервной трубки была показана у грызунов, у которых дефицит инозитола в культуре эмбрионов приводил к краниальным ДНТ [77, 78]. У людей также была выявлена зависимость между низким содержанием МИ в сыворотке крови матери и возникновением дефекта закрытия позвоночного столба (spina bifida) у плода [79], что в свою очередь может указывать на связь между дефицитом инозитола и ДНТ, как и в случае с грызунами. Существует гипотеза, что генетические дефекты мио-инозитолсинтазы ISYNA1, которая также экспрессируется в плаценте и желточном мешке [80, 81], могут приводить к низкому уровню клеточного МИ у матери и/или плода, а следовательно, развитию ДНТ. Однако исследование «случай – контроль» не подтвердило данного предположения [82]. В то же время в первые недели беременности концентрация инозитола в эмбриональном компартменте значительно выше, чем в материнской сыворотке [83]. Это говорит о том, что активные транспортные механизмы для инозитола, опосредованные переносчиками, устанавливаются на ранних сроках беременности и/или имеет место значительная продукция инозитола плацентой/плодом [84].
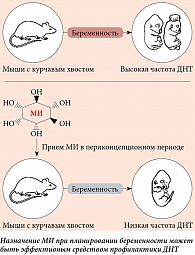
Доказательства эффективности инозитола в качестве профилактики спинальных ДНТ были получены в исследованиях на мышах с курчавым хвостом, у которых фолиевая кислота не оказывала эффективного действия аналогично с фолат-резистентными пациентами [85]. Добавка инозитола снижала частоту расщепления позвоночника у этих мышей (рис. 6), причем при введении их как матерям, так и в культуру эмбрионов [86]. Как МИ, так и ДХИ способны предотвращать ДНТ у моделей с курчавым хвостом с вовлечением специфических изоформ протеинкиназы C [87, 88].
Высокое содержание МИ в развивающейся центральной нервной системе, скелете и сердечной мышце обосновывает высокую потребность эмбриона в этой биологической добавке [89]. МИ действует как предшественник образования фосфоинозитидов, которые опосредуют передачу внутриклеточных сигналов [76, 90]. МИ, равно как и другие полиолы, способен выполнять множество функций во время эмбриогенеза, действуя в качестве осмолита и способствуя расширению амниотической и целомической полостей, обеспечивает предшественниками компоненты клеточной мембраны и поставляет субстраты для пентозофосфатного пути, необходимого для синтеза нуклеиновых кислот [83]. Помимо этого высокая концентрация полиолов в эмбриональном компартменте может отражать зависимость эмбриогенеза от их метаболизма, что позволяет поддерживать концентрацию АТФ и окислительно-восстановительный потенциал в период раннего развития эмбриона в среде с низким содержанием кислорода [83]. Помимо прямой потребности МИ для формирования нервной трубки баланс инозитола в организме матери играет не последнюю роль в развитии ДНТ у матерей с ГСД и ожирением [91, 92]. Хотя еще не выявлен точный алгоритм возникновения ДНТ на фоне материнского диабета и ожирения, вполне вероятно, он связан с нарушением метаболизма глюкозы. Поэтому гиперинсулинемия рассматривается в качестве предполагаемого фактора риска возникновения ДНТ плода у матерей с ожирением и диабетом [93]. Кроме того, ДНТ в значительной степени связан с избыточным потреблением сахара матерями, даже если они не страдают диабетом, а также с признаками метаболического синдрома [94–96]. У эмбрионов грызунов, подвергшихся индуцированному диабету, наблюдались дефицит инозитола в тканях и повышенная концентрация глюкозы [98, 99]. Добавление МИ в рацион таких животных восстанавливало содержание МИ в тканях и снижало частоту возникновения ДНТ, что подтверждает гипотезу о роли дефицита МИ в механизме развития диабетической эмбриопатии [100, 101]. Предполагается, что основными факторами риска возникновения ДНТ являются генетическая предрасположенность и условия окружающей среды, в том числе питание матери [102].
Многочисленные исследования доказывают, что снижение концентрации фолиевой кислоты в крови матери может предрасполагать к возникновению ДНТ у плода. При этом периконцепционная профилактика фолиевой кислотой посредством биологических добавок или обогащения пищи значительно снижает этот риск [103–105]. Тем не менее фолиевая кислота не обеспечивает полной профилактики рецидивов или возникновения ДНТ. Такие случаи описывают как «фолат-резистентные ДНТ» [106].
После удачной профилактики ДНТ на модели мышей с курчавым хвостом, резистентных к фолиевой кислоте, 12 фолат-резистентным пациенткам с ДНТ плода в анамнезе были назначены добавки МИ в качестве возможного средства профилактики рецидива ДНТ при последующей беременности [107, 108]. Все дети родились без ДНТ, что лишь укрепило уверенность в необходимости проведения более крупных рандомизированных исследований.
В двойное слепое клиническое исследование I/II фазы «случай – контроль» (PONTI) были включены женщины с одной или несколькими предыдущими беременностями с ДНТ, которые планировали новую беременность [109]. Было рандомизировано 47 участников, которым до зачатия ежедневно назначали 1 г МИ + 5 мг фолиевой кислоты или плацебо + фолиевую кислоту. В исследовании участвовали и другие нерандомизированные женщины. Среди 35 беременных, получавших МИ, не наблюдалось ни одного рецидива ДНТ, в то время как среди 22 беременных, принимавших только фолиевую кислоту, зарегистрировано три случая ДНТ. Данные исследования убедительно свидетельствуют о потенциальной пользе комплексной добавки МИ и фолиевой кислоты в период планирования беременности, особенно для фолат-резистентных пациенток с ДНТ плода в анамнезе.
С учетом безопасности и хорошей переносимости МИ назначение комбинации «мио-инозитол + фолиевая кислота» представляется целесообразным для любой женщины с высоким риском ДНТ. Более того, данные, полученные в клинических исследованиях, диктуют необходимость дальнейшего полномасштабного клинического исследования для окончательного подтверждения преимуществ комбинации «МИ + фолиевая кислота» в профилактике ДНТ перед монодобавкой фолиевой кислоты.
Инозитол и мужская репродукция (влияние на параметры спермы)
Аналогично полученным данным у женщин для мужчин также характерно высокое содержание МИ в органах половой системы, что указывает на важную роль МИ и в мужской репродукции. Действительно, снижение концентрации МИ в придатках яичка коррелирует со снижением фертильности у трансгенных мышей [110]. МИ выступает также в роли вторичного мессенджера, моделирующего внутриклеточные уровни Ca2+ в сперматозоидах и, таким образом, ответствен за окислительный метаболизм митохондрии и синтез АТФ [111].
Митохондрии служат источником энергии, а следовательно, отвечают за подвижность сперматозоидов, экзоцитоз и оплодотворение [111]. Таким образом, здоровое состояние митохондрий и высокий мембранный потенциал митохондрий (ММП) являются одними из условий получения спермы хорошего качества.
Поскольку МИ принимает участие в регуляции подвижности сперматозоидов, акросомной реакции и оплодотворении [112], он успешно применяется для лечения мужчин с бесплодием, особенно с олигоастенотератозооспермией (ОАТ) – патологией, связанной с уменьшением количества сперматозоидов (олигозооспермия), снижением подвижности сперматозоидов (астенозооспермия) и нарушением морфологии (тератозооспермия).
Исследования сперматозоидов пациентов с ОАТ выявили сверхэкспрессию фермента инозитолмонофосфатазы-1 (ИМПА-1), что в свою очередь нарушало регуляцию фосфатидилинозитолового сигнального каскада. Снижение подвижности сперматозоидов при этом [113] доказывает ключевую роль инозитола в регуляции мобильности сперматозоидов.
Эксперименты in vitro показали, что низкая подвижность сперматозоидов у пациентов с ОАТ сочетается с наличием аморфного волокнистого материала, покрывающего сперматозоиды, и снижением вязкости семенной жидкости. Помимо этого наблюдалось повреждение митохондриальных крист в промежуточном тракте сперматозоидов. Инкубация сперматозоидов от пациентов с ОАТ в среде с МИ восстанавливает структуру митохондрий и разрушает аморфный волокнистый материал. Таким образом, МИ благотворно влияет на морфологию, моторику сперматозоидов и их способность к оплодотворению [112, 114].
Тем не менее назначение МИ в ряде случаев не оказывало благотворного влияния на подвижность сперматозоидов. В связи с этим R.A. Condorelli и соавт. [115] провели эксперименты in vitro, которые продемонстрировали благотворное влияние ДХИ на митохондриальный потенциал. Было доказано, что как в случае нормозооспермии, так и в случае астенозооспермии ДХИ дозозависимо снижает процент сперматозоидов с низким уровнем ММП и, напротив, повышает количество сперматозоидов с высоким митохондриальным потенциалом. Данное пилотное исследование, хотя и показывает лучшее качество сперматозоидов при назначении ДХИ, имеет некоторые ограничения. Как отмечают сами авторы, MMП является прогностическим параметром моторики сперматозоидов и не может быть репрезентативным для общей митохондриальной функции. Более того, чрезмерно высокое значение ММП может ухудшить подвижность и качество сперматозоидов, что приведет к высвобождению активных форм кислорода [115].
В нескольких исследованиях с участием пациентов, перенесших процедуры экстракорпорального оплодотворения (ЭКО), сообщалось, что после инкубации с МИ количество и подвижность сперматозоидов улучшились, а также увеличился процент оплодотворения как у фертильных мужчин, так и у пациентов с ОАТ [116–119]. Помимо улучшения характеристик спермы МИ восстанавливал баланс основных репродуктивных гормонов, таких как лютеинизирующий гормон (ЛГ), ФСГ и ингибин-В [120].
Интересные результаты были получены в исследованиях O.M. Montanino и соавт. В первом исследовании [121] авторы назначали комбинацию МИ, L-карнитина, L-аргинина, витамина Е, селена и фолиевой кислоты два раза в день мужчинам с метаболическим синдромом и низкой подвижностью сперматозоидов. После трехмесячной терапии отмечался положительный результат в отношении чувствительности к инсулину и параметров спермы. Было показано положительное влияние на свойства эякулята (концентрация сперматозоидов, морфология и подвижность).
Во втором исследовании [122] изучали влияние МИ на подвижность сперматозоидов в женских половых путях. В эксперименте участвовали 86 пар. 43 пары получали вагинальные суппозитории, содержащие МИ, а остальные 43 – суппозитории и плацебо. Авторы пришли к выводу, что лечение МИ улучшило общую подвижность сперматозоидов (54,42%, 8,72) по сравнению с исходным значением (46,48%, 4,05) и группой плацебо (46,21%, 5,33). Кроме того, терапия МИ увеличила количество прогрессивно-подвижных сперматозоидов, что является лучшим критерием качественной спермы, в частности во время планирования беременности. Назначение МИ благотворно влияло не только на параметры спермы, но и на качество цервикальной слизи, снижая ее вязкость. В результате 18,60% пар, проходивших лечение МИ, получили желаемую беременность, при этом количество беременностей в контрольной группе составило 6,97%.
Эффективность назначения МИ мужчинам с ОАТ подтверждена в недавнем исследовании M. Santoro и соавт. [123]. Они проводили исследование in vitro и in vivo некоторых параметров эякулята: подвижности, выживаемости и капацитации, а также метаболизма глюкозы и липидов. Ученые пришли к выводу, что помимо повышения подвижности и улучшения выживаемости сперматозоидов МИ благотворно влияет на метаболизм глюкозы и липидов, улучшая производительность сперматозоидов.
Наконец, следует упомянуть, что МИ может защищать сперму бесплодных мужчин, подвергающихся вспомогательным репродуктивным технологиям (ВРТ), от изменений, происходящих во время процедуры криоконсервации [124, 125]. Так, прием добавок МИ может значительно повысить уровень криовыживаемости в образцах с аномальными характеристиками спермы до замораживания. С учетом суммарных результатов всех исследований, можно говорить о благотворном влиянии инозитола в аспекте преодоления бесплодия.
Новые сферы применения инозитола
Важность соотношения МИ/ДХИ в стероидогенезе
В ходе исследований установлено, что помимо функции вторичных мессенджеров в передаче сигналов инсулина инозитол способен действовать как эндокринный модулятор, влияя на стероидогенез. В 1998 г. J.E. Nestler впервые обнаружил, что ДХИ повышает уровень тестостерона в тека-клетках яичников у женщин с СПКЯ, хотя механизм возникновения данного эффекта оставался все еще не известным [28]. Недавно проведенные эксперименты показали, что ДХИ дозозависимо уменьшает экспрессию гена ароматазы, участвующей в стероидогенезе в клетках гранулезы яичников женщин, а также снижает экспрессию генов расщепления боковой цепи цитохрома Р450 [32]. На основании этого можно сделать вывод, что ДХИ модулирует уровни эстрогенов, не блокируя их биосинтез.
Хотя некоторые эффекты МИ остаются неисследованными, мы предполагаем, что этот стереоизомер может действовать на активность ароматазы в обратном порядке. Подтверждением данной гипотезы является тот факт, что МИ выступает в качестве вторичного мессенджера ФСГ, который напрямую стимулирует ароматазу, индуцируя конвертацию андрогенов в эстрогены и созревание фолликулов [126]. Уменьшение уровня ФСГ и последующее снижение уровня ароматазы, синтезируемой клетками гранулезы, являются отличительной характеристикой СПКЯ [127]. Таким образом, если ДХИ ингибирует ароматазу, то МИ, вероятно, усиливает синтез ароматазы в клетках гранулезы [128, 129]. МИ также может модулировать стероидогенез в яичниках путем перестройки белков цитоскелета [130].
Таким образом, увеличение соотношения МИ/ДХИ будет повышать активность ароматазы в гранулезе, способствуя биосинтезу эстрогенов, в то время как снижение соотношения МИ/ДХИ будет способствовать выработке андрогенов в тека-клетках [131].
Важный момент: в нормальных гомеостатических условиях соотношение концентраций МИ/ДХИ в фолликулярной жидкости варьируется от 70:1 до 100:1, в то время как у больных СПКЯ это соотношение характеризуется специфическим истощением МИ и перегрузкой ДХИ [21, 40]. Повышенная концентрация ДХИ способствует синтезу андрогенов, а выраженный дефицит МИ вызывает снижение ФСГ-сигнализации в клетках гранулезы яичников, ухудшая энергетический потенциал ооцитов [30].
A. Bevilacqua и соавт. провели первое экспериментальное исследование на мышах по влиянию соотношения МИ/ДХИ на физиологическое состояние яичников [46]. В эксперименте авторы исследовали добавки с различными соотношениями МИ/ДХИ (а именно 5:1; 20:1; 40:1 и 80:1) на предмет их способности возвращать фенотип СПКЯ в норму. При этом наиболее эффективными результатами в эксперименте на мышах характеризовалось соотношение 40:1. Лечение мышей МИ/ДХИ в молярном соотношении 40:1 привело к быстрому и почти полному исчезновению гистологических признаков и клинических симптомов СПКЯ. Напротив, другие коэффициенты МИ/ДХИ были менее эффективными, а высокое содержание ДХИ даже имело негативные последствия.
Полученные данные полностью подтвердились в клиническом исследовании M. Nordio и соавт. [44]. В исследовании 56 пациенток с СПКЯ получали различные соотношения МИ/ДХИ (0:1; 1:3,5; 2,5:1; 5:1; 20:1; 40:1 и 80:1) с целью восстановления овуляторной функции (по анализу прогестерона) и улучшения нарушенных метаболических параметров, таких как ФСГ, ЛГ, ГСПГ, эстрадиол, свободный тестостерон, индекс ИР и базальный и постпрандиальный уровень инсулина. Авторы отметили, что комбинация 40:1 наиболее эффективно способствовала улучшению параметров, за ней следовали соотношения 20:1 и 80:1. При использовании других соотношений значимых результатов не зафиксировано. Но, несмотря на многообещающие результаты, очевидна необходимость проведения дальнейших более масштабных исследований для изучения молекулярных аспектов активности инозитола в яичниках и других положительных эффектов оптимальной комбинации МИ/ДХИ, в частности обширного когортного анализа пациенток с различными фенотипами СПКЯ.
Применение МИ в программах ВРТ
В 1992 г. T.T. Chiu и соавт. впервые продемонстрировали положительную роль МИ в циклах ЭКО [132]. Было обнаружено высокое содержание МИ (за день до инъекции ХГЧ) в сыворотке крови пациенток, у которых наступила беременность в протоколе ЭКО. Это указывало на возможную роль МИ как в наступлении беременности, так и в поддержании нормального развития эмбриона.
Десять лет спустя та же группа ученых обнаружила корреляцию между концентрацией МИ в фолликулярной жидкости и качеством ооцитов [133]. Было отмечено, что фолликулы с более высоким уровнем МИ содержат ооциты лучшего качества, что указывало на потенциальную перспективу использования МИ в качестве маркера качества ооцитов. Тем не менее данные результаты противоречили существовавшей гипотезе J.E. Nestler о том, что ключевым фактором в патогенезе СПКЯ служит снижение конвертации МИ в ДХИ вследствие низкой активности эпимеразы, в силу чего применение МИ неэффективно у пациенток с СПКЯ.
В опубликованном недавно исследовании K. Ravanos и соавт. были приведены убедительные доказательства корреляции между соотношением МИ/ДХИ в фолликулярной жидкости и качеством бластоцист [30]. Показано, что у бластоцист хорошего качества соотношение МИ/ДХИ значительно выше, чем у бластоцист низкого качества, у которых в фолликулярной жидкости значительно преобладает количество ДХИ. Таким образом, доказано, что соотношение концентрации МИ/ДХИ может являться ценным биомаркером качества бластоцисты, в том числе при прогнозировании наступления беременности.
Исходя из полученных данных, в большинстве исследований, посвященных использованию инозитола в циклах ВРТ у женщин с СПКЯ, был представлен именно МИ. Так, в ретроспективном исследовании A. Wdowiak и соавт. изучали эффективность добавок МИ у женщин с СПКЯ, перенесших внутриплазматическую инъекцию сперматозоидов (ИКСИ). Ученые пришли к заключению, что комбинация 2 г МИ + 200 мкг фолиевой кислоты два раза в день увеличивает динамику развития эмбриона и ускоряет время достижения стадии бластоцисты [134].
Два других исследования также подтвердили эффективность МИ в циклах ЭКО. В первом из них [135] авторы продемонстрировали, что назначение 1 г МИ + 400 мкг фолиевой кислоты женщинам с СПКЯ значительно увеличивает количество зрелых ооцитов по сравнению с женщинами контрольной группы, получавшими только фолиевую кислоту. Во втором проспективном контролируемом рандомизированном исследовании назначали 4 г МИ и 400 мкг фолиевой кислоты 98 бесплодным пациенткам с СПКЯ, подвергавшимся контролируемой овариальной гиперстимуляции р-ФГС и внутриматочной инсеминации [136]. Авторы отметили, что в группе, получавшей МИ, наблюдалось значительное снижение суммарной дозы р-ФСГ и продолжительности цикла стимуляции, а также более высокая частота наступления беременности по сравнению с контрольной группой.
Систематический обзор A.S. Laganà и соавт., включающий восемь РКИ с участием 812 пациенток, показал, что прием МИ позволяет снизить суммарную дозу ФСГ как у женщин с СПКЯ, так и у женщин без СПКЯ в циклах ЭКО. При этом продолжительность контролируемой овариальной гиперстимуляции уменьшилась только у пациенток с СПКЯ [137].
Другой систематический обзор также подтвердил эффективность назначения МИ в увеличении частоты наступления беременности и снижении суммарной дозы р-ФСГ у бесплодных пациенток без СПКЯ, проходивших индукцию овуляции и перенос эмбрионов в протоколах ИКСИ или ЭКО [138].
Наконец, недавнее двойное слепое рандомизированное контролируемое исследование, проведенное S. Mohammadi и соавт., подтвердило эффективность МИ у пациенток с «бедным» овариальным ответом [139]. Действительно, пероральный прием МИ данной целевой группой пациенток значительно улучшил результаты ВРТ, такие как частота наступления клинической беременности, улучшение показателей индекса чувствительности яичников к гонадотропной стимуляции. При этом суммарная доза гонадотропинов существенно снизилась.
Представленные исследования позволяют сделать некоторые выводы в области фармацевтической экономики о возможном снижении затрат, связанных с методами ВРТ, при включении добавок МИ, позволяющих сократить суммарную дозу назначаемого р-ФСГ во время проведения процедур.
Противоположные эффекты ДХИ (подавление синтеза эстрогенов при эстроген-зависимых заболеваниях у женщин, стимуляция синтеза андрогенов при мужском гипогонадизме)
Открытие способности ДХИ модулировать экспрессию фермента ароматазы, тем самым влияя на стероидогенез и, следовательно, на баланс андрогенов/эстрогенов [32], привело к пониманию того, что прием ДХИ может быть эффективным средством лечения метаболических, гормональных и репродуктивных нарушений как у женщин, так и у мужчин, при которых необходимо увеличить количество андрогенов и/или снизить уровень эстрогенов [128, 140] (рис. 4).
Так, исследование G. Monastra и соавт. [141] показало, что на фоне применения ДХИ (1 г/день) в течение месяца мужчинами с измененным гликемическим и/или гормональным статусом, пожелавшими добровольно принять участие в эксперименте, помимо нормализации уровня инсулина и индекса HOMА в крови также снижались сывороточные уровни эстрона и эстрадиола (85,0 и 14,4% соответственно) и повышался уровень тестостерона и дегидроэпиандростерона (+23,4 и +13,8% соответственно). Таким образом, было получено подтверждение важной роли ДХИ в регуляции ароматазы и соотношения половых стероидов, что открывает новые перспективы для исследований и терапевтического применения этого стереоизомера инозитола.
Потенциальной целевой группой для дотации ДХИ среди мужчин могут быть пожилые пациенты с поздним гипогонадизмом, у которых нарушенная функция выработки адекватных уровней тестостерона привела к дефициту андрогенов [142, 143]. К характерным симптомам позднего гипогонадизма относятся снижение сексуальной активности, алопеция, бесплодие и эректильная дисфункция, что неуклонно сопряжено со снижением общего качества жизни.
Заместительная терапия тестостероном (ЗТТ) широко используется для лечения возрастного гипогонадизма, хотя целесообразность данного лечения до сих пор вызывает дискуссии [142].
Следует отметить, что в 2015 г. FDA (Food and Drug Administration, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) выпустило предупреждение о потенциальных сердечно-сосудистых рисках, связанных с ЗТТ. Не исключен также риск угнетения гипоталамо-гипофизарно-гонадной оси экзогенным тестостероном посредством отрицательной обратной связи, что может привести к вторичной недостаточности сперматогенеза и последующему бесплодию [144].
Ввиду того что ДХИ нормализует соотношение тестостерона и эстрадиола и улучшает концентрацию, моторику и морфологию сперматозоидов, а также выступает в роли ингибитора ароматазы и селективного модулятора рецепторов эстрогена (СМЭР), его дотация может служить альтернативой ЗТТ, особенно для лиц с ожирением или высоким сердечно-сосудистым риском [145]. Однако эти препараты еще не вошли в обычную клиническую практику. Но с учетом безопасности и хорошей переносимости [146] можно утверждать о терапевтическом потенциале ДХИ в альтернативном подходе к лечению мужского возрастного гипогонадизма.
В частности, обнадеживающие результаты получены в недавнем пилотном исследовании M.K.P. Nordio и соавт., в котором у десяти пациентов после месяца ежедневного приема 1800 мг ДХИ наблюдалось значительное повышение уровней тестостерона и андростендиона в крови на фоне снижения содержания эстрадиола и эстрона, что расценивалось как свидетельство влияния ДХИ на активность ароматазы. Прием ДХИ также положительно повлиял на показатель ИР, окружность талии, сексуальную активность и физическую силу пациентов [147].
Безусловно, с учетом таких многообещающих данных есть необходимость в проведении более масштабных когортных исследований.
Примечательно, что дефицит эстрогена предрасполагает мужчин к увеличению ожирения и метаболической дисфункции. Но парадокс заключается в том, что ожирение у мужчин, наоборот, связано с гиперэстрогенией. При этом чрезмерная стимуляция эстрадиолом может провоцировать прогрессирование ожирения и метаболические расстройства [148].
В нескольких исследованиях показано, что у мужчин с ожирением низкий уровень циркулирующих андрогенов при повышенной концентрации эстрона и 17-бета-эстрадиола [149, 150]. Причины корреляции ожирения с гиперэстрогенемией у мужчин точно не выявлены, но существует гипотеза о связи с полиморфизмом гена ароматазы CYP19A [151]. Предполагается, что повышенная периферическая ароматизация тестостерона у мужчин с ожирением может усиливать центральную передачу сигналов эстрадиола, подавляя выработку гонадотропина и способствуя устойчивому состоянию гипогонадотропного гипогонадизма [152].
Таким образом, проведенные исследования подтверждают очевидную пользу ДХИ для мужчин с ожирением, поскольку этот стереоизомер инозитола оптимизирует метаболизм глюкозы, снижает уровень инсулина в плазме, модулирует активность ароматазы и способствует выработке андрогенов.
В то же время у женщин терапевтическую значимость может иметь снижение уровня эстрогена при назначении ДХИ, например при лечении миомы матки. Миома матки – самая распространенная доброкачественная опухоль женской половой сферы. Ключевую роль в пролиферации клеток и опухолевом росте играют эстрогены и прогестерон [153]. Лейомиомы в основном протекают бессимптомно и, как правило, имеют тенденцию к регрессу после менопаузы [154]. Тем не менее у ряда пациенток отмечаются тяжелые симптомы, такие как тазовая боль, дисменорея и кровотечение.
К сожалению, на сегодняшний день не существует современных безопасных консервативных методов лечения миомы матки, особенно после того, как улипристала ацетат был удален с рынка в сентябре 2020 г. из-за редких, но серьезных гепатотоксических эффектов [155].
В то же время фармакологическое лечение off-label, включающее прогестагены, андрогены, антагонисты рецепторов эстрогена, селективные модуляторы рецепторов прогестерона (СМПР) и агонисты гонадотропин-рилизинг-гормона (ГнРГ), доказало свою эффективность в уменьшении размера опухоли и клинических симптомов, а в некоторых случаях позволило избежать хирургического вмешательства.
Как известно, экспрессия ароматазы в опухолевой ткани значительно выше таковой в неопухолевых (здоровых) тканях [156]. Сразу несколько исследовательских групп отметили избыточную экспрессию ароматазы в клетках миомы по сравнению с прилегающим к ней здоровым миометрием [157, 158]. Как следствие – высокий уровень эстрогенов in situ, способствующих росту миомы через интракринный/аутокринный механизм [159]. Перспективным подходом к лечению миомы считается снижение уровня эстрогена [160]. Ингибиторы ароматазы, такие как летрозол, демонстрируют эффективность в уменьшении размера и объема миомы, а следовательно, улучшают качество жизни пациенток [161].
Поскольку ДХИ влияет на экспрессию ароматазы, неоспорим его терапевтический потенциал в качестве альтернативного варианта лечения миомы матки. O.M. Montanino описал случай двух пациенток с лейомиомой и обильными менструальными кровотечениями, которые пытались забеременеть с помощью ВРТ [162]. Женщины ежедневно принимали комбинацию галата эпигаллокатехина (EGCG), витамина D и низких доз ДХИ в течение трех месяцев. Ранее в ряде исследований [163–165] продемонстрировано, что природные соединения, такие как EGCG и витамин D, эффективны в уменьшении размера миомы, поэтому в данном контексте действие ДХИ мог бы усилить эффект от вышеописанной комбинации, что и наблюдал O.M. Montanino. Объем миомы сократился на 73,8 и 68,4%, а менструальной кровопотери – на 42,1 и 48,7%. Кроме того, спустя три месяца после окончания лечения обеим пациенткам провели процедуру ВРТ без предварительного оперативного вмешательства.
Полученные результаты свидетельствуют о потенциально высокой эффективности такой комбинации в уменьшении размеров миомы и менструального кровотечения. Кроме того, применение комбинации позволяет избежать хирургического вмешательства. Действие ДХИ как модулятора ароматазы не только объясняет значительное уменьшение размера миоматозных узлов в обоих описанных случаях, но и открывает новые перспективы для терапевтического использования ДХИ в качестве катализатора антипролиферативных и проапоптотических эффектов комбинации витамина D и EGCG. Достигнутые результаты требуют подтверждения в дальнейших масштабных исследованиях.
И наконец, дотация ДХИ может успешно использоваться у ановуляторных женщин для снижения синтеза эстрогена и индукции овуляции [140]. Основным методом индукции овуляции у таких пациенток являются СМЭР кломифена цитрат и ингибиторы ароматазы – летрозол или анастрозол. Эти препараты подавляют биосинтез эстрогенов, тем самым снижая отрицательную обратную связь с гипоталамусом и выброс ГнРГ и ФСГ [166]. При этом они имеют ряд побочных эффектов, особенно связанных с применением летрозола, повышающего риск пороков развития сердца и скелета плода, что может стать противопоказанием к использованию у женщин репродуктивного возраста [167].
Действие ДХИ по снижению экспрессии фермента ароматазы аналогично летрозолу, поэтому он может стать эффективной альтернативой в циклах индукции овуляции. Но, учитывая последующее повышение уровня андрогенов, ассоциированное с влиянием ДХИ на экспрессию ароматазы, перед началом терапии необходимо тщательно изучить анамнез пациентки и оценить длительность приема во избежание негативного воздействия на яичники.
Способность ДХИ восстанавливать овуляцию у женщин с гиперинсулинемией хорошо изучена и обусловлена в основном инсулинсенсибилизирующим действием ДХИ, в результате которого улучшается передача сигналов инсулина и соответственно уменьшается системная гиперинсулинемия. К сожалению, пока подобные исследования у пациенток с ановуляцией, но без гиперинсулинемии отсутствуют.
Только в одном клиническом испытании оценивали эффект ДХИ в отношении восстановления овуляции у женщин без СПКЯ и лишнего веса [168]. У двух молодых пациенток после шести недель приема ДХИ 1200 мг/день наблюдались повышение уровня прогестерона с 0,5 до 12 нг/мл и утолщение эндометрия, что сопровождалось возобновлением менструального цикла и наступлением овуляции. Исходя из полученных результатов и нормального уровня инсулина у обеих женщин, маловероятно, что регуляция инсулина сыграла ключевую роль в восстановлении овуляторной функции. Авторы предположили, что ДХИ главным образом действовал на экспрессию ароматазы, подавляя биосинтез эстрогенов и способствуя высвобождению ФСГ.
Для подтверждения указанных свойств ДХИ в предварительном наблюдении необходимы дальнейшие контролируемые исследования с соответствующей выборкой пациентов.
Доза и длительность приема ДХИ у женщин с СПКЯ
Несмотря на то что оба стереоизомера инозитола показали терапевтическую эффективность у женщин с СПКЯ и могут представлять возможную альтернативу традиционным методам лечения, выявленные свойства ДХИ в качестве модулятора ароматазы и молекулы, повышающей уровень андрогенов, безусловно, требуют дальнейшего изучения его клинического применения. В частности, при назначении ДХИ в качестве монодобавки рекомендуемые дозы и сроки лечения должны быть тщательно оценены и адаптированы к различным клиническим ситуациям. Как уже отмечалось, прием высоких доз ДХИ в течение длительного периода времени может существенно влиять на стероидогенез, повышая уровень андрогенов и ухудшая клиническую картину больных, особенно пациенток с СПКЯ, уже характеризующихся гиперандрогенией.
Так, A. Bevilacqua и соавт. предположили, что аналогично ингибитору ароматазы летрозолу высокие дозы ДХИ, вводимые здоровым самкам мышей, индуцируют андрогенную модель, подобную СПКЯ, или вызывают другие образования яичников [56]. Для подтверждения своей теории авторы вводили самкам мышей дикого типа 250, 500 и 1000 мг/кг/день ДХИ в течение трех недель. Такая доза обеспечивала поступление ДХИ в количестве 5, 10 или 20 мг/сут на мышь, что в пересчете на человека соответствовало 1200, 2400 или 4800 мг ДХИ в день [169].
Все применяемые дозы ДХИ вызывали гистологические изменения яичников по типу СПКЯ у человека и были аналогичны изменениям, наблюдаемым у мышей, получавших летрозол в качестве положительного контроля. Кроме того, матки у мышей, получавших ДХИ, макроскопически напоминали матки ановуляторных животных, а уровни тестостерона увеличивались в несколько раз по сравнению с уровнями у мышей отрицательного контроля. Зарегистрированное снижение экспрессии ароматазы в яичниках также стало первым свидетельством специфической регуляции ароматазы, опосредованной ДХИ в системе in vivo, и подтвердило более ранние экспериментальные наблюдения S. Sacchi за культивируемыми клетками гранулезы человека [32].
В исследовании также отмечалось, что назначение мышам 500 и 1000 мг/кг ДХИ в день вызывало нарушение гистологической структуры яичников и выраженное снижение сывороточного уровня тестостерона, не влияя при этом на содержание ароматазы в яичниках как в отрицательном, так и в положительном контроле. Авторы предположили, что лечение ДХИ могло блокировать нормальные гормональные взаимодействия в яичниках путем ингибирования экспрессии/активности цитохрома P450scc, который катализирует первую стадию стероидогенного каскада. В целом полученные результаты должны мотивировать исследователей на определение оптимальной терапевтической дозы ДХИ, учитывая его двойное действие, а также принимая в расчет исходные метаболические и гормональные параметры пациентов.
Таким образом, становится очевидно, что ДХИ, улучшая одни клинические параметры, может негативно влиять на другие. Поэтому необходимо рассчитывать суточные дозы и длительность приема ДХИ с учетом особенностей заболевания [128]. Конечно, все эти наблюдения и гипотезы нуждаются в подтверждении в рандомизированных плацебоконтролируемых двойных слепых исследованиях с большой выборкой пациентов.
Повышение системной абсорбции инозитола (доза и время приема, фармацевтические подходы)
Фармакокинетические исследования показали, что для улучшения кишечной абсорбции МИ следует принимать два раза в день, вне приема пищи и в разовой дозе 2 г [170]. Однако от 25 до 75% пациенток продемонстрировали отсутствие эффекта от терапии МИ [171] и были обозначены нами как «инозитол-резистентные». Причины явления резистентности к инозитолу до конца не понятны. Так, в исследовании S. Gerli и соавт. в ответ на прием МИ у пациенток значительно снизился уровень тестостерона, как общего, так и свободного, и увеличился уровень ГСПГ [172]. Вместе с тем в исследовании Z. Kamenov и соавт. многие пациентки оказались резистентными к терапии, причем большинство из них страдали ожирением [173]. Исходя из этого, можно предположить, что ожирение, ИР, а также гиперандрогения, дисбиоз и различная биодоступность соединений могут нарушать системную абсорбцию МИ и представлять собой потенциальные факторы риска резистентности к терапии инозитолом. В связи с этим улучшение пероральной абсорбции МИ представляет одну из важных задач клинической практики.
Для улучшения кишечной абсорбции многих препаратов часто используется фармацевтический метод инкапсулирования действующего вещества в мягкие гелевые капсулы [174–177].
Основываясь на этих данных, производители начали выпускать МИ в форме мягких гелевых капсул, что значительно улучшило его абсорбцию в желудочно-кишечном тракте и позволило достичь такого же уровня инозитола в крови при снижении на треть принимаемой дозы инозитола по сравнению с порошковой формой препарата [170].
Недавно была изучена эффективность введения комбинации МИ и α-LA, хорошо известного нутриента, обеспечивающего транспорт ионов металлов и витаминов [178, 179]. Фармакокинетическое исследование G. Monastra и соавт. с участием 18 здоровых добровольцев [180] показало, что комбинация МИ и α-LA гарантирует большую биодоступность МИ по сравнению с приемом одного МИ, поскольку концентрация МИ в плазме крови значительно выше при комбинированном приеме.
Следующее исследование O.M. Montanino, опубликованное в 2018 г., подтвердило клиническую эффективность комбинированного лечения. На начальном этапе 37 пациенткам назначали МИ, после чего у 23 из них (62%) наступила овуляция. У 14 (38%) выявлена резистентность к терапии, что показало отсутствие подъема уровня МИ в плазме крови. Когда инозитол-резистентным пациенткам было предложено комбинированное лечение МИ + α-LA, сывороточный уровень МИ значительно возрос, улучшились липидный и гормональный профили, у 86% женщин наступила овуляция [181]. В том же году был выяснен механизм, лежащий в основе этого эффекта. G. Monastra и соавт. обнаружили, что в присутствии α-LA МИ увеличивал свое прохождение через монослой клеток Caco-2, используемых в качестве стандартной модели кишечного эпителия in vitro [182]. В присутствии α-LA происходило временное открытие плотного соединения между клетками, что содействовало пассивному транспорту МИ (рис. 7). Подобный эффект наблюдался и в случае комбинации α-LA с ДХИ [183].
Несколько лет спустя, стремясь расширить и дополнительно изучить результаты, полученные O.M. Montanino [181], M.I. Hernandez и соавт. [184] провели многоцентровое клиническое исследование эффективности комбинации МИ + α-LA у женщин с СПКЯ в Мексике и Италии. После трехмесячной терапии у всех пациенток уровень прогестерона значительно увеличился, а уровни ИМТ, глюкозы, инсулина, ФСГ снизились, улучшился показатель ЛГ, хотя и не во всех случаях значительно. В течение последующего шестимесячного наблюдения данные показатели оставались стабильными.
В целом полученные результаты указывают на то, что плохая кишечная абсорбция МИ может служить ограничивающим фактором для успешного лечения СПКЯ, но при этом существуют эффективные способы решения данной проблемы.
Последствия дефицита инозитола, связанного с фармакологическим лечением, мальабсорбцией или конкуренцией с пищевой глюкозой
Необходимо учитывать, что прием высокой дозы ДХИ или других сахароподобных молекул в комбинации с МИ может негативно влиять на его биодоступность в организме. Действительно, как показали S. Garzon и соавт., принимаемые совместно с МИ сорбитол, ДХИ и мальтодекстрин значительно снижают его абсорбцию и концентрацию в плазме крови по сравнению с приемом одного МИ [7]. Этот эффект авторы объяснили конкуренцией между молекулами при их взаимодействии с кишечными транспортерами, в основном с SMIT2. Транспортер SMIT2 проявляет сходное сродство к обоим стереоизомерам инозитола, о чем свидетельствуют значения Km: 120–150 мкМ для МИ и 110–130 мкМ для ДХИ. Однако в физиологических условиях концентрация ДХИ в сыворотке крови менее 100 нМ, и поэтому маловероятно, что он может влиять на абсорбцию МИ, концентрация которого в сыворотке крови обычно значительно выше (от 26,8 до 43,0 мкМ) [185, 186]. Сказанное относится и к комбинации МИ/ДХИ в соотношении 40:1, соответствующем нормальному соотношению в сыворотке крови.
Напротив, при потреблении ДХИ в высоких дозах (1 г и более) может возникнуть сильная конкуренция с МИ за транспортер SMIT2, что снизит кишечную абсорбцию МИ и, следовательно, патологически изменит соотношение МИ/ДХИ в плазме крови.
Кроме этого, не стоит недооценивать значение в метаболизме инозитола некоторых фармакологических препаратов, таких как вальпроат натрия, относящийся к антиэпилептическим средствам, и препараты лития, применяемые при биполярном расстройстве. Механизм действия названных препаратов основан на «гипотезе истощения инозитола» [187], согласно которой литий действует в качестве ингибитора монофосфатазы и инозитолполифосфатазы, ключевых ферментов синтеза инозитола, а вальпроат натрия ингибирует миоинозитолфосфатсинтазу.
Безусловно, терапевтический эффект этих препаратов весьма значим, поскольку они контролируют судороги и расстройства настроения. Но их длительное применение вызывает серьезные побочные эффекты, главным образом связанные с истощением инозитола в периферических тканях. Наиболее часто у пациентов развивается гипотиреоз, увеличивается масса тела, развиваются гиперинсулинемия, дислипидемия, кожные заболевания, нарушается функция почек [188–190]. У большинства женщин, принимающих антиэпилептические препараты, развиваются симптомы СПКЯ [190–193], снижается уровень эстрадиола и прогестерона, повышается уровень тестостерона, что приводит к гипогонадизму, аменорее или олигоменорее, сексуальной дисфункции и бесплодию [194].
Хотя данные нарушения проходят сразу после отмены препарата или разрешаются спонтанно спустя несколько недель после прекращения терапии, они, безусловно, ухудшают качество жизни больных и снижают их приверженность проводимому лечению.
Для купирования развившихся симптомов СПКЯ можно рекомендовать прием МИ, доказавшего свою безопасность и эффективность в улучшении гормонального профиля, лечении симптомов гиперандрогении, нормализации менструального цикла, улучшении качества ооцитов и психологического статуса [54, 195]. Комбинация МИ с селеном способна восстанавливать функцию щитовидной железы у пациентов с субклиническим гипотиреозом или аутоиммунным тиреоидитом [196]. Таким образом, добавление МИ способно предупреждать развитие побочных реакций при лечении пациентов с биполярными расстройствами и эпилепсией.
Безусловно, доза МИ должна быть тщательно подобрана, чтобы не препятствовать основному фармакологическому терапевтическому эффекту препаратов. В ряде исследований сообщалось, что доза МИ 3–6 г/день эффективно купирует возможные побочные эффекты, но при этом не преодолевает гематоэнцефалический барьер и поэтому не препятствует фармакологическому действию лечебных препаратов на центральную нервную систему [197, 198]. С учетом того что МИ может конвертироваться в ДХИ, необходимо понимать, что медикаментозное истощение МИ влияет и на содержание ДХИ в организме и комбинированное введение МИ с ДХИ представляется терапевтически более эффективным, чем дотация одного МИ.
Даже при условии, что МИ естественным образом конвертируется в ДХИ, применение комбинации этих изомеров позволит восстановить истощение инозитола и его последствий более быстро и эффективно.
Возможное соотношение МИ/ДХИ в добавках может варьироваться от 10:1 до 100:1, но наиболее привлекательным представляется соотношение 80:1 в пользу МИ [190].
Обобщая изложенное, можно констатировать, что сопутствующая добавка инозитола пациентам, получающим терапию препаратами лития или антиэпилептическими средствами, позволит безопасно купировать возникающие побочные эффекты, что приведет к повышению приверженности пациентов лечению и улучшению качества их жизни.
Заключение
В настоящее время научный подход к применению инозитола претерпел настоящую эволюцию, что связано с обнаружением существенных функциональных различий у стереоизомеров инозитола, несмотря на схожесть химической структуры.
Последние 20 лет исследований убедительно показали, что правильное соотношение МИ/ДХИ определяет здоровое состояние органов и тканей, в то время как дисбаланс уровней инозитола или его истощение может быть причиной различных заболеваний. Следовательно, восстановление физиологического соотношения инозитола или строго контролируемое изменение этого соотношения могут быть двумя разумными подходами к достижению терапевтического эффекта.
Консолидированные результаты проведенных исследований представили убедительные доказательства терапевтической эффективности инозитола при лечении СПКЯ, восстановления как женской, так и мужской репродуктивной функции, а также добавок МИ в профилактике ГСД и ДНТ.
Наиболее благотворное влияние у женщин с СПКЯ отмечается на фоне применения комбинации МИ/ДХИ в соотношении 40:1. В то же время обоснованность ее назначения должна быть дополнительно подтверждена крупномасштабными клиническими испытаниями, а также фармакокинетическими исследованиями.
Недавно подтвержденная роль ДХИ в качестве модулятора ароматазы заставила по-новому взглянуть на его клиническое применение исходя из того, что ДХИ участвует в стероидогенезе и способен изменять соотношение «эстроген/андроген» в организме в пользу андрогена. Поэтому назначение ДХИ в клинической практике должно осуществляться с учетом индивидуальных особенностей пациента. Очевидно, что женщины с СПКЯ, уже имеющие гиперандрогению, не получат пользы от лечения одним только ДХИ, особенно при длительном приеме и в высоких дозах. И наоборот, ДХИ может быть полезен пациентам, которым необходимо повысить уровень андрогенов за счет эстрогенов.
Безусловно, еще многое предстоит понять и узнать в отношении инозитола. Тем не менее за годы исследований инозитол медленно, но неуклонно приближался к классическим фармакологическим методам лечения, доказав свою эффективность, безопасность и высокую комплаентность со стороны пациенток.
Все авторы прочитали и согласовали опубликованную версию рукописи.
Финансирование: исследование не получило внешнего финансирования.
Заявление институциональной комиссии по рассмотрению: не распространяется.
Заявление об информированном согласии: не распространяется.
Заявление о доступности данных: не распространяется.
Конфликт интересов: Simona Dinicola и Vittorio Unfer работают в Lo.Li. Pharma srl, Рим, Италия.
Myo-inositol (myo-Ins) and D-chiro-inositol (D-chiro-Ins) are natural compounds involved in many biological pathways. Since the discovery of their involvement in endocrine signal transduction, myo-Ins and D-chiro-Ins supplementation has contributed to clinical approaches in ameliorating many gynecological and endocrinological diseases. Currently both myo-Ins and D-chiro-Ins are well-tolerated, effective alternative candidates to the classical insulin sensitizers, and are useful treatments in preventing and treating metabolic and reproductive disorders such as polycystic ovary syndrome (PCOS), gestational diabetes mellitus (GDM), and male fertility disturbances, like sperm abnormalities. Moreover, besides metabolic activity, myo-Ins and D-chiro-Ins deeply influence steroidogenesis, regulating the pools of androgens and estrogens, likely in opposite ways. Given the complexity of inositol-related mechanisms of action, many of their beneficial effects are still under scrutiny. Therefore, continuing research aims to discover new emerging roles and mechanisms that can allow clinicians to tailor inositol therapy and to use it in other medical areas, hitherto unexplored. The present paper outlines the established evidence on inositols and updates on recent research, namely concerning D-chiro-Ins involvement into steroidogenesis. In particular, D-chiro-Ins mediates insulin-induced testosterone biosynthesis from ovarian thecal cells and directly affects synthesis of estrogens by modulating the expression of the aromatase enzyme. Ovaries, as well as other organs and tissues, are characterized by a specific ratio of myo-Ins to D-chiro-Ins, which ensures their healthy state and proper functionality. Altered inositol ratios may account for pathological conditions, causing an imbalance in sex hormones. Such situations usually occur in association with medical conditions, such as PCOS, or as a consequence of some pharmacological treatments. Based on the physiological role of inositols and the pathological implications of altered myo-Ins to D-chiro-Ins ratios, inositol therapy may be designed with two different aims: (1) restoring the inositol physiological ratio; (2) altering the ratio in a controlled way to achieve specific effects.

