Химиопрофилактика рака простаты: новые возможности
- Аннотация
- Статья
- Ссылки

Заболеваемость РПЖ в России на 2000 год составила 13,6 на 100 тыс. населения, что соответствует 4 месту по уровню заболеваемости, а по уровню прироста за период с 1990 по 2000 гг. рак простаты находится на 2 месте (63,9%) (3). За 11 лет (с 1989 по 2000 гг.) число впервые выявленных случаев заболевания увеличилось более чем в 2 раза – с 5,5 до 11,6 тыс. Смертность за эти же годы увеличилась с 6,5 до 7,8 на 100 тыс. населения (3).
Более 8 из 10 пациентов, страдающих РПЖ, – это мужчины старше 65 лет. Ожидается, что к 2050 году процент населения старше 65 лет увеличится в Германии с 16 до 24%, в Италии – с 14 до 22%, в США – с 11 до 18%, а в Японии – с 9 до 22% (4).
Увеличение продолжительности жизни и старение мужского населения закономерно приводят к росту заболеваемости РПЖ.
В настоящее время признается ступенчатая теория канцерогенеза, в которой отмечают 3 последовательных этапа: инициацию, промоцию и прогрессию (5). Признается, что опухолевые клетки имеют «неправильный геном». Процесс опухолевого перерождения – это длительный процесс накопления генетических дефектов (6). Значимую роль в патогенезе повреждения молекул ДНК, мутагенезе и развитии раковых болезней у человека отводят свободным радикалам (7). На этапе инициации и промоции повреждения ДНК не достигают критического уровня, а фенотипически (т.е. на гистологическом уровне) они проявляются предраковым изменением эпителия, что в случае предстательной железы представлено простатической интраэпителиальной неоплазией высокой степени (ПИН ВС) или атипической мелкожелезистой пролиферацией – ASAP (atypical small acinar proliferation). С течением времени повреждения ДНК достигают необратимого критического уровня, и развивается рак простаты in situ. В дальнейшем он приобретает способность к инвазивному и метастатическому росту. На основании многочисленных клинических, эпидемиологических, молекулярно-генетических и гистохимических исследований выявлена интимная связь ПИН ВС, ASAP и РПЖ.
Таким образом, непосредственным гистологическим субстратом, на который с целью профилактики РПЖ может быть направлено воздействие потенциальных химиопрофилактических агентов, является ПИН ВС и ASAP.
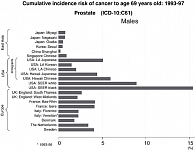
Следует отметить особенности эпидемиологии рака простаты в глобальном масштабе (рисунок 1).
Наиболее высокая заболеваемость, как отмечалось, встречается в западных странах: в США – от 44,3 до 100,2 (в зависимости от расы и места проживания), в Швеции – 44,4, в Швейцарии – 36,3 на 100 тыс. населения; наиболее низкая – в юго-восточном регионе: в Шанхае – 0,8, в Японии – около 4, в Гонконге – 5,1, в Индии – 6,8 на 100 тыс. населения (8). То есть заболеваемость в Азии в 100 с лишним раз ниже, чем в Северной Америке (9).
Заболеваемость раком простаты среди китайцев, мигрировавших в США (Лос-Анджелес), составляет 19,8 на 100 тыс. населения, т.е. более чем в 20 раз выше, чем в Китае. Аналогичная картина отмечается и среди японцев: заболеваемость японцев в США составляет от 32,9 до 34,4 на 100 тыс. населения (9), т.е. в 8,5 раз выше, чем в Японии (10).
Анализ эпидемиологических данных позволяет сделать вывод, что заболеваемость РПЖ зависит не только от генетических и расовых факторов, но также обусловлена особенностями региона проживания. Большинство ученых склонны считать, что под «особенностями региона» следует подразумевать особенности рациона (11).
Диета, богатая различными антиоксидантами (витамины Е, С, А, каротиноиды и др.) и фитоэстрогенами (флавоноиды и изофлавоноиды), характерная для населения Азии и Средиземноморья, обуславливает более низкую частоту РПЖ, чем характер питания в Западной Европе и США (12), где в основном потребляется высококалорийная пища и преобладает гиподинамия.
В качестве химиопрофилактических агентов рака простаты исследуются следующие: ингибиторы 5-a-редуктазы (финастерид, дутастерид), селективные модуляторы эстрогеновых рецепторов (торемифен), селен, витамины Е, С, А, Д; каротиноиды (ликопин, b-каротин), селен, компоненты зеленого чая и изофлавоноиды сои (генистеин, диадзеин), нестероидные противовоспалительные препараты и другие.
В таблице представлены основные исследования по профилактике рака простаты, осуществляемые в мире.
SELECT (Selenium and Vitamin E Cancer Prevention Trial) (13) – крупное рандомизированное интервенционное исследование, спонсируемое Национальным институтом рака США. Дизайн исследования: здоровые мужчины старше 50 лет были разделены на 4 группы, получающие: селен, витамин Е, селен и витамин Е, плацебо. Результаты исследования указывают: ни селен, ни витамин Е, ни их комбинация не приводят к снижению риска развития рака простаты (14).
Тем не менее Dolph L. Hatfield, Vadim N. Gladyshev (15) указывают на необходимость исследований, которые помогут лучше понять биологическую роль селена в организме, чтобы использовать данный микроэлемент с наибольшей выгодой для человека.
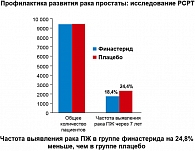
PCPT (Prostate CancerPrevention Trial) (16) – первое крупномасштабное исследование по профилактике рака простаты. Финастерид – ингибитор 5-a-редуктазы II типа. Дизайн исследования: в исследовании участвовали мужчины в возрасте от 55 лет и старше с нормальными данными пальцевого ректального исследования простаты и уровнем простатспецифического антигена (ПСА) 3 нг/мл и менее. Испытуемые были разделены на 2 группы: I группа получала финастерид 5 мг/сут., II – плацебо. Длительность наблюдения – 7 лет. В случае повышения уровня ПСА выше 4 нг/мл в ходе наблюдения рекомендовалась биопсия простаты. После окончания исследования всем больным рекомендовалось пройти биопсию вне зависимости от уровня ПСА. Результаты: частота выявления РПЖ в группе финастерида оказалась на 24,8% меньше, чем в группе плацебо (рисунок 2).
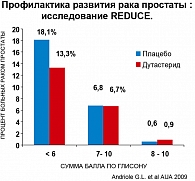
Однако в группе финастерида частота рака с высоким показателем Глисона (7-10) была выше. Эти данные вызвали многочисленные дебаты. Тем не менее после корректировки результатов исследования (по плотности биоптатов) оказалось, что финастерид снижает риск рака простаты как с высоким, так и с низким показателем Глисона (17). Объяснение следующее: финастерид, уменьшая общий объем простаты, не влияет на объем имеющейся низкодифференцированной опухоли, тем самым повышая выявляемость рака с высоким показателем Глисона при повторной биопсии.
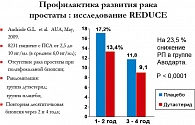
REDUCE (Reduction by Dutasteride of Prostate Cancer Events) (18) – 4-летнее проспективное рандомизированное мультицентровое плацебо-контролируемое III фазы исследование (дутастерид – ингибитор 5-a-редуктазы обоих типов). Пациентам 50-75 лет с повышенным уровнем ПСА (2,5-10 нг/мл) и наличием ПИН ВС в течение 4 лет назначали дутастерид 0,5 мг/сут. Контрольная биопсия простаты выполнялась через 12 и 24 месяца.
Результаты: в группе дутастерида снижение рака простаты на 23,5% (рисунки 3, 4).
Торемифен (Toremifene) относится к группе селективных модуляторов эстрогеновых рецепторов. В 2006 г. опубликованы данные двойного слепого плацебо-контролируемого исследования (фаза IIB) (19). Дизайн исследования: пациенты (всего 514 мужчин) с выявленной ПИН ВС в течение года получали торемифен в дозировке 20 мг/сут., 40 мг/сут., 60 мг/сут. или плацебо. Повторные биопсии выполняли через 6 и 12 месяцев. Результаты: каждая из трех дозировок торемифена приводила к снижению риска развития рака простаты. Наиболее эффективной оказалась дозировка 20 мг/сут., при которой риск развития РПЖ снижался на 48,2% (9,1% vs 17,4%, p < 0,05) по сравнению с группой плацебо. Побочные эффекты в группах достоверно не отличались от плацебо. Сумма баллов по Глисону достоверно не отличалась в подгруппах. Результаты данного исследования послужили толчком для более углубленного изучения влияния торемифена на риск развития рака простаты.
В настоящее время (с 2005 по 2010 гг.) проводится исследование (20) (A Randomized, Double-Blind, Placebo-Controlled, Multicenter Efficacy and Safety Study of Toremifene Citrate for the Prevention of Prostate Cancer in Men With High Grade Prostatic Intraepithelial Neoplasia) по профилактике рака простаты у мужчин с ПИН ВС. Дизайн исследования: мужчины 30 лет и старше (всего рекрутировано 1590 добровольцев) с выявленной ПИН ВС в течение 36 месяцев получают 20 мг/сут. торемифена цитрата или плацебо. Контрольные биопсии выполняются через 12, 24 и 36 месяцев от начала приема препарата. Результаты исследования планируется получить в феврале 2010 года.
Селен (L-Selenium-Based Chemoprevention Of Prostate Cancer Among Men With High Grade Prostatic Intraepithelial Neoplasia) (21) – двойное слепое, плацебо-контролируемое, рандомизированное исследование (фаза III) по профилактике рака простаты у мужчин с ПИН ВС. Дизайн исследования: мужчинам старше 40 лет с диагностированной ПИН ВС в течение 3 лет назначают селен-метионин в дозировке 200 мкг/сут. или плацебо. Контрольные обследования пациентов проводятся 2 раза в год в течение 2 лет, далее 1 раз в год в течение 8 лет. Результаты будут оцениваться на основании контрольной биопсии простаты.
Соя, витамин Е, селен (A double blind, placebo-controlled, randomized study of combination vitamin E, selenium and soy product in patients with high-grade prostatic intraepithelial neoplasia) (22) – двойное слепое, плацебо-контролируемое, рандомизированное исследование по профилактике рака простаты у мужчин с ПИН ВС. Дизайн исследования подобен предыдущим. Пациентам с ПИН ВС в течение 3 лет назначали пищевую добавку, содержащую сою, витамин Е, селен (дозировки не указаны) или плацебо. Через 12, 24 и 36 месяцев выполнялась биопсия простаты. Результаты получены в этом году (23). К сожалению, данная комбинация (соя, витамин Е, селен) не приводит к снижению риска развития рака простаты. Рак простаты выявлен у 26,4% мужчин, что не отличается от группы плацебо.
Проблема профилактики рака простаты актуальна. Поиск путей профилактики поможет глубже понять механизмы возникновения рака простаты. Результаты исследований указывают на эффективность профилактики РПЖ пока главным образом с помощью ингибиторов 5-a-редуктазы (финастерида и дутaстерида).

