Клиническая эффективность Афинитора® (эверолимус) при раке почки и других злокачественных опухолях
- Аннотация
- Статья
- Ссылки

Одним из важнейших метаболических путей для опухолевой прогрессии является сигнальный каскад PI3K/Akt/mTOR, отвечающий за усиление пролиферативной и проангиогенной активности. В опухолевых клетках часто наблюдается повышенная активность сигнального пути PI3K/Akt, что приводит к активации mTOR (мишень к рапамицину у млекопитающих) – ключевого сигнального белка, контролирующего скорость трансляции белков.
Белок mTOR обладает высокой молекулярной массой (289 кДа) и относится к классу серин-треониновых протеинкиназ. В клетках этот белок обнаруживается в виде двух функционально различных комплексов – mTORС-1 и mTORС-2. Открытие комплекса белков mTOR произошло в результате изучения механизма действия рапамицина (сиролимуса) – антибиотика, относящегося к классу макролидов и используемого в трансплантологии в качестве иммуносупрессора. Было отмечено, что рапамицин подавляет пролиферативную активность не только клеток лимфоидного ряда, но и многих других тканей, в том числе и опухолевых. Проведенные исследования показали, что рапамицин образует в клетке комплекс с белком FKBP-12, подавляющий активность mTORС-1, что приводит в конечном итоге к снижению пролиферативной активности и процессов ангиогенеза.
Поскольку рапамицин, несмотря на потенциальную противоопухолевую активность, является достаточно токсичным препаратом, были созданы его аналоги (рапалоги), два из которых были успешно исследованы при раке почки (темсиролимус и эверолимус) и других опухолях. Подробно особенности сигнального пути PI3K/Akt/mTOR и механизмы действия рапамицина и рапалогов были рассмотрены Н.В. Жуковым и М.А. Красильниковым [1].
Лекарственная терапия рака почки в период с начала 1980-х до середины 2000-х представляла собой исключительно лечение цитокинами (интерферон (ИФН) и интерлейкин-2), применение которых обеспечивало время до прогрессирования от 3 до 5 мес. и общую продолжительность жизни от 7 до 17 мес. [2]. При метаанализе 4 исследований по сравнению терапии ИФН с другими видами лечения было показано, что объективный эффект наблюдался у 12,5% больных (против 1,5% при других видах терапии), также было отмечено увеличение 1-летней выживаемости. Сходные данные были продемонстрированы и при применении интерлейкина-2 [3, 4].
Необходимо отметить, что на показатели эффективности при метастатическом раке почки может влиять спонтанная регрессия опухоли (полные и частичные ремиссии) примерно у 7% больных [5], а также проведенная нефрэктомия [6]. Эффективность традиционной химиотерапии при раке почки не была подтверждена. Таким образом, в лекарственной терапии рака почки к середине 1990-х гг. наблюдалось отсутствие прогресса. С появлением препаратов, влияющих на неоангиогенез, отмечен значительный прогресс в лекарственной терапии метастатического рака почки. С 2005 г. были разрешены к применению 4 препарата, 3 из которых представляют ингибиторы тирозинкиназ рецепторов VEGF (сунитиниб, сорафениб и пазопаниб) и бевацизумаб (в сочетании с интерфероном-2α), действующий непосредственно на VEGF (табл. 1).
Другой значимой мишенью лекарственной терапии рака почки оказался рассмотренный выше метаболический путь PI3K/Akt/mTOR. В 2007 г. G. Hudes и соавт. [11] опубликовали результаты исследования темсиролимуса (25 мг, в/в, еженедельно) в 1-й линии терапии рака почки в сравнении с интерфероном-2α (3–18 млн ЕД 3 раза в неделю) у 626 больных, 74% которых имели промежуточный или плохой прогноз по критериям MSKCC. Были продемонстрированы увеличение времени до прогрессирования с 3,1 до 5,5 мес., общей выживаемости с 7,3 до 10,9 мес. и увеличение частоты объективного ответа с 4,8 до 8,6%. Таким образом, была показана значимость подавления активности mTOR.
Другим рапалогом, продемонстрировавшим свою активность при раке почки, стал Афинитор (эверолимус). В предклинических исследованиях [12] и в I фазе клинических исследований [13] была установлена доза эверолимуса, эффективно подавлявшая активность mTOR, – 5–10 мг ежедневно. В исследовании I фазы, в которое были включены 147 больных, Афинитор применялся еженедельно (20 мг, 50 мг или 70 мг) или ежедневно в дозе 5 мг или 10 мг. По результатам исследований для дальнейшего изучения была рекомендована доза 10 мг ежедневно или 50 мг еженедельно. Из 12 пациентов с метастатическим раком почки у одного была отмечена частичная ремиссия и еще у 6 – стабилизация более 6 мес. [12].
В исследование II фазы был включен 41 больной, большинство (83%) из них ранее получали терапию цитокинами. Частичная ремиссия была установлена у 14% больных, а стабилизация более 6 мес. – у 57%. Медиана времени до прогрессирования составила 11,2 мес., общая выживаемость от момента начала терапии – 22,1 мес. [14]. Основными проявлениями токсичности были анорексия, тошнота, диарея, стоматит и пневмонит. У 7 (18%) больных в связи с пневмонитом 3-й степени потребовалось снижение дозы на 7–14-й дни; впоследствии у четырех из этих пациентов доза была повышена до начальной без повторных осложнений. Было отмечено также отклонение 3-й степени уровня АЛТ (10%), ЩФ (8%), гипергликемии (8%) и тромбоцитопении (8%).
Столь успешные результаты позволили начать исследование III фазы эффективности эверолимуса во 2-й линии терапии у больных метастатическим раком почки в сравнении с плацебо (RECORD 1) [15]. Поскольку ко времени начала исследования уже были зарегистрированы показания для сунитиниба или сорафениба в 1-й линии, в исследование включались больные, ранее получавшие эти препараты. Это было первое рандомизированное исследование активности препарата после прогрессирования опухоли на фоне антиангиогенных лекарств.
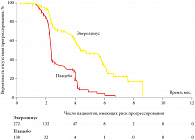
В исследовании больные были рандомизированы в соотношении 2:1 на группы терапии Афинитором 10 мг ежедневно (n = 272) и плацебо (n = 138). При оценке эффекта было убедительно показано увеличение времени до прогрессирования с 1,9 мес. до 4,0 мес. Согласно обновленным в 2009 г. данным [16], медиана времени до прогрессирования составила 4,9 мес. против 1,9 мес. (рис. 1), также было продемонстрировано увеличение общей продолжительности жизни (при исключении из анализа больных группы плацебо, получавших после прогрессирования Афинитор) с 10,0 мес. до 14,8 мес. Важно отметить, что эффект наблюдался независимо от категории риска по MSKCC.
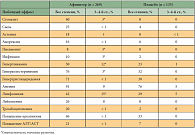
В целом переносимость Афинитора была удовлетворительной, особенно учитывая ранее проведенное лечение (табл. 2).
Таким образом, основными побочными эффектами являлись подавление пролиферации и дифференцировки клеток лимфоцитарного ряда и связанных с этим инфекций, пневмонит, а также поражение слизистой полости рта. При исключении инфекционной природы изменений в легких эффективным оказывалось назначение кортикостероидов.
При оценке активности Афинитора в группах пациентов, получавших ранее в 1-й или 2-й линии терапии ингибиторы тирозинкиназ, было показано, что медиана времени до прогрессирования у больных, получавших ранее только 1 линию лечения, составила 5,42 мес. против 3,78 мес. [17].
На основании полученных результатов Афинитор был разрешен для применения у этой группы больных в России, США и Европе.
Далее было проведено открытое исследование расширенного доступа REACT, в которое были включены в общей сложности 1367 больных раком почки после прогрессирования на фоне терапии ингибиторами тирозинкиназ [18]. Наиболее часто встречавшимися побочными эффектами 3–4-й степени были анемия (13,4%), слабость (6,7%), одышка (6,4%). В целом в исследовании была подтверждена частота встречаемости побочных эффектов.
Вслед за терапией 2-й линии было начато исследование Афинитора в 1-й линии в сочетании с бевацизумабом в сравнении с одним из стандартов лечения – бевацизумаба и интерферона (RECORD 2). Предусматривается включение 360 больных, ранее не получавших системного лечения по поводу рака почки, которые будут рандомизированы на группу терапии Афинитором 10 мг/день постоянно в сочетании с бевацизумабом 10 мг/кг каждые 2 недели и группу лечения бевацизумабом 10 мг/кг каждые 2 недели и интерфероном-α2 (максимальная доза 3 млн ЕД п/к 3 раза в неделю) [19].
Эффективность Афинитора была подтверждена в исследованиях у больных нейроэндокринными опухолями поджелудочной железы (pNET).
Было проведено 3 исследования (RADIANT – 1, 2 и 3 соответственно).
В исследовании II фазы RADIANT-1 [20] были оценены больные, получавшие ранее аналоги соматостатина или химиотерапию по поводу метастатической нейроэндокринной опухоли поджелудочной железы (n = 115). Эти пациенты получали Афинитор 10 мг/день. Вторая группа больных, не получавших ранее аналоги соматостатина (n = 45), получали терапию Афинитором 10 мг/день в сочетании с Сандостатином ЛАР. При оценке эффективности в 1-й группе было отмечено 9,6% частичных ремиссий, у 67,8% больных наблюдалась стабилизация болезни. Медиана времени до прогрессирования составила 9,7 мес. Во 2-й группе было зафиксировано 4,4% частичных ремиссий и 80% стабилизаций. Медиана времени до прогрессирования составила 16,7 мес.
Параллельно было проведено исследование активности Афинитора в сочетании с Сандостатином ЛАР против монотерапии Сандостатином ЛАР у пациентов с нейроэндокринными опухолями желудочно-кишечного тракта (RADIANT-2) [21]. Больные (n = 429) получали обычную дозу Афинитора и Cандостатин ЛАР 30 мг в/м каждые 28 дней или только Сандостатин ЛАР в той же дозе. При оценке эффективности медиана времени до прогрессирования составила 16,4 мес. против 11,3 мес., что соответствовало снижению риска прогрессирования на 23% (р = 0,026). Наиболее частыми побочными эффектами (в основном 1–2-й степени) были стоматит, сыпь, слабость и диарея. Побочные эффекты 3–4-й степени отмечались у более 5% больных и включали стоматит, слабость, диарею, инфекции и гипергликемию.
В исследовании RADIANT-3 [22] оценивалась эффективность терапии эверолимусом у больных метастатическими нейроэндокринными опухолями поджелудочной железы с прогрессированием на фоне химиотерапии или терапии аналогами соматостатина. Больные были рандомизированы на группы терапии Афинитором 10 мг/день (n = 207) или плацебо (n = 203).
При оценке эффективности было показано значительное увеличение времени до прогрессирования при применении Афинитора (с 4,6 мес. до 11,0 мес., р < 0,001). У 43% больных на фоне лечения Афинитором отсутствовало прогрессирование в 18-месячный безрецидивный период против 9% в группе, получавшей плацебо. При проведении многофакторного анализа значимыми для прогноза эффективности терапии Афинитором оказались общее состояние, наличие метастазов в печень и уровень нейронспецифической енолазы (NSE).
На основании проведенных исследований Афинитор был зарегистрирован в мае 2011 г. для терапии нейроэндокринных опухолей поджелудочной железы.
Выше была представлена только малая часть успешно завершенных исследований Афинитора, общее число которых составило более 200 при самых различных локализациях опухолей, в сочетании как с препаратами химио- или таргетной терапии, так и с лучевой терапией.
При раке молочной железы Афинитор был оценен в неоадъювантном режиме в сочетании с летрозолом в сравнении с монотерапией летрозолом [23]. В исследование были включены 270 больных с операбельным гормоночувствительным раком молочной железы, у которых в течение 4 мес. перед операцией проводилась терапия летрозолом 2,5 мг/день с Афинитором 10 мг/день или без него; клинический эффект отмечался у 68,1% и 59,1% соответственно. Также было показано, что добавление к терапии Афинитора значимо снижало экспрессию рецепторов прогестерона, циклина D1, вызывало выраженное снижение активности фосфорилированных форм белка S6. Значимое снижение пролиферативной активности, оцененной Ki67, отмечалось у 57% пациентов в группе, получавшей Афинитор и летрозол, против 30% в группе больных, получавших только летрозол.
В другом исследовании I–II фазы оценивалась активность Афинитора в сочетании с трастузумабом у больных, резистентных к трастузумабу [24]. В исследование были включены 47 больных с HER2-позитивным раком молочной железы, у которых наблюдалось прогрессирование на фоне терапии трастузумабом. Больные получали Афинитор 10 мг/день в сочетании с трастузумабом 8–6 мг/кг каждые 3 недели. У 83% больных были метастазы в висцеральные органы. 38% пациентов имели отрицательный статус по рецепторам эстрогена/прогестерона. При оценке эффективности было установлено, что у 15% больных отмечена частичная ремиссия и еще у 19% – стабилизация более 6 мес. Медиана времени до прогрессирования составила 3,4 мес.
В исследовании F. Andre и соавт. [25] также была оценена способность Афинитора к преодолению резистентности опухоли к проводимой терапии. В исследование активности Афинитора, паклитаксела и трастузумаба были включены 33 больных с HER2-позитивным раком молочной железы, из них 31 был резистентен к таксанам и 32 – к трастузумабу. Ранее пациенты получили в среднем 2 линии химиотерапии. Общая эффективность составила 44%. Контроль болезни в течение 6 и более месяцев отмечен у 74%. Медиана времени до прогрессирования составила 34 недели.
Таким образом, есть основания предполагать, что при раке молочной железы применение Афинитора позволяет преодолеть лекарственную резистентность к трастузумабу и химиотерапии.
При немелкоклеточном раке легкого также были проведены несколько исследований.
J.-C. Soria и соавт. [26] оценили активность Афинитора в монотерапии у больных, ранее получавших химиотерапию с ингибиторов EGFR или без них. В исследование были включены 85 больных, из которых 42 ранее получали только химиотерапию и остальные 43 – химиотерапию и ингибиторы EGFR. Общий эффект составил 4,7% (7,1% и 2,3% в соответствии с ранее проведенным лечением). Медиана времени до прогрессирования составила 2,6 мес. и 2,7 мес. соответственно.
Кроме того, было проведено 2 исследования эффективности комбинации Афинитора с эрлотинибом или с доцетакселом у ранее получавших лечение больных.
В первое исследование [27] были включены 133 больных, получавших Афинитор и эрлотиниб и монотерапию эрлотинибом во 2-й и более линии лечения. Контроль болезни в течение 3 мес. был отмечен у 39,4% против 28,4%, а медиана времени до прогрессирования составила 2,9 мес. против 2 мес. соответственно.
В другом исследовании [28] Афинитор 10 мг/день изучался в комбинации с доцетакселом 60 мг/м2. В исследование были включены 23 больных. Медиана времени до прогрессирования составила 2,3 мес., в то время как медиана общей выживаемости – 12 мес. У 3 больных был зафиксирован частичный эффект, еще у 13 – стабилизация болезни.
Ранее была показана способность Афинитора восстанавливать чувствительность опухолевых клеток к антителам-ингибиторам EGFR [29].
B. Myre и соавт. [30] исследовали активность Афинитора в комбинации с иринотеканом 125 мг/м2 в 1-й и 8-й дни и цетуксимаба в еженедельном режиме у 28 больных, имевших прогрессирование на фоне лечения оксалиплатин- и фторпиримидин-содержащими режимами. При оценке эффективности была зафиксирована 1 полная ремиссия, 2 частичные ремиссии и у 9 – стабилизация из 19 оцененных больных. Таким образом, контроль болезни был отмечен у 63% больных.
A.R. Townsend и соавт. [31] анонсировали исследование активности комбинации Афинитора 5 мг/день в сочетании с иринотеканом 200 мг/м2 и панитумумабом 6 мг/ кг у 50 больных с нативным типом KRAS.
Другим препаратом таргетной терапии метастатического колоректального рака является бевацизумаб – ингибитор VEGF.
I. Altomare и соавт. [32] у больных, ранее получавших бевацизумаб и всю активную химиотерапию, исследовали комбинацию Афинитора 10 мг/день и бевацизумаба 10 мг/кг каждые 2 недели. Несмотря на то что не было отмечено полных или частичных ремиссий, у 46% больных была отмечена стабилизация болезни в течение 6,1 мес.
Оценивая приведенные выше результаты исследований, можно сделать вывод о том, что применение ингибиторов m-TOR, в частности, Афинитора, является весьма перспективным как в монотерапии, так и в различных комбинациях. Афинитор успешно зарекомендовал себя при таких заболеваниях, как рак почки и нейроэндокринные опухоли. При других заболеваниях эффективность Афинитора продолжает изучаться в исследованиях I–II фазы. При этом показана сравнительно хорошая переносимость Афинитора как в монотерапии, так и в сочетании с другими противоопухолевыми препаратами.

