Актуальной проблемой пульмонологии детского возраста остается терапия тяжелой неконтролируемой бронхиальной астмы [1]. По данным статистики, при всем имеющемся арсенале современных противоастматических препаратов почти у 40% пациентов с тяжелым течением данного заболевания не удается достичь желаемой степени контроля над его симптомами. Новые перспективы в этом направлении открывает анти-IgE-терапия, недавно пополнившая арсенал лечебных возможностей врачей-пульмонологов [2–5]. Моноклональные антитела к иммуноглобулину Е (IgE) – лекарственный препарат омализумаб – воздействуют на иммунологическую фазу аллергической реакции [2–4].
В патогенезе бронхиальной астмы IgE отводится ключевая роль, поскольку он отвечает за инициацию аллергической реакции при контакте с аллергеном, что сопровождается выбросом ряда медиаторов, обусловливающих клинические проявления болезни. При этом в ответ на антигенную стимуляцию B-лимфоциты трансформируются в плазматические клетки; те, в свою очередь, продуцируют и выбрасывают в кровоток IgE-антитела. Циркулирующие в крови IgE-антитела связываются с высокоаффинными рецепторами (Fc-эпсилон-RI) на поверхности тучных клеток в тканях и на поверхности базофилов. При повторном контакте с причинным аллергеном его связывание с молекулами IgE индуцирует выброс медиаторов воспаления, что приводит к обострению бронхиальной астмы. Именно поэтому воздействие на указанный механизм аллергии является привлекательной мишенью для терапевтических воздействий [2–8].
С этой целью с помощью гибридомной технологии с последующей гуманизацией был получен оригинальный препарат анти-IgE-антител – омализумаб (Ксолар®), созданный на основе каркаса человеческого IgG, в который имплантирован определяющий комплементарность участок мышиных анти-IgE-антител. Омализумаб связывается с определенным участком молекулы IgE, с тем же локусом, который взаимодействует с IgE-рецептором. При связывании с IgE омализумаб формирует небольшие по размеру, биологически инертные, не связывающие комплемент комплексы, что препятствует дальнейшему прикреплению IgE к рецептору на поверхности эффекторных клеток. Будучи направленным на IgE, омализумаб прерывает сразу несколько ключевых звеньев воспалительного каскада. Он связывает свободно циркулирующие молекулы IgE, значительно снижает экспрессию высокоаффинных рецепторов (Fc-эпсилон-RI-рецепторов) на поверхности тучных клеток и базофилов, что сопровождается уменьшением активации тучных клеток, уменьшением сенсибилизации, а также сокращением притока эозинофилов. Следствием этих событий является значительное снижение выброса медиаторов, уменьшение воспаления и выраженности симптомов обострения бронхиальной астмы [9–11].
Биодоступность омализумаба составляет 62%. Препарат медленно абсорбируется из места введения (пик концентрации отмечается на 7–8-й день) и медленно выводится ретикулогистиоцитарной системой печени. Период полувыведения (Т½) в среднем занимает 26 дней, кажущийся клиренс составляет около 2,4 ± 1,1 мл/кг/сут, при увеличении массы тела вдвое происходит приблизительно двукратное увеличение кажущегося клиренса, что необходимо учитывать при расчете вводимой дозы препарата. В реальной клинической практике расчет индивидуальной дозы препарата проводится разово в начале лечения с учетом уровня общего IgE и массы пациента согласно разработанным таблицам дозирования. Перерасчет индивидуальной дозы проводится только после перерыва в лечении свыше года с учетом вновь определенного уровня общего IgE и массы пациента. Оценку эффективности препарата производят не ранее чем через 16 недель лечения. В ходе исследований лекарственных взаимодействий не установлено [12–14].
В опубликованных данных четырех метаанализов большое внимание уделено эффективности и безопасности применения омализумаба у пациентов с бронхиальной астмой [15, 16]. Сообщается, что среди пациентов с тяжелой персистирующей бронхиальной астмой (согласно критериям GINA*, 2006), получавших лечение омализумабом, отмечено достоверно значимое снижение частоты обострений заболевания, сокращение частоты госпитализаций и обращений за неотложной медицинской помощью; у трети пациентов с тяжелой бронхиальной астмой терапия омализумабом позволила вдвое уменьшить объем базисной противовоспалительной терапии и в большинстве случаев достичь полного контроля заболевания или значительного клинического улучшения. На основании этих результатов данный препарат был рекомендован в качестве средства дополнительной терапии для пациентов с плохим контролем бронхиальной астмы, несмотря на применение высоких доз ингаляционных глюкокортикостероидов в комбинации с длительнодействующими бета-2-агонистами [1].
В клинических исследованиях частота развития нежелательных реакций среди пациентов, получавших Ксолар®, была сравнима с частотой в группе плацебо [5, 10, 17]. Частыми (> 1/100 – > 1/10) нежелательными явлениями были боль, отек, эритема и зуд в месте введения препарата, а также головные боли. Они развивались чаще всего в течение первого часа от момента введения препарата и сохранялись до нескольких дней, однако их выраженность значительно снижалась с каждым последующим введением. Среди серьезных нежелательных эффектов отмечены анафилактические реакции (< 0,1%) в течение 2 часов после введения препарата, которые требовали прекращения лечения (описаны также несколько случаев отсроченной анафилактической реакции – через 24 часа и более), причем до настоящего момента не удалось выявить закономерности их развития [17]. Детальный анализ 67 клинических исследований I–IV фаз с использованием препарата Ксолар® позволил подтвердить отсутствие влияния омализумаба на частоту развития злокачественных новообразований [18].
Имеются отдельные сообщения о возможности развития тяжелой идиопатической тромбоцитопении, алопеции, аллергического гранулематозного ангиита (синдром Черджа – Стросса (Churg-Strauss)). Прием Ксолара может также способствовать повышению частоты гельминтозов, поскольку при этом в норме формируется IgE-опосредованный ответ (частота гельминтозов составила менее 1:1000) [11].
Выяснилось, что среди всех критериев эффективности наиболее общим предиктором ответа на прием омализумаба является уровень общего IgE, так как в исследованиях его низкий исходный уровень (менее 75 МЕ/мл) ассоциировался с незначительным терапевтическим эффектом. Предсказать клиническую эффективность этого препарата, исходя из других индивидуальных критериев оценки бронхиальной астмы, оказалось затруднительным [7, 19], поэтому по истечении 16 недель лечения омализумабом предлагается в каждом конкретном случае принять решение о дальнейшем его использовании с учетом степени тяжести заболевания до лечения, потребности в дополнительной терапии и динамики частоты обострений. Согласно отечественным рекомендациям, омализумаб (Ксолар®) показан для лечения среднетяжелой и тяжелой атопической бронхиальной астмы персистирующего течения при недостаточном эффекте ингаляционных глюкокортикостероидов у пациентов старше 6 лет [1].
Несмотря на то что в российской педиатрической практике омализумаб (Ксолар®) используется с 2008 г., опыт лечения детей с тяжелой бронхиальной астмой этим препаратом в нашей стране невелик, что объясняется высокой стоимостью препарата, строгими критериями отбора на лечение, а также необходимостью организации тщательного мониторинга за состоянием здоровья пациентов, получающих терапию омализумабом.
Целью данного исследования явилась оценка эффективности анти-IgE-терапии у детей с тяжелой неконтролируемой бронхиальной астмой и определение прогностической значимости мониторинга уровня оксида азота в выдыхаемом воздухе (FeNO) на фоне данного лечения.
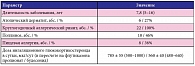
В клинике пульмонологии Московского НИИ педиатрии и детской хирургии с 2008 по 2013 г. накоплены данные по длительной непрерывной терапии омализумабом у 22 детей в возрасте от 8 до 17 лет с тяжелой неконтролируемой бронхиальной астмой (6 девочек, 16 мальчиков). Из них 15 детей (5 девочек, 10 мальчиков) продолжают получать лечение препаратом Ксолар® в настоящее время. Ранее все исследуемые пациенты неоднократно проходили стационарное обследование по поводу тяжелой бронхиальной астмы. Средний возраст пациентов составил 12,5 ± 0,5 лет, продолжительность заболевания – от 5 до 16 лет (табл. 1).
У всех пациентов были выявлены сопутствующие аллергические заболевания (аллергический ринит, пищевая аллергия, поллиноз, атопический дерматит). При иммунологическом исследовании отмечалось увеличение уровня общего IgЕ в крови от 72 до 1130 (618 ± 54) МЕ/мл, что доказывало атопический характер заболевания; выявлена высокая сенсибилизация к бытовым (у 19 из 22), эпидермальным (у 10 из 22) аллергенам и примерно в половине случаев – к грибковым (у 8 из 22) и пыльцевым (у 14 из 22) аллергенам. Пищевая сенсибилизация имела место у 1/3 больных.
Все пациенты на момент назначения препарата Ксолар® в качестве базисной противовоспалительной терапии длительно получали комбинированные препараты, содержащие ингаляционные глюкокортикостероиды и длительнодействующие бета-2-агонисты (Серетид®, Симбикорт®) в высоких дозах (500–1000 мкг/сут по флутиказона пропионату или 480–640 мкг/сут по будесониду), тем не менее у них сохранялась низкая степень контроля над заболеванием.
Измерение уровня оксида азота в выдыхаемом воздухе (FeNO) проводилось в режиме онлайн с помощью хемилюминесцентного газоанализатора 280i (Sievers, США) в соответствии с общепринятыми требованиями протоколов Американского торакального общества (American Thoracic Society – ATS) / Европейского респираторного общества (European Respiratory Society – ERS) [20].
С учетом исходного уровня общего IgE и массы тела, 8 пациентов получали подкожно Ксолар® 2 раза, остальные – 1 раз в месяц. Местных и общих реакций на введение препарата ни в одном случае отмечено не было, что свидетельствует о его хорошей переносимости. Средняя продолжительность лечения составила 1,8 ± 0,4 года. К настоящему моменту из пятнадцати детей, получающих Ксолар®, 5 пациентов получают препарат в течение 2,5 лет, четверо – 1,5 года, остальные – от 6 до 12 месяцев.
Пять пациентов старшего возраста (старше 18 лет) по окончании двухлетнего курса лечения препаратом Ксолар® продолжили получать традиционную базисную терапию комбинированными препаратами, содержащими ингаляционный глюкокортикостероид и длительнодействующий бета-2-агонист, и были направлены для продолжения терапии Ксоларом в лечебные учреждения для взрослых, но только одна пациентка в настоящее время смогла реально продолжить данный вид лечения. Двое пациентов прекратили введение препарата в первые месяцы лечения из-за низкой комплаентности (пропускали очередные введения без уважительных причин и не следовали рекомендациям по продолжению базисного лечения).
На фоне добавления препарата Ксолар® к базисной противовоспалительной терапии все пациенты отметили стойкую положительную динамику в течении тяжелой бронхиальной астмы, что выразилось в сокращении потребности в дополнительном использовании бронхолитиков, снижении частоты дневных и ночных симптомов, улучшении переносимости физических нагрузок. При анализе результатов АСТ-теста (Asthma Control Test – тест по контролю над астмой) в динамике отмечалось стойкое линейное увеличение в зависимости от продолжительности лечения: от 13,3 ± 2,5 (9–15) баллов до начала лечения Ксоларом до 19,9 ± 1,8 баллов к концу второго года анти-IgE-терапии. За все время наблюдения тяжелых обострений, требующих использования системных глюкокортикостероидов, а также вызовов скорой медицинской помощи и экстренных госпитализаций по поводу обострений бронхиальной астмы, у всех пациентов, получавших Ксолар®, не регистрировали. У большей части детей на фоне введения препарата Ксолар® отмечено значительное уменьшение выраженности симптомов аллергического ринита, поллиноза и атопического дерматита, что у некоторых пациентов сопровождалось не только отсутствием сезонных обострений, но и возможностью расширения рациона питания за счет включения в него ранее недоступных косточковых фруктов.
Поскольку все пациенты длительно получали комбинированные препараты, содержащие ингаляционный глюкокортикостероид и длительнодействующий бета-2-агонист, параметры внешнего дыхания у большинства из них значимо не выходили за пределы должных значений, отчетливой их динамики на фоне терапии Ксоларом нами не отмечено (табл. 2). Следует заметить, что добавление препарата Ксолар® в схему традиционного базисного лечения тяжелой бронхиальной астмы в большинстве случаев не позволило нам существенно уменьшить объем базисной противовоспалительной терапии, однако у всех пациентов степень контроля над заболеванием стала качественно выше.
Весьма показательны результаты мониторинга уровня оксида азота в выдыхаемом воздухе (FeNO) у 22 пациентов с неконтролируемой тяжелой бронхиальной астмой на фоне анти-IgE-терапии препаратом омализумаб (Ксолар®). Исходно у 80% исследуемых детей (n = 18) уровень FeNO был значительно увеличен – до 48,9 ± 5,2 ppb (28,6–78,4 ppb). К 16-й неделе лечения препаратом Ксолар® он сократился до 36,5 ± 3,8 ppb (19,4–49,4 ppb; р = 0,188). В последующие 2 года лечения Ксоларом на фоне достижения хорошего контроля над заболеванием уровень FeNO оставался близким к нормальным значениям (21,5 ± 4,3 ppb; 10,7–26,3 ppb; р = 0,002). В то же время у пациентов с худшей степенью контроля сохранялось значимое повышение уровня FeNO (39,7 ± 4,8 ppb; 27,4–53,6 ppb; p = 0,26).
Отметим, что у 4 детей уровень FeNO исходно был близок к нормальному (17,8 ± 3,2 ppb; 12,5–22,8 ppb); у них же имелся относительно невысокий уровень общего IgE (72–87 МЕ/мл). Последующее наблюдение этой группы больных продемонстрировало сравнительно меньшую эффективность добавления препарата Ксолар® к базисной противовоспалительной терапии бронхиальной астмы, чем у пациентов с исходно высокими уровнями общего IgE и FeNO. В ходе двухлетнего наблюдения уровень FeNO у них не претерпел значимых изменений. Это, по нашему мнению, позволяет прогнозировать более выраженный ответ на анти-IgE-терапию у пациентов с тяжелой бронхиальной астмой с выраженными атопическими механизмами воспаления. Подобные выводы были сделаны также в работах P. Silkoff и соавт. (2004), M. Diarmuid и соавт. (2012) [21, 22].
Поскольку данная методика определения высокоспецифичного маркера атопического воспаления дыхательных путей – уровня оксида азота в выдыхаемом воздухе (FeNO) – является неинвазивной, чувствительной и быстрой в исполнении [23–25], то, с учетом ее растущей распространенности и доступности, целесообразно рекомендовать мониторинг уровня FeNO у пациентов с тяжелой бронхиальной астмой, получающих анти-IgE-терапию, для оценки эффективности проводимого лечения и оптимизации объема базисной противовоспалительной терапии.
Для иллюстрации данного положения приводим клиническое наблюдение.
Пациентка С., страдающая тяжелой бронхиальной астмой. Семейный аллергоанамнез отягощен: у старшей сестры – поллиноз, у тетки по материнской линии и двух ее детей – бронхиальная астма. Из анамнеза заболевания известно, что у ребенка с первого года жизни отмечались проявления атопического дерматита, пищевой и лекарственной аллергии; с 6 лет – круглогодичный аллергический ринит. С первого года жизни отмечались повторные обструктивные бронхиты, с 3 лет – типичные приступы удушья (круглогодично, ежемесячно). По тяжести состояния ребенок 3–6 раз в год госпитализировался в стационар, получал инфузионную терапию с эуфиллином, преднизолоном, однако диагноз бронхиальной астмы был установлен только в возрасте 6 лет. В качестве базисной терапии пациентка длительно получала препараты кромонового ряда без выраженного эффекта. С 9 лет получала ингаляционные глюкокортикостероиды – Фликсотид (250–750 мкг/сут), затем – Серетид в постоянно возрастающих дозировках (50/250–100/500 мкг/сут). На фоне непрерывной терапии комбинированными препаратами, содержащими ингаляционный глюкокортикостероид и длительнодействующий бета-2-агонист, в течение 6 лет состояние ребенка несколько улучшилось: приступы стали реже, легче и купировались в домашних условиях ингаляциями беродуала через небулайзер, количество госпитализаций сократилось до 2–3 раз в год. Состояние ребенка вновь ухудшилось в возрасте 14 лет: приступы затрудненного дыхания участились до нескольких раз в сутки, резко возросла потребность в бета-2-агонистах (до 10 доз/сут), за 3 месяца пациентка дважды была госпитализирована для проведения инфузионной терапии, доза Серетида была увеличена до 1000 мкг/сут по флутиказону. Однако в течение 8 месяцев лечения стабилизации достигнуть не удалось, течение бронхиальной астмы оставалось плохо контролируемым, сохранялись приступы затрудненного дыхания до 3–4 раз в неделю, эпизоды ночного кашля и одышка при физической нагрузке, в связи с чем ребенок был направлен в Московский НИИ педиатрии и детской хирургии.
При поступлении в нашу клинику пульмонологии в возрасте 15 лет состояние пациентки было расценено как тяжелое: отмечалась одышка при умеренной физической нагрузке, ночной кашель. При осмотре грудная клетка была вздута, перкуторно над легкими определялся тимпанит, при аускультации дыхание ослаблено, хрипы не выслушивались. При обследовании в общем анализе крови – без патологических изменений, при иммунологическом обследовании выявлено повышение уровня общего IgЕ до 134 МЕ/мл, значимая сенсибилизация к бытовым и эпидермальным аллергенам. На рентгенограмме органов грудной клетки отмечались признаки обструктивного синдрома. Поскольку исходные показатели функции внешнего дыхания на фоне приема комбинированных препаратов, содержащих ингаляционные глюкокортикостероиды и бета-2-агонисты длительного действия, в высоких дозах находились в пределах должных величин, была проведена проба с дозированной физической нагрузкой, выявившая наличие генерализованного постнагрузочного бронхоспазма, уровень оксида азота в выдыхаемом воздухе был увеличен в 2,5 раза (до 50,3 ppb при норме до 20 ppb). Таким образом, на основании данных анамнеза, результатов обследования был установлен диагноз частично контролируемой тяжелой атопической бронхиальной астмы. Базисная терапия Серетидом (100/1000 мкг/сут) была дополнена омализумабом (Ксолар®) подкожно 300 мг × 1 раз в 4 недели.
Последующее динамическое наблюдение в течение 2 лет показало: если до начала терапии Ксоларом на фоне комбинированных ингаляционных препаратов в высоких дозах пациентке не удавалось достичь контроля над тяжелой бронхиальной астмой (результат АСТ-теста до лечения Ксоларом составил 12 баллов), то спустя 16 недель после назначения терапии результат АСТ-теста составил уже 20 баллов, что свидетельствовало о хорошей степени контроля заболевания и делало оправданным продолжение анти-IgЕ-терапии. Высокая суточная вариабельность показателей пиковой скорости выдоха до лечения Ксоларом свидетельствовала о нестабильном состоянии пациентки; на фоне терапии Ксоларом график, отражающий изменение пиковой скорости выдоха, постепенно приобрел вид плавной кривой, а суточный разброс показателей пиковой скорости выдоха составил менее 20%. На фоне добавления в комплекс базисной противовоспалительной терапии инъекций Ксолара, наряду с отчетливым клиническим улучшением, было выявлено улучшение функциональных параметров – исчез бронхоспазм после пробы с дозированной физической нагрузкой, и нормализовался уровень оксида азота в выдыхаемом воздухе (18,5 ppb).
По достижении возраста 18 лет пациентка была направлена для продолжения анти-IgЕ-терапии в НИИ пульмонологии, где она наблюдается по настоящее время. Достигнутая в начале терапии препаратом Ксолар® степень контроля заболевания сохраняется на прежнем уровне; значительно легче протекают сезонные обострения, сохраняется высокая толерантность к физической нагрузке. Госпитализаций и вызовов скорой медицинской помощи по поводу обострений бронхиальной астмы в течение последних 5 лет не отмечалось. Пациентка успешно учится в вузе, что подтверждает возможность качественной социальной адаптации больного с тяжелой бронхиальной астмой при правильно подобранной базисной противовоспалительной терапии.
В целом, учитывая широкие терапевтические возможности и доказанную эффективность у наиболее тяжелого контингента больных с бронхиальной астмой, угрожаемых по смертельному исходу заболевания, следует полагать, что терапия препаратом Ксолар® займет достойное место в арсенале современных противоастматических средств у детей.