Клинический случай осложненного течения болезни Крона
- Аннотация
- Статья
- Ссылки
- English
Введение
Воспалительные заболевания кишечника (ВЗК), к которым относятся язвенный колит (ЯК) и болезнь Крона (БК), традиционно рассматриваются как гетерогенные заболевания с неизвестной до настоящего времени этиологией, непредсказуемым течением и отсутствием совершенных методов лечения.
БК характеризуется поражением любого отдела желудочно-кишечного тракта (ЖКТ) и не имеет способов полного излечения. Большинство пациентов с БК в течение жизни переносят хотя бы одно оперативное вмешательство на ЖКТ [1].
По данным мировой литературы, около 50% пациентов с БК нуждаются в хирургическом лечении в течение первых десяти лет от дебюта заболевания. Как правило, самыми частыми показаниями к срочной операции служат кишечная непроходимость или наличие инфильтрата в брюшной полости [2–4]. Невозможность радикального излечения пациентов с БК нередко приводит к повторным резекциям, увеличивая риск синдрома короткой кишки.
Даже при полном удалении всех макроскопически измененных отделов кишечника хирургическое вмешательство не приводит к полному выздоровлению: в течение пяти лет клинически значимый рецидив отмечается у 28–45% пациентов, а в течение десяти лет – у 36–61%, что диктует необходимость назначения или продолжения противорецидивной терапии после операций по поводу БК [5, 6].
Современная тактика хирургического лечения БК направлена на выполнение экономных резекций, в частности тонкой кишки, а при возможности – проведение органосохраняющих вмешательств (стриктуропластика, эндоскопическая дилатация) [7–12].
На протяжении многих лет медикаментозная терапия БК была ограничена глюкокортикостероидами (ГКС) и иммуномодуляторами, а единственной альтернативой являлось хирургическое лечение. Появление биологических препаратов, в частности ингибиторов фактора некроза опухоли альфа (ФНО-α), повлияло на ход истории заболевания и расширило терапевтические возможности для контроля активности заболевания [13, 14]. Несмотря на появление биологической терапии, хирургическое лечение продолжает играть важную роль в лечении БК [15–19]. Сочетание биологической терапии и хирургических методов лечения у больных с осложненным течением БК в настоящее время позволяет значительно улучшить качество жизни пациентов [20, 21]. Кроме того, одним из основных этапов ведения данной группы больных является четкая маршрутизация, которая позволяет сократить время на каждом этапе и наиболее быстро оказать помощь пациенту.
Клиническое наблюдение
Больной К., 21 год, поступил в отделение лечения ВЗК Московского клинического научного центра (МКНЦ) им. А.С. Логинова с жалобами на боли в правой подвздошной области, лихорадку до 38 °С.
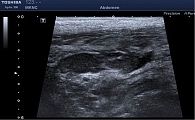
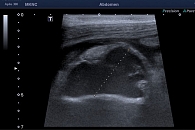
Из анамнеза известно, что считает себя больным с 2017 г., когда отметил появление болей ноющего характера в животе, без четкой локализации. Не обследовался, к врачам не обращался. Принимал спазмолитики с временным положительным эффектом. В мае 2018 г. впервые отметил повышение температуры тела до 39 °С, появились боли в правой подвздошной области высокой интенсивности. По скорой медицинской помощи госпитализирован в ГКБ им. В.П. Демихова, где по результатам обследования диагностирован аппендикулярный инфильтрат. В связи с положительной динамикой на фоне антибактериальной терапии от дальнейшего лечения отказался. Выписан с рекомендациями амбулаторного лечения под наблюдением терапевта и хирурга по месту жительства. Ухудшение состояния пациента случилось в конце ноября 2018 г., когда вновь появились боли в правой подвздошной области. Больной обратился в клинико-диагностическое отделение МКНЦ им. А.С. Логинова, где по результатам ультразвукового исследования (УЗИ) органов брюшной полости в правой подвздошной области выявлен инфильтрат с признаками абсцедирования (рис. 1). По скорой медицинской помощи госпитализирован в ГКБ им. Е.О. Мухина, где больному выполнена серия дренирующих вмешательств. В декабре 2018 г. пациент переведен в отделение колопроктологии МКНЦ им. А.С. Логинова. С целью проведения дифференциального диагноза между аппендикулярным инфильтратом с абсцедированием и БК тонкой кишки проведено дообследование. По данным лабораторных исследований, отмечалось снижение уровня гемоглобина (Hb) до 71 г/л, снижение количества эритроцитов до 2,8 млн, умеренный лейкоцитоз – 9,8 тыс. с палочкоядерным сдвигом до 22%, тромбоцитоз – 645 тыс., увеличение СОЭ до 35 мм/ч, белково-энергетическая недостаточность (гипоальбуминемия до 26 г/л, гипопротеинемия до 51 г/л), повышение С-реактивного белка (СРБ) до 77 мг/л, снижение уровня сывороточного железа до 1,6 мкмоль/л, снижение уровня креатинина до 46 мкмоль/л, водно-электролитные нарушения (гипонатриемия до 132,2 ммоль/л, гипохлоремия до 97,4 ммоль/л). По данным коагулограммы выявлена вторичная коагулопатия в стадии гипокоагуляции (МНО – 1,5, снижение протромбина до 56%). При колонофиброскопии (КФС) колоноскоп проведен предположительно в купол слепой кишки, на доступных визуализации редких участках патологических изменений не обнаружено.
При мультиспиральной компьютерной томографии (МСКТ) с внутривенным контрастированием в брюшной полости выявлен абсцесс (в малом тазу вдоль правой большой поясничной мышцы с переходом на подвздошно-поясничную мышцу) с наличием тонкокишечных свищей, возможно наличие свищевого хода с прямой кишкой; признаки вовлечения в инфильтрат правого мочеточника с формированием правосторонней уретероэктазии и каликопиелоэктазии.
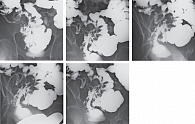
При рентгенографии тонкой кишки с пассажем бария выявлены рентгенологические признаки абсцесса и инфильтрата в малом тазу справа с формированием множественных свищевых ходов, сообщающихся с подвздошной, прямой и сигмовидной кишками; вторичный илеит; признаки вторичного сигмоидита и проктита; спаечный процесс в брюшной полости и малом тазу, убедительные признаки БК не отмечены (рис. 2). При проктографии – рентгенологическая картина инфильтративного поражения (воспалительный инфильтрат) стенок прямой и сигмовидной кишок.
Больному проводили обследование для исключения туберкулезной инфекции (диаскинтест отрицательный, при МСКТ органов грудной клетки патологии не выявлено).
В связи с сохраняющимися водно-электролитными нарушениями, белково-энергетической недостаточностью с целью их коррекции больной был переведен в отделение реанимации и интенсивной терапии, где продолжено проведение интенсивной консервативной терапии с применением водно-солевых растворов, антибактериальной терапии, переливание компонентов крови и нутриционная поддержка. В связи с наличием расширения чашечно-лоханочной системы (ЧЛС) правой почки и верхней трети правого мочеточника больному выполнена постановка нефростомы, дренирование абсцесса брюшной полости под УЗ-контролем и установлен дренаж.
Несмотря на проводимую терапию, у больного отмечена отрицательная динамика по клинико-лабораторным данным: увеличение дебита кишечного отделяемого по дренажной системе, гипертермия до 39 °С, нарастание симптомов системной воспалительной реакции, белково-энергетической недостаточности, ухудшение общего состояния.
Совместно с колопроктологами принято решение о проведении хирургического лечения. Интраоперационно выявлен инфильтрат, состоящий из петли подвздошной кишки, слепой кишки, интимно спаянный с передней брюшной стенкой париетальной брюшиной правого латерального канала, правой подвздошной области, а также брыжейкой подвздошной кишки вплоть до ее корня. Визуализировались многочисленные стриктуры тонкой кишки и свищевые ходы, а также наличие гнойного содержимого при попытке разделить компоненты инфильтрата. С учетом наличия гнойно-воспалительного процесса, явления тонкокишечной непроходимости решено было хирургическое вмешательство завершить формированием концевой илеостомы.
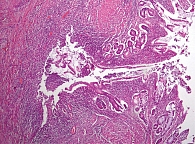
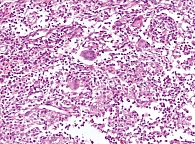
По данным морфологического исследования, в препарате фрагменты стенки подвздошной и толстой кишок с умеренной лимфоплазмоцитарной инфильтрацией в собственной пластинке, с деструкцией крипт и формированием щелевидных эрозий, участками трасмурального воспаления, а также эпителиоидно-клеточными гранулемами с многоядерными гигантскими клетками в толще кишечной стенки. Данная морфологическая картина соответствует клиническому диагнозу «БК в форме илеоколита» (рис. 3, 4).
В послеоперационном периоде проводилась антибактериальная терапия цефтриаксоном 2 г в сутки и метронидазолом 1,5 г в сутки, месалазином с этилцеллюлозным покрытием 5 г в сутки, ривароксабаном 20 мг в сутки с положительным эффектом, что подтверждалось клинико-лабораторными данными (Нb – 101 г/л, эритроциты – 3,7 млн, лейкоциты – 8,8 тыс., СОЭ – 29 мм/ч, альбумин – 37 г/л, белок – 75 г/л, СРБ – 23 мг/л, сывороточное железо – 8,9 мкмоль/л).
Согласно российским клиническим рекомендациям по тактике ведения пациентов с БК, к факторам, достоверно повышающим риск послеоперационного рецидива, относятся следующие: курение, две и более резекции кишки в анамнезе, протяженные резекции тонкой кишки более 50 см, перианальные поражения, пенетрирующий фенотип, ранний дебют заболевания [12, 20, 22].
В зависимости от сочетания факторов риска, а также эффективности ранее проводившейся противорецидивной терапии пациенты после операции должны быть стратифицированы на группы с различным риском послеоперационного рецидива. К группе высокого риска относятся больные, имеющие два и более факторов риска [23–26].
Пациент К. имел высокий риск послеоперационного рецидива: из анамнеза известно, что курит в течение пяти лет, имеет пенетрирующий тип БК и протяженную резекцию кишечника 60 см.
Таким образом, по жизненным показаниям пациенту рекомендована терапия генно-инженерным биологическим препаратом (ГИБП) цертолизумаба пэгол (Симзия®) по стандартной схеме: по 400 мг подкожно на 0, 2, 4-й неделях, далее 400 мг один раз в четыре недели. Также больной принимал метронидазол 1,5 г в сутки курсами по 14 дней каждые шесть месяцев [21].
Через шесть месяцев проведено контрольное обследование в МКНЦ им. А.С. Логинова, при котором, по данным эндоскопического исследования, отмечалась минимальная активность БК (на 10 см от илеостомы визуализировались две афты размерами 5 × 3 и 6 × 5 мм). По данным лабораторных исследований, признаков воспаления отмечено не было (СРБ – 2,9 мг/л, СОЭ – 13 мм/ч, лейкоциты – 6 тыс.). Решено продолжить биологическую терапию препаратом цертолизумаба пэгол (Симзия®) в комбинации с азатиоприном в дозе 100 мг в сутки. Пациент с февраля 2020 г. самостоятельно отменил прием азатиоприна.
Ухудшение состояния отмечено в октябре 2020 г. в виде появления эпизодов приступообразных болей в животе, тошноты, однократной рвоты съеденной пищей. Вновь госпитализирован в МКНЦ им. А.С. Логинова. При обзорной рентгенографии брюшной полости в проекции левого подреберья отмечаются широкие тонкокишечные уровни, в правой половине – полуарка (формирование чаши Клойбера), максимальный просвет кишки на этом участке – 54 мм. Данная рентгенологическая картина свидетельствовала о тонкокишечной непроходимости, вероятнее всего хронического характера.
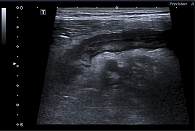
При УЗИ кишечника обращали на себя внимание расширенные петли тонкой кишки до 35 мм с неоднородным гиперэхогенным содержимым, перистальтика местами лоцирована, местами крайне вялая; справа лоцирован небольшой фрагмент тонкой кишки с утолщенными стенками до 5 мм (рис. 5, 6).
При КФС – аппарат через илеостому проведен на 10 см в подвздошную кишку, далее определяется сужение просвета до 0,3–0,4 см, провести аппарат в вышележащие отделы не удалось, в области стриктуры определяется циркулярная язва, покрытая фибрином, слизистая дистальнее стриктуры розовая, бархатистая, перистальтика активная.
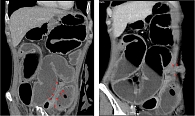
Данные КТ-энтерографии подтвердили формирование стриктуры подвздошной кишки с развитием субкомпенсированной тонкокишечной непроходимости (рис. 7).
С учетом клинической картины, данных эндоскопических и рентгенологических исследований пациенту показано хирургическое лечение. Больной переведен в отделение колопроктологии МКНЦ им. А.С. Логинова, где проведено хирургическое вмешательство в следующем объеме: резекция петли подвздошной кишки, несущей стому, протяженностью около 20 см, включая участок стриктуры, реформирование концевой илеостомы. Послеоперационный период протекал без осложнений, дренаж удален на 7-е сутки. Больной выписан на амбулаторное лечение. Принимал метронидазол по 500 мг три раза в сутки в течение 14 дней, через один месяц после хирургического лечения возобновлена биологическая терапия препаратом цертолизумаба пэгол (Симзия®) по схеме: 400 мг подкожно каждые четыре недели. По лабораторным данным, признаки воспаления не отмечены (СРБ, СОЭ, лейкоциты, тромбоциты в пределах референсных значений). В дальнейшем пациент чувствовал себя хорошо, соблюдал рекомендации. Контрольное обследование запланировано через шесть месяцев.
Препарат цертолизумаба пэгол (Симзия®) пациенты с ВЗК получают в Москве в рамках дополнительного лекарственного обеспечения категорий граждан, имеющих право на предоставление набора социальных услуг, благодаря четкой системе маршрутизации пациентов, которая включает в себя получение протокола врачебной комиссии, проводимой в МКНЦ им. А.С. Логинова, рецепта на ГИБП и получение этого препарата в определенной аптеке. Кроме того, возможно проведение индивидуальной закупки данного препарата, инициированной врачебной комиссией, проводимой в МКНЦ им. А.С. Логинова. Таким образом, все пациенты, нуждающиеся в лечении ГИБП в Москве, обеспечены данными препаратами своевременно.
Обсуждение и заключение
БК – прогрессирующее заболевание, требующее регулярного контроля воспалительной активности и междисциплинарного подхода с привлечением врачей многих специальностей (гастроэнтерологов, колопроктологов, урологов, фтизиатров, ревматологов и врачей других специальностей). У 70% пациентов БК носит прогрессирующий характер [27].
По современным представлениям, БК можно разделить по активности на три фазы. Доклиническая фаза характеризуется наличием субклинического воспаления (нарушение иммунного ответа и развитие гистологического повреждения внутри стенки кишечника), отсутствием характерных клинических, лабораторных, эндоскопических, рентгенологических критериев постановки диагноза.
Далее следует фаза ранних проявлений БК, когда у больного появляются неярко выраженные клинические симптомы БК (лихорадка неясного генеза, железодефицитная анемия, эпизоды диареи, боли в животе, слабость, снижение массы тела) и воспалительные маркеры (повышение уровня СРБ, СОЭ, ферритина, пресепсина, фибриногена, фекального кальпротектина, тромбоцитоз, лейкоцитоз) в анализах крови и кала. На этом этапе впервые регистрируются эндоскопические и рентгенологические признаки заболевания и возможно установить диагноз БК.
Следующая фаза – это фаза поздних проявлений БК. К ним относятся осложнения БК: формирование кишечных свищей, инфильтратов брюшной полости, стриктур с нарушением кишечной проходимости, абсцессов, развитие колоректального рака. К сожалению, более чем 50% больных диагноз БК устанавливается уже на этапе ее поздних проявлений.
По данным опроса пациентов с ВЗК в странах Европы, 64% больных нуждались в экстренной медицинской помощи еще до установления диагноза БК или ЯК, а у 18% пациентов прошло более пяти лет от начала появления симптомов до установления диагноза [28].
Данный клинический случай демонстрирует как раз пример поздней диагностики БК (диагноз установлен через два года от начала появления симптомов), когда заболевание приняло уже прогрессирующий характер и произошло развитие осложнений, требующих хирургического вмешательства, – формирование инфильтрата брюшной полости с абсцедированием, сдавление мочеточников. Назначение ГКС и ГИБП у пациентов с наличием абсцессов брюшной полости противопоказано, поэтому принято решение о проведении на первом этапе хирургического лечения и антибактериальной терапии, а через месяц присоединена биологическая терапия в связи с наличием высоких рисков послеоперационного рецидива БК. Это позволило приостановить прогрессивное течение заболевания.
Важность контрольного обследования через шесть месяцев после хирургического лечения у пациентов с БК неоспорима. У исследуемого пациента по результатам КФС удалось своевременно скорректировать терапию – присоединить азатиоприн в дозе 100 мг в сутки, что сдержало на полгода прогрессию заболевания. Однако больной самостоятельно отменил препарат, в результате чего развилось осложнение в виде формирования стриктуры подвздошной кишки с развитием тонкокишечной непроходимости, потребовавшее повторного хирургического лечения.
Благодаря совместному ведению пациента гастроэнтерологами, колопроктологами, урологами, четкой и своевременной маршрутизации была своевременно оказана высокотехнологичная помощь с применением современных хирургических методов лечения и использованием ГИБП, что явилось сдерживающим фактором прогрессии БК.
N.A. Fadeeva, PhD, O.V. Knyazev, PhD, Prof., M.A. Danilov, PhD, S.G. Khomeriki, PhD, Prof., K.A. Nikolskaya, PhD, E.Yu. Zhulina, PhD, M.V. Pavlov, B.S. Nikitin, D.S. Bordin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Ryzhikh National Medical Research Centre for Coloproctology
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Nina A. Fadeeva, chuevana@mail.ru
A clinical case of a complicated course of Crohn's disease (CD) in a young patient is presented. The article reflects the features of the diagnosis, tactics of conservative and surgical treatment of CD. The issues of routing patients with inflammatory bowel diseases are also considered.

