Лечение метастатической меланомы кожи с мутацией в гене BRAF V600Е
- Аннотация
- Статья
- Ссылки
- English

Введение
Меланома кожи (МК) является одной из наиболее агрессивных злокачественных опухолей. На долю меланомы в структуре всех злокачественных новообразований приходится всего 4% [1, 2]. Однако в группе злокачественных опухолей кожи 90% смертей обусловлены меланомой [3]. Во всем мире наблюдается рост заболеваемости меланомой.
В настоящее время результаты фундаментальных исследований изменили понимание молекулярно-генетических механизмов развития заболевания.
Самая изученная онкогенная мутация при МК – BRAF, кодирующая серин-треонин протеинкиназу, которая в свою очередь действует в MAPK-пути RAS – RAF – MEK – EPK. BRAF – это человеческий ген, ответственный за производство белка B-Raf, участвующий в передаче сигналов о прямом росте клеток [4]. Ген BRAF расположен на длинном плече 7-й хромосомы и состоит из 18 экзонов. Передача сигналов MAPK включает активацию RAS ГТФазы, которая позволяет RAS связывать и активизировать RAF сложной последовательностью событий. Сигнальный каскад завершается фосфорилированием MEK и активированием ERK1 и ERK2 MAPKs, которые затем перемещаются к ядру и регулируют транскрипционные факторы. Частота мутаций в гене BRAF при МК, по данным разных авторов, колеблется от 30–40 до 70%. Наиболее распространенной (69–94% случаев) разновидностью BRAF-мутаций является V600E – замена валина глутамином в 600-м кодоне. Эта мутация считается наиболее распространенной. Мутация V600К встречается в 5–10% случаев. Мутации V600D и V600R выявляются крайне редко [5].
Мутация BRAF у пациентов с МК ассоциируется с неблагоприятным прогнозом. У таких пациентов заболевание характеризуется более агрессивным течением, чем у BRAF-негативных пациентов. Следует также отметить более молодой возраст пациентов, более высокий риск метастазирования в центральной нервной системе при наличии BRAF-мутации [6, 7].
Важным механизмом развития МК является сигнал МЕК. Путь RAS – RAF – MEK – EPK активируется широким спектром ростовых факторов и цитокинов, действующих через рецепторы тирозинкиназ. МЕК 1 и 2 относятся к типичным протеинам подсемейства МЕК [8]. Несмотря на то что мутации МЕК 1/2 обнаруживают редко, постоянно активный МЕК выявляется более чем в 30% клеток первичной опухоли [9].
В рандомизированных клинических исследованиях селективные ингибиторы BRAF вемурафениб и дабрафениб продемонстрировали клиническую эффективность у пациентов с метастатической МК с наличием BRAF-мутации по сравнению с химиотерапией [10].
Результаты последних исследований показали, что двойное ингибирование сигнального пути MAPK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, характеризуется более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме.
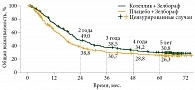
В исследовании BRIM7 применение комбинации кобиметиниба и вемурафениба предупреждало развитие резистентности опухоли к монотерапии BRAF-ингибиторами и обеспечивало длительный контроль заболевания [11, 12]. На фоне комбинированной терапии кобиметинибом и вемурафенибом отмечались улучшение общей выживаемости (ОВ) и выраженная противоопухолевая активность у BRAF-положительных пациентов без предшествующего применения ингибиторов BRAF (рис. 1).
Использование комбинации «кобиметиниб и вемурафениб» позволяет достигать длительного контроля заболевания и значительного увеличения ОВ (рис. 2). Медиана ОВ в группе комбинации кобиметиниба и вемурафениба составила 22,5 месяца, в группе вемурафениба в монорежиме – 17,4 месяца [13].
Длительное наблюдение за пациентами в исследовании 1b фазы BRIM7 показало, что у BRAF-положительных пациентов с метастатической меланомой, ранее не получавших монотерапию BRAF-ингибиторами, при старте терапии с комбинации вемурафениба и кобиметиниба показатель ОВ стабилизировался на уровне 39,2% на четвертом и пятом годах наблюдения [5]. При этом частота общего ответа (ЧОО) достигла 88%. Медиана ОВ составила 28,5 месяца по сравнению с 8,3 месяца в подгруппе пациентов, ранее получавших монотерапию BRAF-ингибиторами, выживаемость без прогрессирования (ВБП) – 13,7 и 2,8 месяца соответственно, что говорит о преимуществе комбинации на старте терапии.
В регистрационном исследовании III фазы coBrim медиана ОВ в группе комбинированной терапии составила 22,5 (20,3–28,8) месяца, четырехлетняя выживаемость – 34,2%, пятилетняя ОВ – 30,8% среди всех пациентов (n = 247), включенных в исследование [6]. Показатели ОВ были выше у пациентов с нормальным уровнем лактатдегидрогеназы (ЛДГ) (n = 131): медиана ОВ достигла 38,5 месяца по сравнению с 14,8 месяца у пациентов с повышенным уровнем ЛДГ (n = 112). Пятилетняя ОВ составила 43 и 16% соответственно. При этом ЧОО достигла 70% при полном ответе у 21% пациентов.
Показатель пяти- и четырехлетней ВБП составил 17 и 14% среди всех пациентов, включенных в исследование. Показатели ВБП были выше у пациентов с нормальным уровнем ЛДГ (n = 131): медиана ВБП составила 15,0 месяца по сравнению с 8,6 месяца у пациентов с повышенным уровнем ЛДГ (n = 112), пятилетняя ВБП – 18 и 7% соответственно.
Таким образом, комбинированная терапия «Зелбораф (вемурафениб) + Котеллик (кобиметиниб)» позволяет добиться быстрого ответа на терапию у пациентов с высокой скоростью прогрессирования заболевания, обеспечивает контроль заболевания почти у 90% пациентов (по данным исследования coBRIM), улучшает ВБП и ОВ у пациентов с метастатической МК.
Клинический случай
В 2006 г. в возрасте 48 лет пациентка получила комплексное лечение по поводу рака молочной железы. 2 февраля 2006 г. выполнена радикальная мастэктомия по Маддену слева. Гистология: низкодифференцированная аденокарцинома. В четырех лимфатических узлах выявлены метастазы аденокарциномы. Установлен диагноз рака левой молочной железы T3N1M0, стадия IIIA. Проведен курс адъювантной химиотерапии в режиме CAF, впоследствии лучевая терапия – суммарная очаговая доза (СОД) 50 Гр на послеоперационный рубец, СОД 36–44 Гр на пути лимфооттока. Для достижения овариальной супрессии использован лучевой метод – СОД 12 Гр на яичники. В течение двух лет пациентка получала адъювантную гормонотерапию ингибиторами ароматазы. В настоящее время данных о рецидиве и прогрессировании заболевания нет, отмечается стойкая ремиссия.
25 июня 2014 г. в возрасте 56 лет пациентке проведено иссечение пигментной опухоли кожи передней брюшной стенки: морфологически – внутридермальный невус, диагноз меланомы не установлен. Пациентка находилась под наблюдением по месту жительства, но в начале 2016 г. обнаружила увеличенный паховый лимфоузел справа.
19 февраля 2016 г. выполнено иссечение пахового лимфоузла слева, морфологически – метастаз беспигментной меланомы. Микропрепараты после иссечения невуса кожи передней брюшной стенки пересмотрены, диагноз верифицирован: пигментная меланома на фоне внутридермального невуса, толщина опухоли по Бреслоу более 3,0 мм, 4-й уровень инвазии по Кларку. Установлен диагноз: меланома кожи передней брюшной стенки рT3bN1bM0, стадия II.
Данные позитронно-эмиссионной и компьютерной томографии (ПЭТ-КТ) от 10 марта 2016 г.: генерализации заболевания не выявлено. Пациентке проведен курс лучевой терапии на паховые лимфоузлы справа СОД 50 Гр с учетом ранее нерадикальной операции. С апреля 2016 г. по июнь 2017 г. проводилась терапия интерфероном (ИФН) альфа-2b 5 млн МЕ три раза в неделю, подкожно.
С 2017 г. отмечалось прогрессирование заболевания – рост метастатической опухоли в мягких тканях брюшной стенки.
18 августа 2017 г. выполнено иссечение метастатической опухоли в подкожной жировой клетчатке передней брюшной стенки. Морфологически – метастаз пигментной меланомы в подкожной жировой клетчатке.
С сентября 2017 г. по январь 2018 г. проводилась терапия дакарбазином и ИФН альфа-2b. На фоне проводимой терапии зарегистрировано прогрессирование заболевания – метастаз в мягких тканях по задней поверхности левого плеча.
7 марта 2018 г. экстирпация опухоли мягких тканей левого плеча. Морфологически – метастаз меланомы.
С марта по сентябрь 2018 г. проводилась терапия ИФН альфа-2b 6 млн МЕ три раза в неделю, подкожно. На фоне лечения зафиксировано очередное прогрессирование – метастаз в области послеоперационного рубца, в мягких тканях по задней поверхности левого плеча.
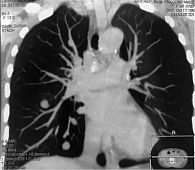
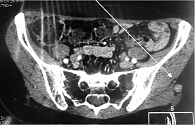
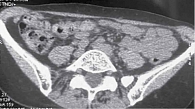
6 сентября 2018 г. выполнено широкое иссечение метастатической опухоли мягких тканей левого плеча. Проведена КТ органов грудной клетки, брюшной полости и малого таза. Генерализация заболевания: множественные метастазы в легких, медиастинальных лимфоузлах, левом надпочечнике, по брюшине в левой подвздошной области, подкожно-жировой клетчатке грудной клетки и левой ягодичной области, в надключичных лимфоузлах справа (рис. 3 и 4). Проведено молекулярно-генетическое исследование, выявлено наличие мутации гена BRAF V600E (с.1299Т>А) (NM_004333).
На момент начала комбинированной терапии вемурафенибом и кобиметинибом в сентябре 2018 г. возраст пациентки составлял 61 год. Диагноз: первично множественный метахронный рак левой молочной железы T3N1M0, стадия IIIA, гр. III. Ремиссия. Меланома кожи передней брюшной стенки T3bN1M1, стадия II, кл. гр. IV, метастазы в паховом лимфоузле справа, мягких тканях левого плеча, легких, медиастинальных лимфоузлах, левом надпочечнике, по брюшине в левой подвздошной области, подкожно-жировой клетчатке грудной клетки и левой ягодичной области, надключичных лимфоузлах справа.
Сопутствующие заболевания: гипертоническая болезнь 2-й степени, риск сердечно-сосудистых осложнений 3. Хронический панкреатит, ремиссия. Хронический гастрит, ремиссия. Мочекаменная болезнь. Хронический пиелонефрит, стадия ремиссии. Лимфостаз левой верхней конечности 2-й степени с 2006 г.
Статус по ECOG – 1 балл, жалобы на слабость 1–2-й степени, уровень ЛДГ 155 ЕД/л, снижение трудоспособности. Сумма таргетных очагов 93 мм.
В сентябре 2018 г. пациентка начала комбинированную терапию вемурафенибом 1920 мг/сут (960 мг (четыре таблетки по 240 мг) два раза в сутки) и кобиметинибом 60 мг/сут (три таблетки по 20 мг).
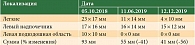
На контрольных обследованиях (декабрь 2019 г.) сумма таргетных очагов последовательно уменьшилась до 55 и 41 мм. Зарегистрирован частичный ответ, который сохраняется до настоящего времени (таблица).
Общий статус пациентки с некоторой положительной динамикой, сохраняются жалобы на слабость 1-й степени, ECOG – 1 балл, трудоспособность восстановлена полностью. Уровень ЛДГ на фоне проводимой терапии остается в пределах нормы.
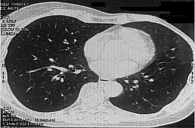
Данные контрольной КТ в июле 2020 г.: сумма измеримых очагов 23 мм. Уменьшение от исходного – 75%. Новых очагов нет. Сохраняется частичный ответ (рис. 5 и 6).
Из нежелательных явлений в течение первых двух курсов терапии отмечались кожная токсичность 2-й степени, артралгия 2-й степени, головная боль 1-й степени, эпизоды диареи 1-й степени. Данные нежелательные явления не потребовали редукции доз и отмены препаратов, разрешились после двух месяцев терапии.
Заключение
Назначение комбинированной таргетной терапии вемурафенибом и кобиметинибом привело к стабилизации, сохраняющейся на протяжении более 22 месяцев. В настоящее время частичный ответ сохраняется, наблюдается уменьшение таргетных очагов на 75%.
Комбинированная терапия продемонстрировала удовлетворительный профиль переносимости у пациентки с коморбидной патологией и двумя злокачественными новообразованиями самостоятельных (первичных) множественных локализаций.
Нежелательные явления, связанные с терапией, были краткосрочными и не повлияли на качество жизни пациентки.
Авторы заявляют об отсутствии конфликта интересов.
K.V. Menshikov, PhD, A.V. Sultanbayev, PhD, Sh.I. Musin, PhD, K.T. Akhmetgareyeva, I.A. Menshikova, PhD
Bashkir State Medical University, Ufa
Republican Clinical Oncological Dispensary, Ufa
Contact person: Konstantin V. Menshikov, kmenshikov80@bk.ru
Skin melanoma (MC) is one of the most aggressive malignant tumors. Worldwide, there is an increase in the incidence of melanoma. Currently, the results of basic research have changed the understanding of the molecular and genetic mechanisms of disease development. The most studied oncogenic mutation in MK – BRAF encoding serine-threonine protein kinase, which in turn acts in the MAPK pathway RAS – RAF – MEK – ERK. BRAF mutations are associated with an unfavorable prognosis in MC. Currently targeted therapy of generalized MC is recognized as one of the most effective methods of treatment. Double inhibition of the MARK signaling pathway, which is achieved by simultaneous use of BRAF and MEK inhibitors, is characterized by higher efficiency compared to the BRAF inhibitor in the single mode. The article presents a clinical case of treatment of generalized MC. The patient was repeatedly operated on for metastatic MC. The disease progressed four times on the background of treatment with dacarbazine and interferon. The activating mutation in the EXON of the BRAF gene type V600E was found. After the disease progressed, the patient received combination therapy with cobimetinib and vemurafenib. A partial response has been kept for more than 22 months.
This clinical case demonstrates the possibilities of targeted therapy of generalized melanoma.

