Молекулярно-генетический анализ в стратификации риска рака щитовидной железы
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включено 112 пациентов, прооперированных по поводу узловой патологии щитовидной железы. У всех больных определяли уровень экспрессии 12 miRNA методом реакции обратной транскрипции с последующей полимеразной цепной реакцией в режиме реального времени, а также мутацию BRAFV600E и экспрессию гена HMGA2.
Результаты. Точечная мутация BRAFV600E обнаружена в 68% случаев папиллярного рака и не встречалась при фолликулярном и медуллярном раке щитовидной железы, а также при доброкачественных образованиях, таким образом, ее можно считать специфическим диагностическим маркером папиллярного рака щитовидной железы. Мутацию V600E в гене нельзя признать надежным прогностическим маркером, так как не установлена зависимость с агрессивными характеристиками опухоли.
По результатам нашего исследования, рак щитовидной железы ассоциировался с повышением уровня экспрессии онкогенных miR146, miR221, miR155, miR375, miR31, miR551 и снижением экспрессии онкосупрессорных miR7 и miR145. Были определены онкогенные и онкосупрессорные miRNA для разных гистологических вариантов рака щитовидной железы. При папиллярном раке выявлено повышение экспрессии онкогенов miR31, miR155, miR551 и miR146, фолликулярном – miR183, медуллярном – miR7 и miR375.
Вывод. В клинической практике возможно применение профилей экспрессии miRNA для дифференциальной диагностики доброкачественных и злокачественных образований щитовидной железы.
Материал и методы. В исследование включено 112 пациентов, прооперированных по поводу узловой патологии щитовидной железы. У всех больных определяли уровень экспрессии 12 miRNA методом реакции обратной транскрипции с последующей полимеразной цепной реакцией в режиме реального времени, а также мутацию BRAFV600E и экспрессию гена HMGA2.
Результаты. Точечная мутация BRAFV600E обнаружена в 68% случаев папиллярного рака и не встречалась при фолликулярном и медуллярном раке щитовидной железы, а также при доброкачественных образованиях, таким образом, ее можно считать специфическим диагностическим маркером папиллярного рака щитовидной железы. Мутацию V600E в гене нельзя признать надежным прогностическим маркером, так как не установлена зависимость с агрессивными характеристиками опухоли.
По результатам нашего исследования, рак щитовидной железы ассоциировался с повышением уровня экспрессии онкогенных miR146, miR221, miR155, miR375, miR31, miR551 и снижением экспрессии онкосупрессорных miR7 и miR145. Были определены онкогенные и онкосупрессорные miRNA для разных гистологических вариантов рака щитовидной железы. При папиллярном раке выявлено повышение экспрессии онкогенов miR31, miR155, miR551 и miR146, фолликулярном – miR183, медуллярном – miR7 и miR375.
Вывод. В клинической практике возможно применение профилей экспрессии miRNA для дифференциальной диагностики доброкачественных и злокачественных образований щитовидной железы.
В последние годы одной из актуальных диагностических проблем в области эндокринологии является определение характера узлов щитовидной железы (ЩЖ) на дооперационном этапе. Согласно данным, при пальпации узловые образования в ЩЖ выявляются лишь у 5–7% взрослого населения [1]. Золотым стандартом предоперационной диагностики узловых образований ЩЖ на сегодняшний день остается тонкоигольная аспирационная биопсия, однако в 20% случаев она не позволяет получить точный цитологический диагноз. Большинство таких пациентов подвергаются хирургическому вмешательству, при этом менее 20% узлов оказываются злокачественными [2]. Именно поэтому продолжается поиск новых дополнительных диагностических маркеров, а также маркеров агрессивности течения рака щитовидной железы (РЩЖ). Одним из перспективных направлений считается исследование уровня экспрессии miRNA. Однако следует отметить, что вопрос о возможности определения профилей экспрессии miRNA для повышения точности диагностики РЩЖ все еще остается открытым. В последние годы опубликованы как положительные [3–6], так и негативные результаты [5] исследований в отношении этой проблемы.
МикроРНК представляют собой малые (19–25 нуклеотидов), некодирующие молекулы РНК, которые обычно функционируют как отрицательные регуляторы экспрессии генов, кодирующих белок [7]. Установлено, что miRNA участвует в развитии нескольких типов опухолей в основном за счет аномальных уровней экспрессии зрелых транскриптов miRNA по сравнению с соответствующими незатронутыми тканями [8]. Показано, что как стимуляция онкогенных miRNA (например, miR155, miR21), так и подавление функционирующих как супрессоры опухолевого роста miRNA (например, miR15a, miR16) способствуют развитию опухолевого процесса [9–12]. H. He и соавт. в 2005 г. получили предварительные доказательства потенциальной роли miRNA при папиллярном раке щитовидной железы (ПРЩЖ) [13]. Исследователи отметили сверхэкспрессию нескольких miRNA в опухолевой ткани по сравнению со здоровой тканью ЩЖ. В список активирующих (до 19,3 раза) miRNA вошли miR146, miR221/222, miR155, miR34 и miR181. Вскоре эти данные были подтверждены в других работах [14]. Исследователи пришли к выводу, что в патогенезе ПРЩЖ участвуют повышенная регуляция нескольких miRNA, измененное ингибирование их мишеней, а также изменение последовательности генов, направленных на miRNA, могут способствовать их регуляции [13, 14]. Различные miRNA дерегулируются при фолликулярном раке ЩЖ (ФРЩЖ) и анапластической карциноме [15, 16]. Это доказывает, что каждый тип РЩЖ имеет специфические признаки экспрессии определенных miRNA.
В ретроспективном исследовании C.K. Chou и соавт. в 2010 г. было показано, что некоторые miRNA (miR-221/222 и miR-146b) связаны с клинически агрессивными видами ПРЩЖ [17]. Однако остается актуальным проведение более крупного проспективного клинического исследования.
Целью нашего исследования стал сравнительный анализ гистологических образцов в группе доброкачественных и злокачественных образований щитовидной железы с помощью молекулярно-генетического тестирования (определение мутации BRAFV660E, экспрессии гена HMGA2, микроРНК (miR, miRNA)) для выявления возможной корреляции данных маркеров с неблагоприятным онкологическим прогнозом.
Материал и методы
В ретроспективное исследование типа «случай – контроль» включены 112 пациентов, прооперированных с подозрением на РЩЖ (цитологическое заключение Bethesda III–VI) в 2018 г. на базе отделения онкологической хирургии № 1 Университетской клинической больницы № 1 Сеченовского Университета.
Всем пациентам проводилось дооперационное цитологическое исследование с интерпретацией результатов по системе Bethesda (2009 г.), ультразвуковое исследование ЩЖ, устанавливался тиреоидный статус. Результаты цитологического исследования, а также клинико-лабораторные данные были сопоставлены с данными гистологического исследования. В качестве прогностических ультразвуковых признаков оценены наличие/отсутствие кальцинатов, неровность/нечеткость контура, гипоэхогенность узлового образования. Окончательный диагноз установлен на основании гистологического заключения. Все образцы цитологического и гистологического исследования верифицированы одним специалистом. РЩЖ классифицирован клинически по системе TNM (Американский объединенный комитет по раку (AJCC), 8-е изд., 2017 г.). По результатам послеоперационного гистологического исследования пациентов разделили на две группы. В первую группу вошли лица со злокачественными образованиями ЩЖ (n = 54), во вторую – с доброкачественными образованиями ЩЖ (n = 58). Из 58 больных у 30 диагностирована фолликулярная аденома, у 28 – коллоидный зоб.
В рамках нашего исследования к признакам агрессивного течения опухоли относили мультицентричность, инвазию в капсулу узла и капсулу щитовидной железы, инвазию в лимфатические сосуды, наличие регионарных или отдаленных метастазов. Отдельно оценивали все известные случаи рецидива – 13% (n = 7).
В ходе дальнейшего исследования на базе Института молекулярной и клеточной биологии Сибирского отделения Российской академии наук для всех типов опухолей и образований проведено молекулярно-генетическое тестирование. Из материала гистологических препаратов выделены образцы ДНК и РНК и проанализированы уровни экспрессии гена HMGA2, 12 miRNA (miR144, miR145, miR146, miR155, miR183, miR199, miR221, miR31, miR551, miR375, miR451, miR7) методом реакции обратной транскрипции с последующей полимеразной цепной реакцией в режиме реального времени (ОТ-ПЦР-РВ). Мутация BRAFV600E с помощью аллель-специфичной ПЦР с гидролизуемым зондом [18].
Уровень относительной экспрессии miRNA рассчитывали с помощью метода 2-ΔCq. Повышенным или пониженным уровнем miRNA в исследуемом образце считали изменение уровня в пять раз или более относительно нормального (контрольного образца) в большую или меньшую сторону.
Исследование проводилось с соблюдением принципов добровольности и конфиденциальности в соответствии с Основами законодательства РФ об охране здоровья граждан (указ Президента РФ от 24.12.1993 № 2288). Проведение исследования было одобрено локальным комитетом по этике Первого МГМУ имени И.М. Сеченова (регистрационный номер 02-17).
Статистическую обработку результатов проводили с использованием методов параметрического и непараметрического анализа с использованием пакета программ IBM SPSS Statistics 23. Исследованные количественные показатели представляли в виде медианы (Ме). Для сопоставления групп по количественным признакам применяли непараметрические методы: U-критерий Манна – Уитни, критерий Краскала – Уоллиса. Для сравнения частот использовали χ2 и точный критерий Фишера. Оптимальные уровни показателей чувствительности и специфичности определяли методом наибольшей суммы. Различие между группами считали статистически достоверным при р < 0,05.
Результаты исследования и их обсуждение
На дооперационном этапе неопределенный цитологический диагноз (Bethesda III и IV) имели 40,7% пациентов, Bethesda V – 25,9%. По результатам гистологического исследования в первой группе выявлено 47 случаев ПРЩЖ, три случая ФРЩЖ, два – медуллярного РЩЖ (МРЩЖ) и два случая анапластического РЩЖ (АРЩЖ). Средний возраст пациентов составил 51,3 [19–79] года. В данной группе статистически значимо преобладали женщины – 85,15%. Средний объем ЩЖ составил 33,0 [6,1–156,0] мл. Большинство (68,5%) пациентов имели узлы более 1 см. В трети случаев это были микрокарциномы.
Выбор объема операции был обусловлен результатами цитологического исследования, наличием или отсутствием признаков метастатического поражения регионарных лимфоузлов, а также размерами и количеством узлов. В 70,3% случаев оперативное лечение выполнено в объеме тиреоидэктомии, в том числе в 42,6% с лимфодиссекцией, в 29,6% случаев – гемитиреоидэктомии. В первой группе с помощью TNM установлено, что большинство пациентов имели РЩЖ на стадии Т1 (n = 28) или Т2 (n = 4). У оставшихся пациентов (n = 22) диагностированы стадии Т3 и Т4. Гистологически агрессивные характеристики имели 50,7% опухолей. У семи (13,7%) пациентов обнаружена инвазия в капсулу узла, у троих (5,8%) – инвазия в лимфатические сосуды, у восьми (15,6%) отмечалась мультицентричность. Еще у восьми (15,6%) опухоль прорастала в капсулу ЩЖ. Метастатическое поражение регионарных лимфоузлов отмечалось у 20 (38,9%) пациентов. У 34 (61,1%) больных не было выявлено данных о метастатическом процессе. Отдаленные метастазы обнаружены у пациента с АРЩЖ.
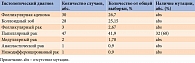
Нами проведен молекулярно-генетический анализ 112 образцов послеоперационного гистологического исследования на наличие мутации BRAFV600E, а также корреляционный анализ BRAFV600E с морфологическими характеристиками опухоли и клинико-анамнестическими данными пациентов (табл. 1).
Мутация BRAFV600E в 68% случаев определялась лишь в группе с гистологическим диагнозом «папиллярная карцинома». При других гистологических вариантах РЩЖ таковая не выявлена.
Достоверной связи между метастатическим поражением лимфоузлов, а также гистологическими агрессивными характеристиками опухоли и статусом BRAFV600E в нашем исследовании не установлено.
Анализ зависимости BRAF-положительного статуса от пола пациентов показал, что таковая присутствовала у семи (87,5%) из восьми мужчин, у 25 (78,1%) из 32 женщин (р < 0,05). Данных о связи BRAF-положительных опухолей с возрастом пациентов в ходе исследования не получено.
BRAF-положительный статус определялся в 80% случаев при микрокарциномах и в 52,6% – при опухолях более 1 см. У шести (50%) из 12 пациентов с микрокарциномами имела место инвазия в капсулу узла ЩЖ, у пяти (41,6%) опухоль не выходила за пределы капсулы, у трех (25%) – мультицентричное распространение опухоли, инвазия в капсулу ЩЖ – у двух (16,6%) пациентов, у одного (8,3%) зафиксированы метастазы в регионарные лимфоузлы и лишь у одного (8,3%) больного – инвазия в лимфатические сосуды.
Таким образом, полученные данные еще раз подтверждают, что размер узлового образования не всегда коррелирует со степенью агрессивности РЩЖ и только по размеру узлового образования невозможно принимать решение об объеме оперативного вмешательства.
Результаты по частоте выявления BRAFV660E-мутации при ПРЩЖ соответствуют данным других исследователей. Так, в исследовании М.А. Быкова, проведенном в 2015 г., частота определения BRAF600E-мутации при ПРЩЖ составила 59,4% [19]. Автором также была показана достоверная связь данной мутации с агрессивными характеристиками опухоли. Однако это не соответствует нашим результатам. В других исследованиях также получены противоречивые данные о корреляции BRAF-мутации с агрессивными характеристиками опухоли [20, 21].
В исследуемых образцах первой группы проведен сравнительный анализ экспрессии 12 микроРНК, а также ультразвуковых и клинических характеристик узловых образований. При опухолях с таким ультразвуковым признаком, как нечеткость/неровность контуров, с достоверно большей частотой определялась экспрессия гена HMGA2 (р = 0,01) и повышенная экспрессия miR31 (p = 0,02). Гипоэхогенная структура была связана с пониженной экспрессией miR144 (p = 0,01) и miR155 (p = 0,006). В случае метастатического поражения регионарных лимфатических узлов с высокой достоверностью отмечалась пониженная экспрессия miR7 (р = 0,0001) по сравнении с опухолями без экстратиреоидного распространения. В случае рецидивирующего течения также определяли пониженную экспрессию miR7 (р = 0,003).
HMGA2 выявляли достоверно с более высокой частотой у мужчин (р = 0,008), экспрессия трех miRNA, miR146, miR221 и miR551 у них также была выше (р = 0,001, р = 0,03, р = 0,02). Корреляция с возрастом прослеживалась в отношении экспрессии miR221 и miR451. У пациентов 45 лет и старше отмечалась повышенная экспрессия miR221 (р = 0,035) и достоверно сниженная – miR451 (р = 0,017).
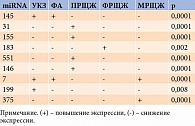
При распределении образцов по гистологическим вариантам в нашем исследовании были определены онкогенные и онкосупрессорные miRNA для каждого из гистологических диагнозов. Нами установлены онкогены ПРЩЖ – miR31, miR155, miR551, miR146, ФРЩЖ – miR183, МРЩЖ – miR7 и miR375. В случае узлового коллоидного зоба (УКЗ) с высокой достоверностью отмечалась повышенная экспрессия онкосупрессорных miR199, miR145 и miR7, фолликулярной аденомы (ФА) – повышенный уровень экспрессии miR145 и miR7 (табл. 2). Расчет осуществляли с использованием теста Манна – Уитни. Уровень статистической значимости различий между группами составил менее 0,05.
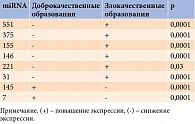
По результатам сравнительного анализа в группе злокачественных образований выявлены статистически значимые различия по уровню экспрессии онкогенных miR146, miR221, miR155, miR375, miR31, miR551 и онкосупрессорных miR7 и miR145 (p = 0,0001) по сравнению с группой доброкачественных образований ЩЖ (табл. 3). При расчете использовали тест Манна – Уитни. Уровень статистической значимости различий между группами составил менее 0,05.
Вывод
Проведенное нами исследование позволило оценить возможность использования молекулярно-генетических маркеров в дифференциальной диагностике доброкачественных и злокачественных образований ЩЖ. Исследованные нами маркеры применимы также для цитологического материала, полученного методом тонкоигольной аспирационной биопсии, и могут применяться в клинической практике. Совершенствование методов дооперационной диагностики РЩЖ должно способствовать выбору оптимального объема оперативного лечения, уменьшению количества диагностических и повторных операций.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении данной публикации.
Финансирование
Авторы заявляют об отсутствии финансовой поддержки в отношении данной публикации.
M.O. Rogova, N.S. Martirosian, PhD, L.V. Trukhina, PhD, N.B. Paramonova, PhD, L.I. Ippolitov, PhD, M.E. Telnova, PhD, N.A. Petunina, MD, PhD, Prof., S.Ye. Titov, PhD, Yu.A. Veryaskina, PhD
I.M. Sechenov First Moscow State Medical University
Institute of Molecular and Cell Biology of RAS Siberian Branch
Vector-Best, JSC
Novosibirsk State University
Institute of Citology and Genetics of RAS Siberian Branch
Contact person: Marina O. Rogova, aniram12med@yandex.ru
Summary: to conduct a comparative analysis of histological samples in the group of benign and malignant thyroid formations using molecular genetic testing: determination of the BRAFV600E mutation, expression of the HMGA2 gene, microRNA (miR, miRNA). To identify possible correlation of these markers with an unfavorable cancer prognosis.
Material and methods. The study included 112 patients who underwent surgery for nodular pathology of the thyroid gland. In all patients, the level of 12 miRNA expression was determined by reverse transcription reaction followed by real-time polymerase chain reaction, as well as the presence of BRAFV600E mutation and HMGA2 gene expression.
Results. The BRAFV600E mutation can be considered a specific diagnostic marker for papillary thyroid cancer. According to the results of our study, the BRAFV600E mutation was not found in patients with follicular and medullary thyroid cancer, as well as in individuals with benign thyroid formations. The BRAF mutation is not a reliable prognostic marker, since the relationship with aggressive tumor characteristics has not been proved. The model obtained in our study based on the determination of miR7m2 and 451am2 expression levels showed moderate prognostic value. The diagnostic value of our model based on determining the expression level of miR146bm3, 221m2, 375m4, 7m2 was high. Therefore, determining the level of expression of oncogenic miR31, -146b, -155, -357, -551b can be recommended as a differential diagnosis of benign and malignant thyroid formations.
Conclusion. In clinical practice, miRNA expression profiles can be used for differential diagnosis of benign and malignant thyroid formations.

