Можно ли замедлить прогрессирование ХОБЛ с помощью терапии длительно действующими бронходилататорами?
- Аннотация
- Статья
- Ссылки
![Рис. 1. Течение ХОБЛ: типичная эволюция функциональных показателей [6]](/upload/resize_cache/iblock/3f2/195_350_1/spiriva1.jpg)

![Рис. 3. Устойчивое улучшение функции легких и замедление прогрессирования заболевания при терапии тиотропием больных ХОБЛ стадии GOLD II [26].](/upload/resize_cache/iblock/6a2/195_350_1/spiriva4.jpg)
![Рис. 4. Устойчивое улучшение функции легких и замедление прогрессирования заболевания при терапии тиотропием у «наивных» (нелеченных ранее) больных ХОБЛ [29]](/upload/resize_cache/iblock/167/195_350_1/spiriva5.jpg)
![Рис. 5. Устойчивое улучшение функции легких и замедление прогрессирования заболеванияпри терапии тиотропием у «наивных» (нелеченных ранее) больных ХОБЛ [30]](/upload/resize_cache/iblock/678/195_350_1/spiriva6.jpg)
Введение
Согласно рекомендациям Американского торакального общества и Европейского респираторного общества, хроническая обструктивная болезнь легких (ХОБЛ) определяется как «заболевание, которое можно предупредить и лечить; характеризуется не полностью обратимой бронхиальной обструкцией. Ограничение воздушного потока обычно прогрессирует и связано с абнормальным воспалительным ответом дыхательных путей на повреждающие частицы или газы, причем основной причиной является курение. Хотя ХОБЛ поражает легкие, она также приводит к значимым системным проявлениям» [1].
По данным ряда исследований, распространенность ХОБЛ в мире у людей старше 40 лет составляет 10,1% (11,8% у мужчин и 8,5% у женщин) [2]. ХОБЛ является причиной значительной части визитов к врачу, обращений в отделение неотложной помощи и госпитализаций. ХОБЛ является единственной болезнью, при которой смертность продолжает увеличиваться [3].
Последние исследования, посвященные изучению патофизиологии и новым методам терапии ХОБЛ, показали, что течение ХОБЛ можно значительно улучшить. Поэтому отношение к ХОБЛ в последнее время сместилось от «необоснованного нигилизма к научно-обоснованному оптимизму» [4].
Относительно недавно в контексте ХОБЛ появилось новое понятие – «модификация заболевания», которое отражает улучшение клинического течения заболевания. Модификация ХОБЛ рассматривается как улучшение исходов заболевания, важных для больного, т.е. симптомов заболевания и качества жизни больного, или замедление скорости снижения функциональных легочных показателей, а также снижение числа обострений у больных и летальности [5].
Прогрессирование обструктивных заболеваний легких обычно оценивается по скорости снижения показателя объема форсированного выдоха за 1 с (ОФВ1), у здоровых он равен около 25–30 мл/год, а у больных ХОБЛ – 40–80 мл/год (рис. 1) [6]. Для оценки скорости прогрессирования заболевания необходимо исследование большого количества больных (обычно более 100 человек) в течение довольно продолжительного срока (несколько лет) [7].
Относительно недавно было опубликовано исследование, посвященное оценке изменений функциональных показателей с течением времени у здоровых людей и у курильщиков – потомков участников знаменитого Фремингемского исследования [8]. Уникальными особенностями данного анализа явились его длительность – 23 года, большой объем наблюдения (n=4391), включение в анализ и мужчин, и женщин, а также лиц широкого возрастного диапазона (от 13 лет до 71 года). Основные заключения данной работы следующие:
- нормальная скорость снижения ОФВ1 у взрослых людей составляет ~ 20 мл/год;
- курение негативно влияет на скорость снижения ОФВ1 и у мужчин, и у женщин;
- отказ от курения оказывает наибольший положительный эффект на более ранних этапах функциональных нарушений.
Современная терапия ХОБЛ
Спектр лекарственных средств (ЛС), которые в настоящее время рекомендованы для длительной поддерживающей терапии ХОБЛ, относительно невелик: коротко- и длительно действующие бронходилататоры, ингаляционные глюкокортикостероиды (ИГКС), комбинированные препараты (ИГКС / длительно действующие β2-агонисты), антиоксиданты (N-ацетилцистеин) и вакцины [9]. Особое место среди ЛС, использующихся для терапии стабильного периода ХОБЛ, занимают бронходилататоры.
К числу наиболее эффективных бронходилататоров для терапии ХОБЛ относится антихолинергический препарат длительного действия – тиотропия бромид. Достоинствами тиотропия являются его селективность по отношению к М1- и М3-рецепторам и длительный период действия [10]. Препарат обеспечивает бронходилатацию и протекцию против холинергических бронхоконстрикторных стимулов в течение 24 ч, что делает возможным назначение его 1 раз в сут. Такие свойства препарата значительно упрощают режим дозирования и улучшают комплаенс больных к терапии. Прирост функциональных легочных показателей у больных ХОБЛ на фоне терапии тиотропием во всех исследованиях превышал таковой у пациентов, получавших препараты сравнения, и данное улучшение поддерживалось на протяжении всего периода исследования без развития тахифилаксии [11]. Тиотропий оказался первым препаратом, у которого положительное влияние на легочную гиперинфляцию было подтверждено в рандомизированных контролируемых исследованиях (РКИ) [12].
До настоящего времени ни одно лекарственное средство, включая иГКС, короткодействующие бронхолитики, N-ацетилцистеин, не показало способность замедлить скорость снижения ОФВ1 [13–17].
Долгое время единственным фактором, способным приостановить прогрессирование ХОБЛ, является ранний отказ от курения [18]. Ретроспективный анализ одногодичных плацебо-контролируемых исследований показал, что длительная поддерживающая терапия антихолинергическим препаратом длительного действия тиотропием может замедлить прогрессирование ХОБЛ [19]. Изучению влияния длительной поддерживающей терапии тиотропием на клиническое течение ХОБЛ (ежегодное снижение функциональных показателей, качество жизни, частота обострений и летальность больных) было посвящено глобальное исследование UPLIFT [20].
Исследование UPLIFT
Исследование UPLIFT (Understanding Potential Long-term impacts on Function with Tiotropium – понимание потенциального долговременного воздействия на функцию тиотропия) – крупнейшее на сегодня исследование, посвященное эффективности медикаментозной терапии у больных ХОБЛ [20]. Исследование имело рандомизированный контролируемый двойной слепой дизайн, продолжалось 4 года, в нем участвовали 490 исследовательских центров из 37 стран мира и, в общей сложности, в него было включено 5993 больных ХОБЛ. Первичной конечной точкой исследования UPLIFT являлась оценка влияния длительной поддерживающей терапии тиотропием на показатель ежегодного снижения ОФВ1, вторичными конечными точками – влияние терапии на параметры качества жизни, на частоту обострений и летальность больных ХОБЛ [7].
В исследование включались больные ХОБЛ старше 40 лет с анамнезом курения более 10 пачек/лет, при условии объема форсированного выдоха за 1 с (ОФВ1) ≤ 70% (после пробы с бронхолитиками) и ОФВ1/форсированной жизненной емкости легких (ФЖЕЛ) ≤ 70%. Все больные были рандомизированы в две группы – прием тиотропия (Спирива, Boehringer Ingelheim) 18 мкг 1 раз в сут (2986 больных) или плацебо (3006 больных). Дизайн исследования был максимально приближен к условиям реальной жизни, т.е. больным, принимающим участие в исследовании, разрешался прием любых препаратов (включая иГКС, длительно действующие β2-агонисты (ДДБА) и теофиллины), за исключением антихолинергических препаратов (АХП). Всем больным проводилась спирометрия до начала исследования, через 1 мес и далее каждые 6 мес до конца исследования и через 30 дней после окончания исследования.
Средний возраст больных, включенных в исследование, составлял 65±8 лет, большинство больных – мужчины (75%), и 30% пациентов продолжали курить. Средний ОФВ1 до приема бронхолитиков составлял 1,10±0,40 л (39% от нормы), после приема бронхолитиков – 1,32±0,42 л (48% от нормы), таким образом средний прирост ОФВ1 в пробе с бронхолитиками составил 23±18%. Согласно классификации GOLD, больные ХОБЛ распределялись следующим образом: стадия II – 46%, стадия III – 44%, стадия IV – 9%. Во время исследования 74% больных ХОБЛ принимали ИГКС, 72% – ДДБА и 46% – фиксированные комбинации ИГКС/ДДБА.
Исследование UPLIFT продемонстрировало, что длительная поддерживающая терапия тиотропием у больных ХОБЛ приводит к стойкому улучшению функциональных легочных показателей и качества жизни больных; уменьшению риска развития обострений заболевания, летальности больных, числа сердечно-сосудистых нежелательных реакций и нежелательных реакций со стороны нижних дыхательных путей.
Проведенное исследование не выявило различий по скорости ежегодного снижения показателя ОФВ1 между группами тиотропия и плацебо (до приема бронхолитиков: 30±1 vs 30±1 мл/год, соответственно, р=0,95; после приема бронхолитиков: 40±1 vs 42±1 мл/год, соответственно, р=0,21). Также не было отмечено различий и по скорости ежегодного снижения показателя ФЖЕЛ (до приема бронхолитиков: 43±3 vs 39±3 мл/год, соответственно, р=0,30; после приема бронхолитиков: 61±3 vs 61±3 мл/год, соответственно, р=0,84). Однако функциональные легочные показатели на протяжении всего исследования были значительно лучше у больных, принимавших тиотропий: среднее различие по ОФВ1 между группами составляло до приема бронхолитиков от 87 до 103 мл, после приема бронхолитиков – от 47 до 65 мл (р<0,001) (рис. 2).
Как уже подчеркивалось, прогрессирование ХОБЛ, обычно оцениваемое по скорости ежегодного снижения функциональных показателей, является важнейшей характеристикой течения ХОБЛ. Несмотря на то что в нескольких годичных исследованиях были получены обнадеживающие результаты о замедлении прогрессирования ХОБЛ на фоне приема тиотропия по сравнению с приемом ипратропия [21] или плацебо [19], в исследовании UPLIFT не было выявлено различий между группами по скорости изменения ОФВ1 или ФЖЕЛ. В то же время обращает на себя внимание, что ежегодное снижение постбронходилатационного показателя ОФВ1 (42 мл/год) даже в группе плацебо оказалось меньшим, чем в других известных исследованиях (47–69 мл/год) (табл. 1) [13–17].
Как можно объяснить полученные результаты? Почти «нормальные физиологические» ежегодные изменения функциональных показателей в исследовании UPLIFT можно объяснить с точки зрения дизайна исследования, приближенного к реальной жизни. В данном исследовании разрешался прием любых лекарственных препаратов (кроме АХП). В итоге около 3/4 больных ХОБЛ, участвовавших в исследовании, принимали и ИГКС, и ДДБА. Возможно, такая комплексная терапия, а также активная терапия обострений заболевания, сама по себе могла замедлить прогрессирование ХОБЛ, и добавление других препаратов (тиотропия) не привело к дальнейшему замедлению снижения ОФВ1, так как этот показатель уже не отличался от нормы, – так называемый «эффект потолка». Справедливость данного положения подтверждает субгрупповой анализ, показавший достоверные отличия между группами тиотропия и плацебо по скорости ежегодного снижения ОФВ1 у больных, которые не получали ни иГКС, ни ДДБА (40 vs 47 мл/год, р=0,046).
Кроме того, в исследовании UPLIFT доля актуальных курильщиков составляла всего 30%, что много меньше по сравнению с другими исследованиями (38–90%), и в ходе самого исследования еще 26% больных изменили свой статус курения (большинство бросили курить). Еще одним объяснением отсутствия различий между группами по скорости изменения функциональных показателей является более высокий риск выбывания из исследования больных, принимавших плацебо. Анализ данных настоящего исследования и других исследований показал, что в первую очередь выбывают больные с более быстрым ухудшением функциональных показателей, что в дальнейшем при проведении анализа всех включенных в исследование пациентов (intent-to-treat analysis) «выравнивает» обе сравниваемые группы [22, 23].
Исследование UPLIFT благодаря большому объему исследования позволило также оценить эффективность терапии тиотропием в отдельных группах больных ХОБЛ: у больных с ранними стадиями ХОБЛ, у «наивных» больных (т.е. никогда не получавших никакой терапии по поводу ХОБЛ), у больных моложе 50 лет, у курящих и некурящих, и т.д.
Влияние терапии тиотропием на прогрессирование заболевания у больных с ранними стадиями ХОБЛ
В соответствии с существующей классификацией ХОБЛ в рамках руководства GOLD (2008) к ранним стадиям ХОБЛ относят легкую и среднетяжелую стадии ХОБЛ, т.е. формально это те больные, которые имеют соотношение ОФВ1 к ФЖЕЛ менее 70% (как и все больные ХОБЛ), но при этом ОФВ1 > 50% [9].
Почему нужно лечить больных с ранними стадиями ХОБЛ? Физическая выносливость снижена у больных ХОБЛ, уже на ранних стадиях. В исследовании V.M. Pinto-Plata и соавт. анализировался эталонный показатель физической выносливости больных – VO2 (пиковое потребление кислорода) при выполнении эргометрической пробы у больных с различными стадиями течения ХОБЛ в сравнении со здоровыми лицами [24]. Было показано, что по этому показателю больные со стадией GOLD I ничем не отличались от здоровых лиц. Но уже начиная со стадии GOLD II данный показатель значительно снижен по сравнению с группой контроля (примерно на 15%). В исследовании J.F. O’Reilly и соавт. было показано, что у больных с ранними стадиями ХОБЛ довольно часто развиваются обострения, причем у некоторых из них – до 10 обострений в год, т.е. обострения заболевания – это проблема не только больных с терминальными стадиями ХОБЛ, но и больных с ранними стадиями ХОБЛ [25].
Из 5993 рандомизированных пациентов в исследование UPLIFT 2739 (46%) имели II стадию ХОБЛ по GOLD. По сравнению с пациентами в группе тиотропия больные контрольной группы чаще прекращали терапию досрочно (35 vs 31%; p=0,024). Больные со II стадией ХОБЛ на протяжении исследования использовали ДДБА (69–71%), иГКС (72–73%) и комбинации иГКС/ДДБА (61%) [26].
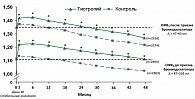
В группе тиотропия пребронходилататорный ОФВ1 снижался в среднем на 35 мл/год, в контрольной группе – на 37 мл/год (p=0,38). Для постбронходилататорного ОФВ1 скорость снижения была достоверно ниже в группе тиотропия по сравнению с контрольной группой (43 vs 49 мл/год, p=0,024) (рис. 3). Для ФЖЕЛ и медленной жизненной емкости легких (МЖЕЛ) скорость снижения пребронходилататорных значений не различалась между группами. Однако скорость снижения после бронходилатации была ниже в группе тиотропия, чем в контрольной группе (статистически недостоверное различие).
Средние значения пребронходилататорного и постбронходилататорного ОФВ1 в группе тиотропия были выше, чем в контрольной группе во всех временных точках в течение исследования, с различиями между группами в пределах от 101 до 119 мл и от 52 до 82 мл, соответственно. Средняя пребронходилататорная ФЖЕЛ была на 164–194 мл выше, а средняя пребронходилататорная МЖЕЛ на 44–75 мл выше в группе тиотропия, чем в контрольной группе (p<0,001 во всех временных точках). Различия для постбронходилататорной ФЖЕЛ и МЖЕЛ варьировались от 42 до 68 мл (p<0,01 во всех временных точках) и от 15 до 35 мл (p>0,05 во всех временных точках), соответственно.
Таким образом, данный субгрупповой анализ исследования UPLIFT показал, что у больных со II стадией ХОБЛ прием тиотропия уменьшает скорость снижения постбронходилататорного ОФВ1, т.е. замедляет прогрессирование ХОБЛ.
Влияние терапии тиотропием на прогрессирование заболевания у «наивных» больных ХОБЛ
Исследования по оценке эффективности терапии у «наивных» больных ХОБЛ, т.е. у пациентов, ранее никогда не получавших никакой терапии, безусловно, представляют большой интерес для клиницистов, так, фактически речь идет о выборе начальной терапии у больных ХОБЛ. Таких «наивных» пациентов довольно много, так как повсеместно во всем мире гиподиагностика ХОБЛ очень высока. Например, на момент проведения одного из эпидемиологических исследований в Испании только 20% больных имели установленный диагноз ХОБЛ [27]. В исследовании, проведенном в США, отмечено, что у около 60–70% пациентов со сниженными показателями ОФВ1 диагноз ХОБЛ также никогда не выставлялся [28].
Задачей настоящего анализа явилась оценка клинических исходов, включая прогрессирование заболевания у больных ХОБЛ, никогда не получавших терапии по поводу данного заболевания [29].
В настоящий анализ были включены 810 «наивных» пациентов (403 получали тиотропий, 407 – плацебо). По сравнению с пациентами, уже получавшими поддерживающую терапию по поводу ХОБЛ до начала исследования UPLIFT, «наивные» больные были моложе, имели более «короткую» историю ХОБЛ, чаще являлись актуальными курильщиками и имели более высокие функциональные показатели.
В целом больные групп тиотропия и контроля существенно не различались между собой. Приблизительно 73% пациентов были мужчины, средний возраст составлял 63±8 лет, и 43,1% больных были активными курильщиками. Пациенты имели умеренную бронхиальную обструкцию (постбронходилатационный ОФВ1 52±12% должных) и хороший ответ на бронхолитики – прирост ОФВ1 после ингаляции ипратропия и сальбутамола составил 21±17%. Большинство больных ХОБЛ имели II и III степень тяжести по классификации GOLD и только 5% пациентов – IV.
Уже через 30 дней от начала исследования добронходилатационный показатель ОФВ1 у больных группы тиотропия был выше на 99±15 мл (p<0,0001), чем в группе контроля. На протяжении всего исследования показатели до- и постбронходилатационного ОФВ1 были существенно выше в группе тиотропия (p<0,05 во всех временных точках), различие по добронходилатационному ОФВ1 варьировало от 99 до 160 мл, а по постбронходилатационному ОФВ1 – от 52 до 110 мл.
Ежегодное снижение постбронходилатационного показателя ОФВ1 оказалось более медленным у больных, получавших тиотропий (42 vs 53 мл/год, p=0,026), по сравнению с больными группы контроля (рис. 4).
Таким образом, в исследовании удалось показать, что длительная поддерживающая терапия тиотропием способна замедлить прогрессирование заболевания у больных ХОБЛ, никогда не получавших терапии.
Влияние терапии тиотропием на прогрессирование заболевания у больных ХОБЛ моложе 50 лет
Общепринято, что ХОБЛ – заболевание пожилого возраста. Однако, по данным многочисленных эпидемиологических исследований, ХОБЛ можно обнаружить у больных не только старше 60 лет, но и после 25 лет. D.M. Mannino и соавт. выявили, что среди больных ХОБЛ в возрастном диапазоне от 25 до 54 лет легкая степень тяжести ХОБЛ встречается у 44% больных, средняя степень – у 33% больных [3]. Классическое эпидемиологическое исследование Fletcher и Peto показало, что те больные, которые в ходе исследования умирали от ХОБЛ, в возрасте 40 лет уже имели заметные функциональные нарушения [6].
В настоящее время очень мало известно о течении заболевания и о возможностях медикаментозной терапии у «молодых» больных ХОБЛ.
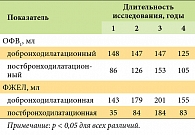
В работе A.H. Morice и соавт. были проанализированы данные из исследования UPLIFT о 356 пациентах моложе 50 лет [30]. Оказалось, «молодые» пациенты имели сходный профиль тяжести ХОБЛ по сравнению с более пожилыми больными, однако среди них чаще выявляли актуальных курильщиков: 51% vs 42% (50–60 лет), 27% (60–70 лет), 14% (>70 лет). В целом у больных ХОБЛ в возрасте < 50 лет терапия тиотропием привела к заметному улучшению функциональных показателей (табл. 2) и улучшению качества жизни. Средняя скорость ежегодного снижения добронходилатационного ОФВ1 в группах контроля и тиотропия составила 41 и 34 мл соответственно (p=ns). В то же время скорость снижения постбронходилатационного ОФВ1 в данных группах составила 58 и 38 мл/год соответственно (p<0,05) (рис. 5).
Таким образом, длительная поддерживающая терапия тиотропием у «молодых» больных ХОБЛ приводит к замедлению прогрессирования заболевания.
Влияние терапии тиотропием на прогрессирование заболевания у больных ХОБЛ в зависимости от статуса курения
Влияние статуса курения на эффективность длительной поддерживающей терапии бронходилататорами у больных ХОБЛ практически не изучена. В одном из немногих доступных на сегодня исследований было проведено сравнение изменения функциональных показателей во время терапии тиотропием в течение 3 мес у больных ХОБЛ – 80 курильщиков и 224 бывших курильщика [31]. Оказалось, что по сравнению с плацебо, максимальное улучшение показателя ОФВ1 наблюдалось у курильщиков (138 мл), а у бывших курильщиков прирост ОФВ1 был менее выражен (66 мл). В другом исследовании продемонстрированы противоположные данные. В метаанализе, посвященном терапии ипратропием (n=1836 больных ХОБЛ), было выявлено, что улучшение функциональных показателей у бывших курильщиков было более выражено, чем у продолжающих курить [32].
Исследование UPLIFT дало возможность детально оценить зависимость легочной функции и эффективности поддерживающей терапии тиотропием от статуса курения в большой группе больных ХОБЛ в течение продолжительного времени [33].
В анализ были включены 5925 больных ХОБЛ. Исходно 70% были бывшими курильщиками и 30% – активными курильщиками; в течение исследования 60% по-прежнему не курили, 14% – перманентно продолжали курить и 26% были интермиттирующими курильщиками. Среди бывших курильщиков 85% в группе плацебо и 83% в группе тиотропия сохраняли этот статус в течение всего исследования, а 14 и 16% соответственно хотя бы на одном визите сообщили о том, что снова курят. Среди активных курильщиков 48% из группы плацебо и 47% из группы тиотропия продолжали курить в течение всего исследования, а 50 и 52% соответственно хотя бы временно прекращали курить. Среди интермиттирующих курильщиков было больше женщин. В разных категориях курения средний возраст больных варьировал от 61 до 66 лет, стадии ХОБЛ II и III по GOLD составляли от 89 до 93%.
Большинство демографических показателей были примерно одинаковыми при разном статусе курения в группах тиотропия и плацебо, однако в группе тиотропия среди перманентных курильщиков было больше мужчин (72%), чем в группе плацебо (62%). Среди бывших курильщиков в начале исследования имели стадии ХОБЛ II и III в группе плацебо 41 и 48% больных соответственно, а в группе тиотропия – 45 и 44% соответственно.
Перманентные курильщики имели самую большую скорость снижения ОФВ1 (–59 мл/год для постбронходилатационных величин), самая низкая была у бывших курильщиков (–33 мл/год). Однако в каждой категории курильщиков разница в скорости падения ОФВ1 между группами тиотропия и плацебо была одинаковой. За период исследования во всех категориях курильщиков получено существенное улучшение легочной функции в группе тиотропия по сравнению с плацебо, причем наиболее выраженным оно было у перманентных курильщиков (через 1 мес на 100 и 90 мл для до- и постбронходилатационных величин соответственно; через 48 мес на 130 и 90 мл соответственно).
Таким образом, длительное лечение тиотропием связано с положительным влиянием на легочную функцию и исходы заболевания при разном статусе курения, хотя величина такого влияния может различаться. Перманентные и интермиттирующие курильщики имеют худший прогноз с точки зрения падения легочной функции, чем бросившие курить пациенты. При любом статусе курения лечение тиотропием было связано с существенным длительным улучшением до- и постбронходилатационных показателей легочной функции по сравнению с плацебо.
Заключение
Таким образом, современная терапия ХОБЛ позволяет добиться модификации заболевания. У больных ХОБЛ поддерживающая терапия тиотропием уменьшает скорость снижения постбронходилататорного ОФВ1, т.е. замедляет прогрессирование ХОБЛ. Данный эффект особенно выражен у больных с ранними стадиями ХОБЛ (GOLD II), у пациентов, ранее не принимавших терапии по поводу ХОБЛ, и у больных младше 50 лет. Терапия тиотропием приводит к стойкому улучшению функциональных показателей больных ХОБЛ независимо от статуса курения.

