Новые аспекты использования росиглитазона в профилактике и лечении сахарного диабета 2 типа
- Аннотация
- Статья
- Ссылки

Подавляющее большинство больных – это пациенты с сахарным диабетом 2 типа (СД2) Социальная значимость СД определяется его поздними осложнениями. Общепризнанно, что сахарный диабет стал серьезной проблемой для здравоохранения. Это заболевание затрагивает лиц любого возраста и приводит к длительной утрате здоровья и ранней смерти больных. Инвалидность и летальность от диабетической нефропатии и диабетической гангрены, а также кардиоваскулярных и цереброваскулярных заболеваний остается очень высокой. Для любого государства – это значительное экономическое бремя.
Радикальное излечение СД 2 типа – вопрос будущего, а сегодня диабет в определенном смысле является неизлечимым заболеванием, поэтому его профилактике в последнее время уделяют особое внимание. Ежегодно у 5-10% лиц с нарушенной толерантностью к глюкозе (НТГ) развивается СД 2 типа, за пятилетие эта цифра составляет 20-34%. Гликемия натощак более 5,6 ммоль/л в сочетании с НТГ повышает риск развития СД до 65%. Как показали эпидемиологические исследования, даже на стадии НТГ частота развития ишемической болезни сердца (ИБС) в 2 раза выше, а смертность от ССЗ в 1,5 раза выше, чем у лиц без нарушений углеводного обмена. Предположительно, около 300 млн человек в мире находятся на стадии преддиабета. Учитывая высокий сердечно-сосудистый риск у пациентов с СД 2 типа, профилактические мероприятия должны начинаться рано. Следовательно, даже на стадии НТГ необходимо начинать активное лечение для профилактики сердечно-сосудистых заболеваний (ССЗ) и прогрессирования нарушений углеводного обмена.
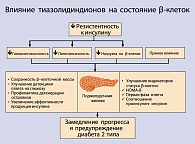
СД 2 типа представляет собой хроническое прогрессирующее заболевание, обусловленное наличием инсулинорезистентности (ИР) и секреторным дефектом b-клеток. В основе прогрессирования атеросклероза и высокой летальности от кардиоваскулярных расстройств у больных СД2 также лежит ИР и сопутствующая ей гиперинсулинемия (рисунок 1). Доказано, что к моменту развития СД 2 типа чувствительность периферических тканей к инсулину оказывается сниженной на 70%, а секреция инсулина – на 50%. Инсулинорезистентность – сниженная чувствительность периферических тканей к действию эндогенного инсулина. Наибольшее клиническое значение имеет потеря чувствительности к инсулину мышечной, жировой и печеночной тканей. Понимание механизмов развития ИР, поиск генов, ответственных за ее развитие крайне важен для разработки новых подходов к лечению СД2. Работы в области молекулярной биологии показали, что у больных СД2 имеются генетические дефекты, ответственные за передачу сигнала после соединения инсулина с рецептором (пострецепторные дефекты). Прежде всего нарушается транслокация переносчика глюкозы ГЛЮТ-4. В этом могут быть повинны генетические дефекты на уровне субстрата инсулинового рецептора I типа и/или фосфатидилинозитол-3-киназы. При СД2 также обнаружена нарушенная экспрессия других генов, обеспечивающих метаболизм глюкозы и липидов, в частности гена глюкозо-6-фосфатдегидрогеназы, глюкокиназы, липопротеинлипазы, синтазы жирных кислот и ряда других.
Генетическая предрасположенность к ИР может не проявиться клинически (в виде метаболического синдрома и/или СД2) при отсутствии соответствующих факторов внешней среды. К ним, как известно, относятся избыточное калорийное питание и низкая физическая активность, приводящие к увеличению абдоминального ожирения, накоплению свободных жирных кислот (СЖК) и, следовательно, усилению имеющейся ИР.
Ухудшение состояния b-клеток также, вероятно, является следствием сочетания генетических и окружающих факторов (рисунок 2). Наследственный аспект становится явным исходя из того факта, что риск диабета 2 типа возрастает в случае, если им страдали один или оба родителя пациента, а в небольшом количестве случаев диабета 2 типа секреция инсулина может быть нарушена без присутствия резистентности к инсулину. Более того, в животных моделях были идентифицированы генетические локусы, обеспечивающие нарушение секреции инсулина и изменение экспрессии генов островков поджелудочной железы.
Гипергликемия, даже умеренная, наблюдающаяся еще до развития диабета, может приводить к повреждению b-клеток за счет процесса, известного под названием глюкозотоксичность. В экспериментальных и животных моделях хроническое воздействие глюкозы на b-клетки приводит к нарушению секреции инсулина, в то время как повышенные уровни глюкозы коррелируют с уровнем апоптоза (запрограммированной клеточной смерти). Второй феномен, липотоксичность, также приводит к поражению b-клеток. У инсулинорезистентных индивидуумов жировая ткань резистентна к инсулин-регулируемой супрессии процессов липолиза, и это является причиной повышения уровня свободных жирных кислот. Длительное повышение уровня свободных жирных кислот приводит к функциональным нарушениям b-клеток в экспериментальных клеточных моделях, ингибируя секрецию инсулина. Как и в случае с глюкозотоксичностью, липотоксичность также индуцирует апоптоз b-клеток.
Повышение инсулинорезистентности и поражение b-клеток лежат в основе прогрессирования диабета 2 типа, и эти два фактора имеют различные значения и степени изменения. Инсулинорезистентность провоцирует изменения, которые наблюдаются до начала гипергликемии, и уровни инсулинорезистентности достигают своих максимальных значений на относительно ранних стадиях прогрессирования заболевания. Поражение b-клеток также играет роль на ранних стадиях патогенеза диабета 2 типа, причем эти патологические изменения вначале протекают длительно, а затем демонстрируют быстрый прогресс, и уровни эндогенного инсулина значительно снижаются. Данные, экстраполированные из исследований UKPDS и Belfast Diet Study, заставляют предполагать, что дисфункция b-клеток предшествует развитию диабета в течение вплоть до 15 лет. Кроме того, в UKPDS была отмечена корреляция между длительным постепенным ухудшением контроля гликемии и прогрессивной дисфункцией b-клеток, подтверждая мнение о том, что поражение b-клеток может быть ведущим фактором заболевания.
В целом, инсулинорезистентность и поражение b-клеток вовлечены в нарушение метаболизма глюкозы, что может привести к диабету 2 типа. Однако в то время как инсулинорезистентность является хорошо установленным фактором риска для прогресса диабета, здоровые b-клетки могут компенсировать резистентность повышением продукции инсулина с тем, чтобы поддерживать нормогликемию. При прогрессировании болезни значительная потеря b-клеток является причиной прекращения компенсаторной гиперинсулинемии.
Исследования, которые проводятся в настоящее время, показывают, что нарушения со стороны b-клеток заключаются не только в простой редукции секреции инсулина, они являются многофакторными и вовлекают целый ряд дефектов, в частности изменения в способности b-клеток остро отвечать на стимуляцию глюкозой (изменение I фазы секреции инсулина), нарушение образования инсулина (соотношение проинсулин/инсулин), изменения b-клеточной массы.
Основная концепция терапии метаболических нарушений базируется на представлении о том, что уменьшение инсулинорезистентности и хронической гиперинсулинемии способно предотвратить клиническую манифестацию сахарного диабета 2 типа и сердечно-сосудистых заболеваний, а при развившихся заболеваниях – снизить тяжесть их течения. Как известно, существуют немедикаментозные методы лечения инсулинорезистентности, которые при неэффективности могут быть усилены фармакотерапией. Исходя из особенностей патофизиологии НТГ необходимо строить концепцию профилактики СД 2 типа, а значит, следует избегать продуктов, стимулирующих секрецию инсулина и содержащих большое количество жира. Повышенное потребление жира с пищей коррелирует с высоким уровнем инсулина натощак независимо от массы тела. Параллельно с диетотерапией должны проводиться мероприятия, направленные на повышение двигательной активности. Рекомендуются физические нагрузки умеренной интенсивности по 30-45 минут не менее 3-5 раз в неделю.
Исследование по профилактике диабета (Diabetes Prevention Study) показало, что даже умеренное уменьшение массы тела у больных с НТГ может значительно уменьшить процент ее перехода в СД. Однако следует учитывать, что интенсивное изменение образа жизни требует очень больших усилий, которые не могут выдержать подавляющее большинство больных. Анализ результатов нескольких проспективных контролируемых исследований эффективности изменения образа жизни как без медикаментозной терапии, так и в сочетании с ней (метформин, акарбоза, ксеникал) показал, что эти мероприятия приводят к снижению риска развития СД 2 типа на 31-58%. Среди существующего арсенала антидиабетических средств наибольший интерес в плане возможного использования с целью профилактики СД 2 типа представляет росиглитазон. Воздействуя на специфические ядерные PPARγ-рецепторы, расположенные в жировой, мышечной ткани и паренхиматозных органах, тиазолидиндионы устраняют инсулинорезистентность и оказывают регулирующее влияние на метаболизм глюкозы и липидов. В целом тиазолидиндионы усиливают отложение глюкозы в скелетной мускулатуре и жировой ткани, уменьшают выброс глюкозы печенью, повышают чувствительность адипоцитов к инсулину и их способность к захвату глюкозы и хранению липидов. Это тормозит липолиз, что в свою очередь снижает системное содержание глицерина и свободных жирных кислот. Увеличение их количества оказывает выраженное влияние на гомеостаз глюкозы, снижая ее захват, окисление и хранение в мышечной ткани. СЖК также играют роль в патогенезе резистентности к инсулину, вызывая снижение стимулированного инсулином захвата глюкозы, активируя глюконеогенез в печени и угнетая синтез гликогена в мышцах. Кроме того, повышенное количество СЖК значительно ограничивает секрецию инсулина b-клетками.
Дополнительным позитивным эффектом росиглитазона является его способность сохранять функциональную активность β-клеток. Росиглитазон, оказывая воздействие на PPARγ-рецепторы, расположенные в печеночной и жировой тканях, способствует коррекции дислипидемии, наблюдаемой у больных СД2. Гиполипидемический эффект является дополнительным преимуществом тиазолидиндионов перед другими пероральными сахароснижающими препаратами. Кроме того, применение тиазолидиндионов у больных с СД2 открывает перспективы профилактики сердечно-сосудистых осложнений, механизм развития которых во многом обусловлен имеющейся инсулинорезистентностью.
2006 год оказался знаменательным в плане получения новых данных, касающихся эффективности Авандии в снижении риска прогрессирования преддиабета в сахарный диабет 2 типа и снижении риска неудачи монотерапии в течение пяти лет по сравнению с метформином и глибуридом. Предположение о том, что применение препаратов этого класса позволило бы предотвратить развитие практически всех проявлений метаболического синдрома блестяще подтвердилось в завершившемся многоцентровом, двойном слепом, плацебоконтролируемом исследовании DREAM (Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication), результаты которого были впервые опубликованы в сентябрьском номере журнала LANCET и представлены на 42 ежегодном конгрессе Европейской ассоциации исследования диабета (ЕАSD) в Копенгагене. В исследовании DREAM оценивалось влияние росиглитазона и/или ингибитора АПФ рамиприла на прогресс заболевания от нарушения толерантности к глюкозе и нарушения уровня гликемии натощак до диабета 2 типа. 4 декабря 2006 года в Кейптауне на XIX Всемирном конгрессе Международной федерации диабета были доложены результаты исследования ADOPT (A Diabetes Outcome Progression Trial), которое является первым длительным исследованием по прямому сравнению доступных в настоящее время методов лечения диабета 2 типа и впервые после UKPDS поможет установить новые стандарты ведения пациентов. Результаты данного международного иследования, включавшего 4360 пациентов с недавно манифестировавшим сахарным диабетом 2 типа , были также опубликованы в журнале New England Journal of Medicine.
Способность глитазонов отдалить или предупредить прогресс диабета 2 типа становилась все более очевидной. Так, в исследовании TRIPOD назначение троглитазона женщинам с ранним гестационным диабетом значительно редуцировало частоту развития диабета по сравнению с плацебо в течение 30 месяцев. После отмены троглитазона кумулятивная заболеваемость оставалась пониженной в течение 8 месяцев наблюдения, и это подтверждает, что подобная терапия вызывает фундаментальные изменения в развитии болезни, а не только краткосрочно маскирует заболевание посредством воздействия на уровни глюкозы. Кроме того, в исследовании, проведенном на пациентах с нарушением толерантности к глюкозе и инсулинорезистентностью, частота развития диабета 2 типа была значительно меньше у тех лиц, которые получали глитазон в течение 2 лет, по сравнению с группой контроля. Последние данные Diabetes Prevention Program (DPP) также говорят в поддержку потенциала глитазонов. Назначение троглитазона лицам с нарушением толерентности к глюкозе в среднем в течение 9 месяцев значительно редуцирует вероятность развития диабета 2 типа на протяжении периода терапии по сравнению с группой контроля. Наконец, в исследовании PRO-active, в котором исследовалось влияние пиоглитазона на сердечно-сосудистые осложнения, вынужденный переход пациентов на терапию инсулином наблюдался значительно реже в течение 34,5 месяцев терапии в группе пиоглитазона по сравнению с плацебо. По данным клинических исследований, 26-недельная монотерапия росиглитазоном приводит к 60-процентному улучшению функционального состояния b-клеток по результатам HOMA. Улучшение состояния b-клеток на фоне глитазонов контрастирует с результатами воздействия других антидиабетичских агентов. Например, в шестимесячном исследовании росиглитазон, но не инсулин вызывал улучшение со стороны первой фазы инсулинового ответа на глюкозу и снижал соотношение проинсулина к инсулину – эффект, который не зависел от глюкозотоксичности. Механизмы позитивного воздействия глитазонов на статус и функциональное состояние b-клеток могут быть как прямые, так и косвенные, а именно посредством увеличения чувствительности к инсулину и уменьшения плазматических уровней глюкозы и свободных жирных кислот – таким образом осуществляется протекция b-клеток от глюкозотоксичности и липотоксичности. Также уменьшается потребность в усиленной продукции инсулина b-клетками.
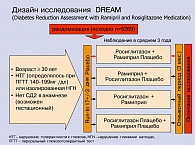
DREAM – это самое крупное исследование по профилактике диабета у 5300 лиц в возрасте старше 30 лет с нарушением толерантности к глюкозе и нарушением уровня гликемии натощак. Двадцать одна страна приняла участие в проведении исследования. Рамиприл является кандидатом на исследования с тех пор, как исследование Heart Outcomes Prevention Evaluation (HOPE) выявило, что в группе лиц с высоким риском диабета, получавших 4,5 курса лечения препаратом, диабет диагностировался на 33% реже. В рамках DREAM проводилась оценка влияния терапии на первичные параметры эффективности – прогрессирование НТГ в диабет или смерть от любых причин. Вторичные конечные точки включали изменения функций b-клеток, оцениваемых по инсулиновому индексу и HOMA, изменения инсулинорезистентности, нормализацию толерантности к глюкозе и нормализацию уровней глюкозы натощак, а также частоту одного или более сердечно-сосудистых или почечных осложнений. Исследование DREAM определило вероятность развития сахарного диабета 2 типа на протяжении в среднем трехлетнего периода наблюдения. Пациенты, принимавшие участие в исследовании, были рандомизированы в группы, принимавшие росиглитазон (8 мг ежедневно, n=2365) или плацебо и рамиприл (15 мг ежедневно) или плацебо (n=2634) с использованием факториального дизайна 2´2 в сочетании с рекомендациями по изменению образа жизни (рисунок 3). Их состояние оценивалось врачом каждые 6 месяцев в течение 3-5 лет для определения возможности снижения риска развития диабета 2 типа у пациентов с преддиабетом. Исследование DREAM не преследовало цели прямого сравнения препаратов рамиприла и росиглитазона. Результаты исследования, касающиеся действия препарата рамиприл, который увеличивал регрессию заболевания до нормогликемии, но не продемонстрировал снижения риска развития диабета или смерти, также были представлены на конгрессе EASD и опубликованы отдельно в журнале New England Journal of Medicine.
Результаты исследования продемонстрировали, что только у 10,6% пациентов, принимавших препарат росиглитазон, развился диабет 2 типа в сравнении с 25% пациентов, принимавших плацебо. В отношении композитной первичной конечной точки исследования, включавшей развитие диабета или смерть по любой причине, росиглитазон продемонстрировал снижение риска на 60% относительно плацебо (p<0,0001).
На протяжении в среднем трехлетнего периода наблюдения у 51% пациентов, получавших лечение росиглитазоном, уровень сахара в крови нормализовался по сравнению с 30% пациентов, получавших плацебо. Таким образом, пациенты, принимавшие росиглитазон, имели примерно на 70% (p<0,0001) больше вероятность восстановить нормальный уровень сахара в крови, чем те, кто принимали плацебо. Как известно, пациенты с высоким индексом массы тела (ИМТ) – признаком ожирения – имеют большую вероятность развития диабета, чем те, у кого этот индекс ниже. Однако риск развития диабета не повышался в зависимости от ИМТ в группе росиглитазона по сравнению с группой плацебо. Эти данные говорят о том, что росиглитазон может уменьшать повышенный риск развития диабета, который присущ ожирению.
В исследовании росиглитазон в целом хорошо переносился пациентами. Не было существенной разницы между группами росиглитазона и плацебо в отношении выбывания из исследования до его окончания. В отношении композитной вторичной конечной точки кардиоваскулярных событий, включавшей инфаркт миокарда, инсульт, кардиоваскулярную смерть, подтвержденную сердечную недостаточность, нестабильную стенокардию и операции реваскуляризации (2,9% в группе росиглитазона – 75 случаев; 2,1% в группе плацебо – 55 случаев, p=0,15) также существенной разницы выявлено не было. Показатель количества смертей в процессе исследования был небольшим и без значимого различия между группами (1,1% в группе росиглитазона 30 смертей – в сравнении с 1,3% в группе плацебо –33 смерти, p=0,7). Наиболее часто из сердечно-сосудистых событий отмечались операции реваскуляризации. Большее количество случаев развития подтвержденной сердечной недостаточности наблюдалось в группе росиглитазона по сравнению с группой плацебо (0,5% пациентов – 14 случаев и 0,1% пациентов – 2 случая соответственно, p=0,01). Данные, предоставленные Университетом МакМастера, показали, что все случаи сердечной недостаточности эффективно лечились на протяжении исследования. Информация о возможности развития сердечной недостаточности при приеме росиглитазона содержится в инструкции по медицинскому применению препарата. К окончанию исследования средняя масса тела в группе росиглитазона незначительно увеличилась (2,2 кг) по сравнению с группой плацебо.
Исследование ADOPT – это важный шаг вперед по сравнению с исследованием Kingdom Prospective Diabetes Study (UKPDS), которое было завершено в 1998 году, когда тизолидиндионы (TZDs) были еще недоступны и которое включало два из трех пероральных препаратов, оценивавшихся в исследовании ADOPT, – метформин и сульфонилмочевина.
Пациенты, которые включались в исследование, были рандомизированы в группы росиглитазона, сульфонилмочевины (глибурида) или метформина, при этом проводилось титрование доз препаратов до максимально эффективных (росиглитазон – 4 мг два раза в день; метформин – 1 г два раза в день; глибурид – 7,5 мг два раза в день). Пациенты наблюдались в течение 4-6 лет для оценки длительного влияния каждого лекарственного препарата, которое применялось в качестве инициальной монотерапии, на уровень сахара в крови, инсулинорезистентность и функциональное состояние β-клеток. К моменту неудачи монотерапии 99,3%, 98,6% и 99% пациентов получали максимальные дозы росиглитазона, метформина и глибурида соответственно.
Результаты исследования ADOPT показали, что начальная терапия препаратом Авандия® уменьшает риск неудачи монотерапии у пациентов с диабетом 2 типа на 32% по сравнению с метформином (р<0,001) и на 63% по сравнению с глибуридом (р<0,001) в течение пяти лет. Начальная терапия росиглитазоном отдаляет прогрессирующую потерю контроля уровня сахара в крови более эффективно, чем метформин или глибурид, при оценке различных пороговых значений сахара крови – от уровня глюкозы плазмы натощак (ГПН) >180 мг/дл (>10 ммол/1) до более низких значений сахара крови, которые больше соответствуют современным терапевтическим подходам – ГПН >140 мг/дл (>7,8 ммол/1). Длительный контроль глюкозы, оцениваемый по среднему уровню гликогемоглобина (HbAlc) <7,0 %, поддерживался в течение более длительного времени на фоне росиглитазона – 60 месяцев по сравнению с 45 месяцами на фоне метформина и 33 месяцами на фоне глибурида. Исследование ADOPT продемонстрировало, что росиглитазон значительно улучшает чувствительность к инсулину (р<0,001 по сравнению с метформином или глибуридом) и уменьшает степень подавления функции β-клеток (р=0,02 по сравнению с метформином; р<0,001 по сравнению с глибуридом).
Исследование ADOPT на большой когорте больных диабетом 2 типа показало, что росиглитазон в целом хорошо переносится пациентами, за которыми наблюдали в течение шести лет. Достоверной разницы между группами росиглитазона и метформина по такому параметру, как вынужденная отмена препарата, не наблюдалось, однако она чаще наблюдалась в группе глибурида (44% – в группе глибурида, 38% – в группе метформина, 37% – в группе росиглитазона). Данная разница в основном обусловлена более высокой частотой исключения из исследования из-за гипогликемии в группе глибурида.
Одинаковая частота серьезного нежелательного явления – сердечной недостаточности – отмечалась в группах росиглитазона (0,8 %) и метформина (0,8 %); однако она наблюдалась реже в группе глибурида (0,2%).
По результатам пятилетнего наблюдения, в ходе исследования наиболее частыми нежелательными явлениями в терапевтических группах были: отеки (росиглитазон – 14,1%, глибурид – 8,5%, метформин – 7,2%); увеличение массы тела (росиглитазон – 6,9%; глибурид – 3,3%; метформин – 1,2%); нежелательные явления со стороны желудочно-кишечного тракта (метформин – 38,3 %, росиглитазон – 23%, глибурид – 21,9%), и гипогликемия (глибурид – 38,7%, метформин – 11,6%, росиглитазон – 9,8 %).
Недавно проведенный анализ показал более низкую частоту переломов как нежелательного явления у женщин, принимавших глибурид или метформин, по сравнению с росиглитазоном (глибурид – 3,5%, метформин – 5,1%, росиглитазон – 9,3%), представленных в виде переломов ступни и костей верхних конечностей. Разницы в частоте переломов в мужской популяции в разных группах отмечено не было. Данная частота переломов у женщин, согласно литературным данным, соответствует таковой у женщин с диабетом, выявленного в ходе проведения обсервационных исследований и анализа крупных баз данных по лечению диабета. Данные результаты свидетельствуют о том, что у пожилых женщин с диабетом 2 типа имеется повышенный риск переломов.
Учитывая, что СД 2 типа в настоящее время является неизлечимым заболеванием и тяжелым экономическим бременем для любого государства и семьи, причиной ранней инвалидизации людей трудоспособного возраста и высокой летальности, крайне актуальным становится изыскание путей профилактики или отсрочки его развития. За последнее десятилетие были предприняты несколько многоцентровых рандомизированных плацебо контролируемых исследований, в которых наряду со стандартным или интенсивным изменением образа жизни использовали и лекарственные средства (акарбоза, метформин, ксеникал). Продолжаются исследования и с другими препаратами. Росиглитазон в дозе 8 мг применен в исследовании DREAM (Diabetes Reduction Assessment with Ramipril and Rosiglitazone Medication ) и показал высокую эффективность в профилактике СД 2 типа. По сравнению с группой плацебо в группе росиглитазона снижение риска перехода НТГ в СД 2 типа составило 62%. Исследование ADOPT подтвердило целесообразность раннего включения росиглитазона в терапию пациентов с диабетом 2 типа. Это первое длительное исследование, которое показало, что прогрессирующая потеря контроля уровня сахара в крови может быть отсрочена, а целевые уровни сахара в крови могут поддерживаться с помощью росиглитазона в течение длительного времени по сравнению с метформином или глибуридом – двумя наиболее часто применяемыми пероральными антидиабетическими препаратами. Росиглитазон – безопасное и эффективное лекарственное средство не только для длительного применения пациентами с сахарным диабетом 2 типа, но также может обсуждаться его применение у лиц с НТГ с целью предупреждения или отсрочки развития СД 2 типа.

