Новые перспективы лечения лимфопролиферативных заболеваний. IX научно-практическая конференция «Современная гематология. Проблемы и решения». Сателлитный симпозиум компании «Рош»
- Аннотация
- Статья
- Ссылки



Современные подходы к оптимизации терапии В-клеточных неходжкинских лимфом
Мабтеру одним из первых таргетных препаратов начали использовать у пациентов с фолликулярной лимфомой. Доказано, что добавление Мабтеры к химиотерапии при диффузной В-крупноклеточной лимфоме (ДВКЛ) приводит к «драматическому улучшению» результатов лечения3. Крайне важно, что у пожилых больных ДВКЛ добавление Мабтеры к химиотерапии способствует улучшению показателей беспрогрессивной и общей выживаемости4.
На сегодняшний день Мабтера включена в схемы лечения различных вариантов В-клеточных лимфом у пациентов разного возраста (рис. 1).
Мабтера применяется при индолентных и агрессивных неходжкинских лимфомах в виде индукционной терапии, а также в качестве поддерживающей терапии в первой линии или в случае рецидива заболевания.
До недавнего времени с внутривенным введением Мабтеры были связаны определенные неудобства. Они касались доступа к периферической вене, расчета дозы и приготовления раствора. Компания «Рош» провела оптимизацию таргетного препарата, которая предусматривала коррекцию режима дозирования и способа введения. Итогом стала новая подкожная форма препарата Мабтера. Препарат Мабтера для подкожного введения уже зарегистрирован в России. Его появление на отечественном фармацевтическом рынке ожидается в ближайшее время.
«Препарат очень удобен в использовании. Это флакон с готовым к употреблению раствором объемом 11,7 мл, который набирается шприцем объемом 20 мл, после чего с помощью тоненькой иглы вводится больному в подкожную жировую клетчатку», – уточнила докладчик.
Выбору наиболее оптимального режима дозирования формы для подкожного введения препарата Мабтера было посвящено исследование SparkThera (BP22333)5. 124 пациента с фолликулярной лимфомой, получившие внутривенно одну инфузию ритуксимаба и более, были рандомизированы на четыре группы: одну группу внутривенного введения Мабтеры в дозе 375 мг/м2 и три группы подкожного введения Мабтеры в дозах 375, 625 и 800 мг/м2. В результате анализа фармакокинетики различных доз препарата оптимальной была признана фиксированная доза 1400 мг, не зависевшая от веса и пола больного. В соответствии с полученными данными, фармакокинетические параметры сывороточной концентрации Мабтеры для подкожного (1400 мг) и внутривенного (375 мг/м2) введения сопоставимы. Мабтера для подкожного введения хорошо переносится. Профиль ее безопасности соответствует таковому внутривенной формы препарата.
Первая доза препарата Мабтера всегда вводится внутривенно. Это позволяет наблюдать за состоянием пациента и в случае развития побочных реакций корректировать терапию.
В исследовании III фазы SABRINA (BO22334) изучали безопасность, сопоставимость и эффективность препарата Мабтера для подкожного введения в фиксированной дозе 1400 мг6. 530 нелеченых пациентов с фолликулярной лимфомой были рандомизированы в группу внутривенного введения Мабтеры в дозе 375 мг/м2 в комбинации с химиотерапией по схеме CHOP или CVP и группу, получавшую после первой внутривенной дозы препарата подкожную форму Мабтеры в дозе 1400 мг в комбинации с CHOP или CVP.
Согласно полученным данным, общий ответ на терапию в двух группах был сопоставим: для подкожной формы – 83%, для внутривенной – 84%. Однако частота полных ответов была выше в группе Мабтеры для подкожного введения в комбинации с химиотерапией: 42% – у мужчин, 49% – у женщин. В группе Мабтеры для внутривенного введения в комбинации с химиотерапией эти показатели составили 21 и 39% соответственно7.
Исследование SABRINA продемонстрировало сопоставимый профиль безопасности двух форм препарата Мабтера: частота всех зарегистрированных нежелательных явлений в группах была сходной (при подкожном введении – 93%, при внутривенном – 92%)6. Различия отмечались только в частоте инфузионных реакций за счет эритемы 1-й степени на месте подкожного введения. В группе подкожного введения Мабтеры инфузионные реакции были зафиксированы в 47% случаев, в группе внутривенного введения – в 33% случаев.
В немецком исследовании Prefmab оценивали, какую из двух форм введения Мабтеры предпочитают пациенты, получившие первую линию терапии по поводу В-клеточной неходжкинской лимфомы8. Подавляющее большинство участников исследования (82–84%) предпочли подкожную форму. Основные причины, по мнению пациентов, – более комфортное введение, менее продолжительное пребывание в клинике и меньший эмоциональный стресс.
Сказанное подтверждает и собственный исследовательский опыт профессора Г.С. Тумян: «Все 42 пациента, участвовавшие в исследованиях в нашей клинике, выбрали именно эту форму введения. Серьезных нежелательных явлений, связанных с ней, не наблюдалось».
Ключевым благоприятным фактором при подкожном введении Мабтеры является улучшение эмоционального статуса больного. Подкожное введение позволяет значительно снизить время пребывания в клинике. Дело в том, что вместо четырех-пяти часов, необходимых для внутривенного введения Мабтеры, на подкожное введение уходит всего 10–15 минут. Фиксированная, более корректная доза Мабтеры и более физиологичный путь ее доставки в лимфатическую систему, минуя кровеносное русло, скорее всего ассоциируются с высокой эффективностью препарата. Следовательно, подкожное введение ритуксимаба удобно, безопасно и эффективно.
Далее профессор Г.С. Тумян кратко остановилась на возможностях первого гуманизированного гликоинженерного моноклонального анти-CD20 антитела 2-го типа – препарата Газива (обинутузумаб). Препарат Газива в комбинации с хлорамбуцилом одобрен во многих странах мира, в том числе в России, для лечения хронического лимфолейкоза.
В настоящее время уже имеются положительные результаты многоцентрового рандомизированного исследования III фазы GADOLIN, посвященного сравнительной оценке комбинации препарата Газива с бендамустином с последующей поддерживающей терапией Газивой и монотерапии бендамустином у пациентов с индолентной неходжкинской лимфомой (НХЛ), рефрактерных к терапии, с включением ритуксимаба. Эти данные представлены в Управление по контролю за продуктами питания и лекарственными средствами США (Food and Drug Administration – FDA) и другие регуляторные органы для рассмотрения вопроса о расширении показаний к применению препарата Газива.
В заключение профессор Г.С. Тумян отметила, что кроме препаратов Мабтера и Газива портфолио потенциальных лекарственных препаратов компании «Рош» для лечения онкогематологических заболеваний включает иммуноконъюгат анти-CD79a (полатузумаб ведотин), малые молекулы – антагонист MDM2 и ингибитор BCL-2 (АВТ-199), в отношении которых проводятся клинические исследования различных фаз.
Хронический лимфоцитарный лейкоз: кто наши пациенты и что мы предлагали им раньше?
По данным Боткинской больницы, режим FCR занимает лидирующие позиции при выборе терапии первой линии: из 514 пациентов с хроническим лимфолейкозом его получали 39% больных. На втором месте – хлорамбуцил – 16% пациентов. Режим FCR Lite или режим LR применяли по 12% пациентов. При выборе терапии второй линии пальма первенства принадлежит режимам FCR и FR – 21% пациентов, за ними следует режим BR – 18% больных, далее – хлорамбуцил – 16%.
Какова эффективность разных режимов химиотерапии?
Согласно российским данным, при использовании алкилирующих препаратов в терапии первой линии время до следующей терапии составляет 18 месяцев, при добавлении к ним ритуксимаба этот период увеличивается до 33 месяцев, при использовании режима FCR Lite – до 54 месяцев, режима FCR – до 64 месяцев. Последний режим демонстрирует наибольшую эффективность и во второй линии терапии, поскольку медиана времени до следующей терапии достигает 29 месяцев. Таким образом, как в первой, так и во второй линии терапии наиболее эффективны комбинированные схемы с флударабином и Мабтерой.
Одна из причин, препятствующих проведению наиболее эффективных режимов химиотерапии, – коморбидность, которая в российской выборке больных ХЛЛ превышает 80%. В связи с этим режим FCR применяют у 40–45% больных. Остальные пациенты получают менее эффективные методы лечения. По словам докладчика, коморбидность влияет на общую выживаемость при наличии серьезных патологий, к которым с учетом индекса Чарлсона (Charlson) можно отнести, например, тяжелую почечную недостаточность, вторичный рак, сердечную недостаточность, серьезную декомпенсацию кровообращения, сахарный диабет с осложнениями.
В структуре смертности больных ХЛЛ преобладают причины, связанные с основным заболеванием – хроническим лимфолейкозом (61% случаев). Основной из данных причин является прогрессирование заболевания. На долю осложнений, связанных с терапией, приходится 11%, других причин – 28%. Уровень коморбидности влияет на причину смерти. Например, 72% пациентов с низким уровнем коморбидности (CIRS ≤ 4) умирают от хронического лимфолейкоза. Среди пациентов с высоким уровнем коморбидности (CIRS ≥ 5) причины смерти, связанные с ХЛЛ, имеют место в 53% случаев.
Какие существуют факторы прогноза у больных ХЛЛ?
В многовариантном анализе независимое прогностическое значение в выживаемости без прогрессирования имели мутация ТР53/делеция 17р (4 балла), вариант без мутаций IgVH (2 балла), уровень бета-2-микроглобулина ≥ 3,5 мг/л (2 балла), стадия заболевания B/C (1 балл), возраст > 65 лет (1 балл).
На сегодняшний день на основании этих прогностических факторов разработан международный прогностический индекс ХЛЛ, в соответствии с которым выделяют четыре группы риска. По данным международных исследований, пятилетняя общая выживаемость в группе низкого риска (0–1 балл) составляет 93,2%, в группе промежуточного риска (2–3 балла) – 79,4%, в группе высокого риска (4–6 баллов) – 63,6%, в группе очень высокого риска (7–10 баллов) – 23,3%9. Эти данные сопоставимы с данными регистра Боткинской больницы, согласно которым пятилетняя общая выживаемость в группе низкого риска составляет 97%, в группе промежуточного риска – 77%, высокого риска – 64%, очень высокого – 14%.
«Общую выживаемость больных хроническим лимфоцитарным лейкозом, даже с учетом поправок на возраст, предопределяет терапия первой линии. Чем эффективнее режимы, используемые в терапии первой линии, тем благоприятнее исход лечения. В этом помогают новые более эффективные и безопасные препараты, которые позволяют добиваться более качественных ремиссий и увеличивать продолжительность жизни пациентов», – констатировал Е.А. Никитин.
Новые перспективы в лечении хронического лимфолейкоза
Следует отметить, что неудачи лечения также имеют место: у 20% пациентов не исключен рецидив в течение двух лет. Анализ данных показал, что у 50% больных, имеющих ранний рецидив, выявляется делеция 17-й хромосомы10. Понимание биологии ХЛЛ и попытки улучшить результаты лечения привели к созданию молекул, влияющих на различные звенья патогенеза ХЛЛ, например ингибиторов сигнала BCR-комплекса (ибрутиниб, иделалисиб), проапоптотических препаратов (АВТ-199), моноклональных антител (офатумумаб, обинутузумаб). Для нормальной жизнедеятельности клетки необходима экспрессия функционально активного В-клеточного рецепторного комплекса, через который осуществляется проведение всех сигналов для пролиферации, миграции, выживания клетки11. Эти сигналы поступают посредством первичных и вторичных мессенджеров, в роли которых выступают различные киназы. Блокируя с помощью лекарственного средства ту или иную киназу, можно ослаблять пролиферацию, миграцию, выживаемость клетки, влияя на микроклеточное окружение.
Ибрутиниб является ингибитором тирозинкиназы Брутона, необходимой для передачи сигнала от BCR. Данные исследования HELIOS продемонстрировали, что комбинированная терапия препаратами ибрутиниб, бендамустин и ритуксимаб (BR) приводит к значительному улучшению выживаемости без прогрессирования и общей выживаемости по сравнению с плацебо + BR у пациентов с рецидивирующим или рефрактерным ХЛЛ/лимфомой из малых лимфоцитов12.
В исследовании RESONATE-17 показано, что применение ибрутиниба у пациентов с рецидивирующим или рефрактерным ХЛЛ, которые имели делецию 17р и/или мутацию ТР53, способствовало увеличению общей и беспрогрессивной выживаемости13.
Иделалисиб относится к ингибиторам PI3-киназы и способствует блокированию передачи сигналов, стимулирующих рост, пролиферацию и выживаемость клеток. В исследовании пациентам с рецидивирующим ХЛЛ назначали иделалисиб в комбинации с ритуксимабом. На фоне применения данной комбинации значительно улучшались показатели общей и беспрогрессивной выживаемости у пациентов с делецией 17р и/или мутацией ТР53, делецией 11-й хромосомы, немутированным IgVH14.
Проапоптотический препарат АВТ-199 – потенциальный селективный ингибитор Bcl-2. Апоптоз может быть заблокирован различными способами, в том числе через систему гена Bcl-2, ответственного за нарушение соотношения анти- и проапоптотических белков. В связи с этим была разработана молекула, блокирующая антиапоптотический белок Bcl-2. АВТ-199 является третьей генерацией данной молекулы, отличается высокой активностью в опухолевых клетках, экспрессирующих Bcl-2, и не активен при экспрессии Bcl-XL.
Первым гликоинженерным моноклональным антителом анти-CD20 2-го типа является обинутузумаб (Газива). Благодаря уникальному механизму действия Газива способствует усилению индукции прямой гибели клеток и антителозависимой клеточной цитотоксичности (АЗКЦ)15, 16. Как разъясняет Т.Е. Бялик, прямая гибель – это цитоплазматический тип гибели клеток с участием лизосом. Газива характеризуется многократно усиленной способностью индуцировать АЗКЦ и прямую гибель клеток по сравнению с антителами 1-го типа (ритуксимаб)17.
Чтобы выбрать наиболее эффективную и безопасную дозу препарата Газива, было проведено исследование I/II фазы. В нем участвовали пациенты с ХЛЛ, фолликулярной лимфомой, мантийноклеточной лимфомой, ДВКЛ и болезнью Вальденстрема, которые получали различные дозы препарата Газива. При сопоставлении фармакокинетических данных установлено, что наилучшая насыщаемость мишеней происходит при введении 1600 мг в 1-й и 8-й дни первого курса и 800 мг в 1-й день последующих курсов терапии. Однако фиксированная доза 1000 мг один раз в 28 дней оказывает такой же эффект при проведении дополнительных инфузий на 8-й и 15-й дни первого курса терапии. Именно поэтому была выбрана фиксированная доза 1000 мг, которая обладает оптимальной эффективностью и снижает риск ошибок18.
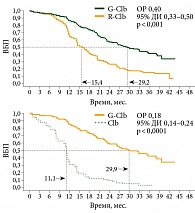
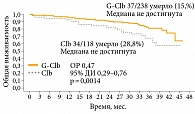
В открытом многоцентровом рандомизированном сравнительном исследовании III фазы CLL11 у пациентов с нелеченым ХЛЛ и сопутствующими заболеваниями сравнивали эффективность комбинации Газивы и хлорамбуцила с комбинацией Мабтеры и хлорамбуцила и с монотерапией хлорамбуцилом19. В исследование был включен 781 пациент с неблагоприятным соматическим статусом. Полученные результаты продемонстрировали преимущество комбинации Газивы и хлорамбуцила перед другими схемами лечения. Общий ответ в группе Газивы и хлорамбуцила составил 78,4%, из них полная ремиссия достигнута в 16,5% случаев, в группе Мабтеры и хлорамбуцила – 65%, из них полные ремиссии – в 4,9% случаев, а при монотерапии хлорамбуцилом – 31,4% при отсутствии случаев полной ремиссии20. Комбинация Газивы и хлорамбуцила достоверно увеличивала беспрогрессивную выживаемость более чем на год по сравнению с комбинацией Мабтеры и хлорамбуцила (29,2 против 15,7 месяца; отношение рисков (ОР) 0,40; 95%-ный доверительный интервал (ДИ) 0,33–0,50; р < 0,001) и более чем на полтора года по сравнению с монотерапией хлорамбуцилом (29,9 против 11,1 месяца; ОР 0,18; 95% ДИ 0,14–0,24; р < 0,0001) (рис. 2)21. Медиана общей выживаемости пока не достигнута ни в одной из групп сравнения, однако уже продемонстрировано достоверное преимущество комбинации Газивы и хлорамбуцила перед монотерапией хлорамбуцилом по данному показателю (ОР 0,47; 95% ДИ 0,29–0,76; р = 0,0014) (рис. 3)21.
Согласно анализу частоты побочных эффектов двух комбинаций, добавление Газивы приводит к более частым инфузионным реакциям и тромбоцитопении по сравнению с Мабтерой19.
Положительные итоги клинического исследования СLL11 послужили основанием для одобрения FDA использования биологического препарата Газива в комбинации с хлорамбуцилом в терапии ХЛЛ. В настоящее время препарат включен в рекомендации Национальной всеобщей онкологической сети (National Comprehensive Cancer Network – NCCN) по лечению ХЛЛ без неблагоприятных хромосомных аномалий в качестве терапии первой линии для пациентов ≥ 70 лет или более молодых пациентов с сопутствующими заболеваниями или ослабленных пациентов со значительными сопутствующими заболеваниями, не способных переносить аналоги пуринов. В рекомендациях Европейского общества медицинской онкологии (European Society for Medical Oncology – ESMO) комбинация Газивы и хлорамбуцила рекомендована для первой линии терапии ХЛЛ у пациентов со значимой коморбидностью и отсутствием делеции/мутации ТР53. Газива также включена в Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний для терапии пациентов преклонного возраста.
Возможно, итоги продолжающегося исследования GREEN по оценке эффективности Газивы в комбинации с различными режимами химиотерапии у нелеченых пациентов и пациентов с рецидивирующим ХЛЛ позволят расширить рекомендации по применению препарата Газива.
Далее Т.Е. Бялик детально остановилась на способах применения препарата Газива в комбинации с хлорамбуцилом, акцентировав внимание на режимах дозирования:
-
1000 мг внутривенно в 1-й, 8-й и 15-й дни 28-дневного цикла (цикл 1);
-
1000 мг внутривенно в 1-й день каждого последующего 28-дневного цикла (циклы 2–6).
Введение первой дозы препарата в первом цикле терапии следует разделить на два этапа: 1-й день – 100 мг, 2-й день – 900 мг.
Таким образом, Газиву вводят в течение шести циклов (девять введений), каждый цикл длится 28 дней.
Премедикацию глюкокортикостероидами проводят за 60 минут перед инфузией Газивы, а антигистаминными и нестероидными противовоспалительными препаратами – за 30 минут перед инфузией.
Введение первых 1000 мг препарата Газива проводится следующим образом:
-
инфузию первых 100 мг проводят со скоростью 25 мг/ч, она длится четыре часа;
-
инфузию оставшихся 900 мг начинают с 50 мг/ч и увеличивают скорость на 50 мг/ч каждые 30 минут до максимальной скорости 400 мг/ч.
Заключение
Результаты ряда исследований показали, что фиксированная доза препарата Мабтера для подкожного введения, равная 1400 мг, соответствует по безопасности и эффективности расчетной дозе, используемой при внутривенном введении препарата при неходжкинских лимфомах.
Серьезным прорывом в лечении пациентов с ХЛЛ стало применение первого гликоинженерного моноклонального анти-CD20 антитела 2-го типа Газивы. Препарат Газива в комбинации с хлорамбуцилом предоставляет пациентам с ХЛЛ и сопутствующими заболеваниями доказанные преимущества в выживаемости, не нарушая качество жизни, и рекомендован для применения в первой линии терапии ХЛЛ у данной группы пациентов в рамках основных мировых и российских рекомендаций по терапии лимфопролиферативных заболеваний.

