количество статей
6422
Пожалуйста, авторизуйтесь:
Теория
О профилактической, лечебной и избыточной дозе омега-3 полиненасыщенных жирных кислот в прегравидарный период, во время беременности и кормления грудью
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 4 (45)
- Аннотация
- Статья
- Ссылки
- English
Препараты на основе высокоочищенных стандартизированных форм омега-3 полиненасыщенных жирных кислот представляют собой один из наиболее перспективных, но малоиспользуемых резервов для профилактики патологий беременности и осложняющих беременность соматических заболеваний. Высокая эффективность и безопасность терапевтического применения стандартизированных омега-3 полиненасыщенных жирных кислот обусловлена наличием параллельных молекулярных механизмов регуляторного воздействия омега-3 полиненасыщенных жирных кислот на воспаление, функцию эндотелия, коагуляцию, агрегацию тромбоцитов, вазоспазм (в том числе спиральных артерий плаценты). Эффективное лечебное воздействие омега-3 полиненасыщенных жирных кислот может быть осуществлено только при поступлении в организм достаточного их количества (900–1200 мг/сут) в таких формах, как докозагексаеновая и эйкозапентаеновая кислоты. В статье рассмотрены данные клинических исследований по использованию профилактических доз (до 300 мг/сут) омега-3 полиненасыщенных жирных кислот, направленных на достижение желаемых терапевтических эффектов.
Введение
Омега-3 полиненасыщенные жирные кислоты (ПНЖК) (в форме докозагексаеновой (ДГК) и эйкозапентаеновой (ЭПК) кислот) не только с успехом обеспечивают нормальное течение беременности, но и эффективно используются в профилактике и лечении осложнений беременности. Результаты когортных многоцентровых исследований дают основание применять омега-3 ПНЖК для профилактики и в терапии акушерских осложнений (привычное невынашивание [1], преждевременные роды, тромбофилические нарушения с развитием плацентарной недостаточности, задержка внутриутробного развития), а также в лечении послеродовых депрессий [2].
ПНЖК трансформируются посредством каскада арахидоновой кислоты. Однако в отличие от самой арахидоновой кислоты омега-3 ПНЖК ингибируют ее каскад, предотвращая синтез провоспалительных молекул. Омега-3 ПНЖК противостоят провоспалительным эффектам арахидоновой кислоты путем вытеснения, конкурентного ингибирования и непосредственного противодействия. В результате этого уменьшается синтез простагландинов, тромбоксанов и лейкотриенов и снижается воспаление [3]. В экспериментальных исследованиях были выявлены дополнительные физиологические эффекты омега-3 ПНЖК: уменьшение экспрессии эндотелиальных молекул адгезии, подавление хемотаксиса, активация лейкоцитов (вследствие снижения провоспалительных цитокинов) и нормализация нарушенного ритма сокращений сердца.
Противовоспалительное, антитромбозное, антиапоптотическое и антиоксидантное действие омега-3 ПНЖК [4] может быть осуществлено только при условии достаточного суточного потребления нутриента (из пищи или путем дополнительного приема специальных препаратов). В этой связи во многих странах введены нормы потребления омега-3 ПНЖК как эссенциального микронутриента, в том числе во время беременности. Согласно международным рекомендациям необходимое количество омега-3 ПНЖК колеблется от 0,5–2 до 3 г/сут. При этом содержание таких форм омега-3 ПНЖК, как ЭПК и ДГК, должно быть не менее 500 мг/сут в соотношении 2 : 1 [5].
По результатам независимого опроса, в России препараты омега-3 ПНЖК принимают не более 1% беременных. Точных данных, к сожалению, нет (в настоящее время проводится скрининг-исследование по оценке потребления омега-3 ПНЖК в рационе питания беременных в Ивановской государственной медицинской академии). Можно предположить, что ситуация с потреблением омега-3 ПНЖК беременными в среднем по России сравнима с таковой в развивающихся странах [6–11].
Принимая во внимание низкую обеспеченность большинства беременных омега-3 ПНЖК, необходимость использования специальных препаратов на основе омега-3 ПНЖК очевидна. В настоящее время остро стоит вопрос выбора наиболее подходящего препарата и, что не менее важно, оптимальной дозировки этого препарата в каждом конкретном случае.
Заметим, что традиционная осторожность в отношении внедрения новых лекарственных препаратов в акушерско-гинекологическую практику часто переносится на нутритивные препараты на основе витаминов, микроэлементов, омега-3 ПНЖК. Так, если применение омега-3 ПНЖК для профилактики сердечно-сосудистой патологии исследуется уже более 30 лет и имеет уровень доказательности класса А, то в акушерстве эти препараты только начинают внедряться.
В настоящей работе приведены данные клинических и доказательных исследований, свидетельствующие о перспективах использования определенных дозировок стандартизированных лекарственных средств, содержащих омега-3 ПНЖК, для нутритивной поддержки беременности.
Общетерапевтическое применение определенных дозировок омега-3 ПНЖК в различных группах пациентов
В целом терапевтическая доза омега-3 ПНЖК для взрослых (старше 18 лет) составляет 1000–3000 мг/сут. Дозы 1000–1500 мг/сут могут успешно использоваться в терапии таких заболеваний, как инфаркт миокарда, синдром поликистозных яичников и дегенерация макулы.
Наиболее изучено применение омега-3 ПНЖК в кардиологической практике. По данным рандомизированных исследований типа «случай – контроль» и проспективных исследований, прием омега-3 ПНЖК действительно снижал риск инфаркта миокарда и внезапной остановки сердца [12]. Например, в исследовании GISSI-Prevenzione (n = 11 324, три с половиной года наблюдения) этиловые эфиры омега-3 ПНЖК эффективно снижали смертность у пациентов после недавнего инфаркта миокарда. Положительный эффект приема омега-3 ПНЖК в дозах порядка 1000 мг/сут наблюдался вне зависимости от сопутствующих патологий, привычек или других видов терапевтического вмешательства [13].
Синдром поликистозных яичников – распространенное расстройство эндокринной функции у женщин, связанное с существенным повышением риска сахарного диабета 2 типа и сердечно-сосудистых заболеваний. Прием 1200 мг/сут омега-3 ПНЖК (четыре капсулы по 180 мг ЭПК + 120 мг ДГК) или плацебо в течение восьми недель значительно увеличивал сывороточные уровни адипонектина (р = 0,003), вызывал снижение повышенных уровней глюкозы (р < 0,001), инсулина (р = 0,002), общего холестерина (р = 0,002) и холестерина липопротеинов низкой плотности (р = 0,003) по сравнению с плацебо. Сывороточные уровни триглицеридов также значительно снизились (р = 0,024), а уровни липопротеинов высокой плотности увеличились (р = 0,018) [14].
Омега-3 ПНЖК – эссенциальный нутриент, необходимый для нормального развития нервной системы и зрительного анализатора плода и новорожденного. Каждый год возрастает число детей с нарушениями функции зрения и перинатальной энцефалопатией – заболеваниями, во многом обусловленными дефицитом омега-3 ПНЖК [15]. Данные доказательной медицины указывают на значительное увеличение остроты зрения новорожденных при приеме ПНЖК. У детей, чьи матери получали ПНЖК (ДГК) во время беременности и лактации, отмечается более высокая острота зрения [16]. Кроме того, терапевтическая доза омега-3 ПНЖК 1000 мг/сут может успешно использоваться для остановки процесса макулярной дегенерации. Установлено, что ежедневный прием ДГК 840 мг + ЭПК 270 мг в течение трех лет приводил к накоплению омега-3 ПНЖК в эритроцитах и снижению заболеваемости хориоидной неоваскуляризацией глаза [17].
Более высокие дозы омега-3 ПНЖК (2000–3000 мг/сут) используются в терапии таких тяжелых заболеваний, как геморрагический инсульт и сахарный диабет 2 типа. В рандомизированном исследовании пациенты, перенесшие хирургическое вмешательство в течение 72 часов с момента появления субарахноидального кровоизлияния, получали 2700 мг/сут ЭПК в течение 30 суток после операции. Многофакторный анализ показал, что скорректированное отношение шансов составляет 0,39 (95% ДИ 0,17–0,89, р = 0,028) для симптоматического вазоспазма при приеме данной дозы ЭПК [18].
Из омега-3 ПНЖК образуется широкий спектр противовоспалительных молекул – резолвинов, способствующих нормальному физиологическому процессу прекращения воспаления при сахарном диабете. Например, прием омега-3 ПНЖК 2720 мг/сут (1548 мг ЭПК + 828 мг ДГК + 338 мг других омега-3 ПНЖК, всего три капсулы в день) в рандомизированном исследовании способствовал снижению провоспалительных интерлейкина 2, фактора некроза опухоли альфа в плазме крови в группе 84 пациентов (45–85 лет) с сахарным диабетом 2 типа по сравнению с контролем (р < 0,01) [19].
Заметным терапевтическим эффектом обладают и более низкие дозы омега-3 ПНЖК. Так, прием ДГК в течение шести месяцев в дозах 250 и 500 мг/сут в группе 60 детей с неалкогольной жировой болезнью печени достоверно по сравнению с плацебо снижал степень тяжести течения заболевания. При этом дозы 250 и 500 мг/сут в равной степени уменьшали выраженность стеатоза печени. Эффект приема препарата сохранялся практически неизменным по крайней мере в течение последующих 18 месяцев (p = 0,02) [20].
Различные дозировки омега-3 ПНЖК при беременности
Состав ПНЖК влияет на рост и состав тела плода. Ежедневный прием 1200 мг омега-3 ПНЖК в группе 208 здоровых беременных женщин на ранних сроках беременности достоверно повышал уровень ДГК в эритроцитах. Вместе с тем более высокий уровень ДГК в эритроцитах на 32-й неделе беременности положительно коррелировал с нормальной (а не пониженной) массой тела плода при рождении [21]. Следует отметить, что избыток омега-3 ПНЖК (превышение суточных доз более чем в четыре раза) при беременности нежелателен. В исследовании с участием 2109 беременных была установлена возможность снижения массы тела плода при рождении (на 23–166 г) на фоне приема очень высоких доз омега-3 ПНЖК (более 3–5 г/сут), то есть при превышении суточных потребностей в четыре – десять раз. При приеме 420 мг ЭПК + 1620 мг ДГК (шесть капсул по 70 мг ЭПК + 270 мг ДГК) у пациентов с ожирением отмечено достоверно более выраженное снижение массы тела (p = 0,024) и индекса массы тела (p = 0,027), преимущественно у женщин [22].
В датском исследовании (n = 12 373) была установлена связь между низкими концентрациями омега-3 ПНЖК в плазме крови и более низким весом новорожденных, соотношение шансов составило 1 : 4 [23]. Исследование с участием 182 беременных показало, что увеличение уровня ПНЖК на 1% соответствовало увеличению срока вынашивания на 1,5 дня [24]. В другом исследовании (n = 533) прием 2700 мг/сут омега-3 ПНЖК также удлинял время гестации на 6,4 дня [25].
В другом исследовании 145 женщин принимали 1600 мг ЭПК + 1100 мг ДГК, что превышало суточную потребность в 34 раза. Было установлено, что распространенность пищевой аллергии была ниже в группе омега-3 ПНЖК по сравнению с группой плацебо (2 и 15% соответственно, р < 0,05). Распространенность IgE-экземы в группе, получавшей омега-3 ПНЖК, составила 8%, а в группе плацебо – 24% (р < 0,05) [26, 27].
Омега-3 ПНЖК в лечении тромбофилии у беременных
Нарушения процессов регуляции воспаления и тромбофилия играют основную роль в развитии патологий беременности. Фармакотерапия традиционно включает дипиридамол (антиагрегант), аспирин (антиагрегантное и отчасти противовоспалительное действие), антикоагулянтную терапию (препараты микродозированного гепарина). Прием этих препаратов дает определенную нагрузку на выводящие системы организма (печень и почки) и в ряде случаев сопровождается побочными эффектами. Кроме того, у некоторых пациенток эффект от подобной терапии не наблюдается. Таким образом, актуальность поиска эффективных и безопасных средств, снижающих воспаление и тромбофилию, очевидна.
Прием в течение четырех недель 1200 мг/сут омега-3 ПНЖК преимущественно в форме ЭПК (1000 мг ЭПК + 200 мг ДГК) или преимущественно в форме ДГК (200 мг ЭПК + 1000 мг ДГК) приводил к достоверному уменьшению агрегации по сравнению с плацебо (-12%, р = 0,016). При этом ЭПК в большей степени уменьшала агрегацию тромбоцитов у мужчин (-18%, p = 0,005), а ДГК – у женщин (-19%, p = 0,001) [28].
Прием 640 мг/сут омега-3 ПНЖК (520 мг ДГК + 120 мг ЭПК) в течение четырех недель в группе 40 здоровых добровольцев и 16 пациентов с сердечно-сосудистыми заболеваниями существенно уменьшал аденозиндифосфат-индуцированную (р = 0,036) и адреналин-индуцированную (р = 0,013) агрегацию тромбоцитов [29].
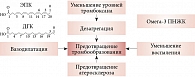
Механизмы воздействия омега-3 ПНЖК на различные патофизиологические процессы, приводящие в конечном счете к тромбоэмболии, основаны на исследованиях по фундаментальной медицине и экспериментальной фармакологии (рисунок) [30]. По данным многочисленных экспериментальных и клинических исследований, омега-3 ПНЖК существенно снижают агрегационную способность тромбоцитов, значительно улучшают параметры коагуляции (протромбиновое время, активированное частичное тромбопластиновое время, уровень фибриногена, активность факторов II, V, VII, VIII, IX, X, XI, XII и антитромбина III) и параметры фибринолиза (плазминоген, тканевый активатор плазминогена, альфа-2-ингибитор плазмина и ингибитор активатора плазминогена). На фоне приема омега-3 ПНЖК снижаются уровни триглицеридов в плазме и активации тромбоцитов, агрегации тромбоцитов, а также плазменные уровни фибриногена и фактора V [31].
Тридцать здоровых добровольцев получали ЭПК и ДГК всего 3400 мг/сут в течение 28 дней. Омега-3 ПНЖК не столько снижали уровни тромбоцитов (на 6,3%), сколько уменьшали активацию тромбоцитов посредством коллагена (на 50%) [32].
Повышенные уровни гомоцистеина, фактора VIII и фактора Виллебранда в плазме крови являются факторами риска тромбоэмболии и в значительной мере зависят от адекватности пищевого рациона. В проспективном исследовании ARIC в течение 12 лет наблюдали 14 962 взрослых среднего возраста. За этот срок было зарегистрировано 196 случаев венозной тромбоэмболии. Потребление рыбы один или более раз в неделю коррелировало с 30–45%-ным снижением риска тромбоэмболии, в то время как потребление красного жареного мяса двукратно повышало риск венозной тромбоэмболии [33].
Использование стандартизированных форм омега-3 ПНЖК перспективно в комбинированной терапии, направленной на снижение риска атеросклероза и протромботических состояний. Группа из 42 пациентов с сочетанной гиперлипидемией (уровень триглицеридов сыворотки 2,0–15,0 ммоль/л, сывороточный холестерин > 5,3 ммоль/л) после трехмесячного периода нормализации диеты получали лечение аторвастатином 10 мг/сут в течение 10 недель. В течение последних пяти недель пациенты были рандомизированы на две группы: в первой группе дополнительно назначали омега-3 ПНЖК по 1680 мг/сут, во второй – плацебо (кукурузное масло). Дополнительный прием препарата омега-3 ПНЖК вызвал дальнейшее снижение концентрации фактора FVIIa, а также уровня и активности фактора FVII [34].
Омега-3 ПНЖК уменьшают активность тромбоцитов и у пациентов со стабильной ишемической болезнью сердца, перенесших чрескожное коронарное вмешательство. Группа из 62 пациентов, получавших стандартную антиагрегантную терапию (аспирин 75 мг/сут, клопидогрел в нагрузочной дозе 600 мг, затем по 75 мг/сут), были рандомизированы на две группы: получение дополнительной дотации этилового эфира омега-3 в количестве 1000 мг/сут (n = 32) или плацебо (n = 30). Функция тромбоцитов была измерена трансмиссионной световой агрегометрией с аденозиндифосфатом и арахидоновой кислотой в качестве стимуляторов тромбообразования. После одного месяца лечения омега-3 ПНЖК максимальная агрегация тромбоцитов, вызванная 20 мкмоль/л аденозиндифосфата, была на 10% ниже по сравнению с контрольной группой (р = 0,029) [35].
В исследовании когорты из 485 пациентов со стабильной ишемической болезнью сердца все участники принимали низкие дозы аспирина (от 75 до 162 мг/сут) в течение одной недели. Пациенты были обследованы на аспирин-резистентность с использованием анализа VerifyNow Aspirin и тестов на агрегацию тромбоцитов. Аспирин-резистентность устанавливалась при наличии двух из трех критериев:
1) балл по шкале VerifyNow более 550;
2) агрегация тромбоцитов, вызванная 0,5 мг/мл арахидоновой кислоты, ≥ 20%;
3) агрегация тромбоцитов, вызванная 10 мкмоль/л аденозиндифосфата, ≥ 70%.
У 30 (6,2%) пациентов была выявлена аспириновая резистентность. Они были рандомизированы на получение либо низких доз аспирина и омега-3 ПНЖК (4 г/сут), либо аспирина в дозе 325 мг/сут. После 30 дней лечения пациенты прошли повторное обследование. В обеих группах наблюдалось значительное сокращение числа пациентов с резистентностью к аспирину, снижение уровней тромбоксана В2 в плазме (на 57% в группе принимавших омега-3 и на 40% в группе принимавших аспирин) [36].
В итальянском исследовании было установлено, что эффективность омега-3 ПНЖК сравнима с эффективностью малых доз аспирина у женщин с антифосфолипидным синдромом. Роды в срок произошли у 80% женщин, принимавших аспирин, и у 74% женщин, принимавших омега-3 ПНЖК [37]. Представляется перспективным изучение совместного назначения малых доз аспирина и омега-3 ПНЖК с целью повышения эффективности терапии антифосфолипидного синдрома.
В Научно-исследовательском институте акушерства и гинекологии им. Д.О. Отта РАМН (Санкт-Петербург) проанализирован клинический опыт использования капсул «9 месяцев. Омегамама» у беременных с высоким риском развития сосудистых осложнений и у беременных с гестозом легкой/средней степени в третьем триместре. В основной группе пациентки принимали добавку «9 месяцев. Омегамама» (две капсулы два раза в день, постоянно в течение всего третьего триместра). В контрольной группе проводилась стандартная комплексная профилактика эндотелиальной дисфункции тем или иным поливитаминным комплексом (Элевитом, Витрумом, Мульти-табсом – одна таблетка в день постоянно, Магне В6 Форте – по одной таблетке три раза в день, не менее одного месяца в триместр).
В основной группе гестоз отсутствовал в 53% случаев, легкая форма гестоза зарегистрирована у 47% беременных, в группе сравнения – 16 и 72% соответственно. Кроме того, если в основной группе формы гестоза средней и тяжелой степени не наблюдались, то в группе сравнения случаи гестоза средней степени отмечены у 8% пациенток, а тяжелой степени – у 4%.
Капсулы «9 месяцев. Омегамама» значимо нормализовали липидный профиль и коагулограмму пациенток по сравнению с группой контроля. В частности, снижались уровни триглицеридов (от 342 ± 15 до 308 ± 13 мл/дл), общего холестерина (от 272 ± 6 до 243 ± 5 мг/дл), повышался уровень холестерина липопротеинов высокой плотности (от 52 ± 2 до 59 ± 2 мг/дл). На фоне приема омега-3 ПНЖК достоверно увеличилось время свертывания (с 27± 0,7 до 36 ± 0,5 с) и снизились уровни фибриногена (с 5,8 ± 0,2 до 4,1 ± 0,1 г/л).
Следует отметить: на фоне стандартной терапии преждевременное родоразрешение имело место в 22% случаев, а при приеме капсул «9 месяцев. Омегамама» – только у 12,5% женщин. Состояние новорожденных по шкале Апгар оценивалось в среднем в 5,5 ± 2 балла в контрольной группе и 7,3 ± 0,5 балла в основной. Прием капсул «9 месяцев. Омегамама» способствовал достоверной нормализации массы тела новорожденного (в среднем 2457 ± 48 г в основной группе и 2075 ± 56 г в группе сравнения). Кроме того, 15% новорожденных, матери которых не получали поддержку омега-3 ПНЖК, находились на искусственной вентиляции легких, в то время как ни один ребенок в основной группе не имел показаний для проведения искусственной вентиляции легких [38].
Выбор препаратов омега-3 ПНЖК для беременных: практические рекомендации
В России компенсация микронутриентной недостаточности у беременных, как правило, осуществляется специализированными витаминно-минеральными комплексами (Элевит Пронаталь, Витрум Пренатал форте, Компливит Мама). В последнее время появились витаминно-минеральные комплексы для беременных, содержащие от 90 до 200 мг омега-3 ПНЖК в правильной, так называемой акушерской пропорции (содержание ДГК превышает содержание ЭПК). Однако такие количества омега-3 ПНЖК ориентированы на дополнение хорошего (с точки зрения содержания омега-3) рациона питания у женщин, не имеющих соматической патологии и патологии беременности. В то же время стандартизированные по ДГК и ЭПК препараты омега-3 ПНЖК, имеющие доказательную базу эффективного применения, используются нечасто.
Европейский сертификат качества для применения у беременных имеет субстанция MEG-3 (DSM, Швейцария) и производимая на основании этой субстанции добавка «9 месяцев. Омегамама». Следует подчеркнуть, что DSM имеет не только европейский статус фармацевтической субстанции, но и европейский сертификат фармакологического качества Ph/Eur для применения у беременных.
ПНЖК в добавке «9 месяцев. Омегамама» представлены практически полностью в виде ДГК (соотношение ДГК : ЭПК – 7 : 1), что оптимально для матери и важно для обеспечения оптимального нервно-психического развития будущего ребенка [15]. ДГК- и ЭПК-субстанции защищены от окисления посредством добавления альфа-, бета- и гамма-токоферолов, аскорбилпальмитата и лимонной кислоты. Субстанция приготовляется на основе экстракта жира из анчоусов и сардин. Эти виды рыб имеют короткий жизненный цикл и практически не накапливают токсичных металлов (ртуть, кадмий и т.д.). В двух капсулах добавки «9 месяцев. Омегамама» содержится 300 мг ПНЖК, что соответствует рекомендованной суточной потребности в ПНЖК (200–400 мг) и 40% рекомендованной суточной потребности в ДГК (700 мг).
В 2012 г. Российское общество акушеров-гинекологов издало информационное письмо, регламентирующее индивидуальный подход к дозированию препаратов омега-3 ПНЖК для беременных (на примере добавки капсул «9 месяцев. Омегамама», поскольку «…омега-3 ПНЖК в Омегамаме представлены практически полностью в виде ДГК. Соотношение ДГК : ЭПК крайне высоко (7 : 1), что оптимально и для матери, и для развивающегося плода, так как ДГК обладает антиапоптотическими и иммуномодулирующими свойствами. Содержание омега-3 ПНЖК в одной капсуле Омегамамы составляет 150 мг…»).
При физиологической беременности рекомендовано использовать две капсулы добавки «9 месяцев. Омегамама» в сутки (300 мг омега-3 ПНЖК). При осложненной беременности и при сопутствующей соматической патологии дозу можно увеличить до шести – восьми капсул (900–1200 мг) в сутки. Российское общество акушеров-гинекологов также рекомендует обязательно включать прием капсул «9 месяцев. Омегамама» в комплекс терапевтических мер для профилактики фетоплацентарной недостаточности, преэклампсии и осложнений беременности.
Таким образом, при нормальной беременности и отсутствии соматической патологии витаминно-минеральные комплексы, не содержащие омега-3 ПНЖК, следует дополнять приемом двух капсул добавки «9 месяцев. Омегамама» (300 мг/сут). При использовании витаминно-минеральных комплексов, содержащих ту или иную дозу омега-3 ПНЖК (например, 200 мг омега-3 ПНЖК в Наталбене Супра или Фемибионе II), дополнительно следует принимать одну капсулу добавки «9 месяцев. Омегамама» в день (150 мг/сут).
При патологии беременности и соматической патологии использование любых витаминно-минеральных комплексов для беременных, в том числе содержащих ту или иную дозу омега-3 ПНЖК, следует дополнять приемом капсул «9 месяцев. Омегамама» так, чтобы суммарная доза омега-3 ПНЖК составляла от 900 до 1200 мг/сут (шесть – восемь капсул в сутки). Эта рекомендация хорошо себя показала при ведении сложных клинических случаев повторно беременных женщин с дефицитом соединительной ткани в анамнезе, у которых в первых родах родились дети с кистами головного мозга и неврологической патологией разной степени тяжести [39, 40].
Прием добавки «9 месяцев. Омегамама» от 900 мг/сут (две капсулы три раза в день) до 1200 мг/сут (две капсулы четыре раза в день) в сочетании с органическим магнием в виде цитрата магния в течение трех-четырех месяцев беременности приводил к редукции кист головного мозга, в ряде случаев вплоть до полного исчезновения. Адекватный (необходимый и достаточный) уровень потребления омега-3 ПНЖК в виде ДГК позволяет существенно улучшать прогноз беременности у женщин с отягощенным провоспалительным анамнезом, страдающих дисплазией соединительной ткани, улучшать прогноз жизни и нервно-психического и интеллектуального развития новорожденных.
Заключение
Следует отметить высокую безопасность использования омега-3 ПНЖК во время беременности. Омега-3 ПНЖК являются не просто фармацевтическим препаратом, а имеют статус эсссенциального микронутриента. Юридически установленными в Российской Федерации нормами предписано потребление 700 мг/сут омега-3 в форме ДГК и 600 мг/сут омега-3 в форме ЭПК. Широкое распространение дефицита потребления омега-3 ПНЖК (менее 30% от рекомендуемой суточной нормы) среди россиянок репродуктивного возраста ведет к нарушению регуляции процессов воспаления и формированию тромбофилии. Как следствие, эффективность противовоспалительной, антикоагулянтной и антиагрегантной фармакотерапии снижается. Именно поэтому использование высокоочищенных стандартизированных форм омега-3 ПНЖК весьма перспективно для преодоления резистентности конкретных пациенток к аспирину и другим антиагрегантам.
Для профилактики и лечения гестоза и тромбофилии у беременных рекомендуется использовать капсулы «9 месяцев. Омегамама», содержащие омега-3 ПНЖК преимущественно в виде ДГК. Кроме этого, прием капсул «9 месяцев. Омегамама» может быть рекомендован для коррекции неидеального уровня потребления беременными ДГК и ЭПК. В России у женщин с патологией беременности в виде тромбофилии, гестоза обеспеченность омега-3 ПНЖК в виде ДГК недостаточна для покрытия возрастающих потребностей в этом микронутриенте. Физиологическая обеспеченность ДГК – одно из определяющих условий для профилактики гестоза и тромбофилии у беременных; а также для развития мозга, зрения, иммунной системы плода.
1. Rump P., Mensink R.P., Kester A.D., Hornstra G. Essential fatty acid composition of plasma phospholipids and birth weight: a study in term neonates // Am. J. Clin. Nutr. 2001. Vol. 73. № 4. P. 797–806.
2. Hibbeln J.R. Seafood consumption, the DHA content of mothers' milk and prevalence rates of postpartum depression: a cross-national, ecological analysis // J. Affect. Disord. 2002. Vol. 69. № 1–3. P. 15–29.
3. Fritsche K. Fatty acids as modulators of the immune response // Annu. Rev. Nutr. 2006. Vol. 26. P. 45–73.
4. Gonzalez-Periz A., Planaguma A., Gronert K. et al. Docosahexaenoic acid (DHA) blunts liver injury by conversion to protective lipid mediators: protectin D1 and 17S-hydroxy-DHA // FASEB J. 2006. Vol. 20. № 14. P. 2537–2539.
5. Sanz París A., Marí Sanchis A., García Malpartida K. et al. Proposed profile of omega 3 fatty acids in enteral nutrition // Nutr. Hosp. 2012. Vol. 27. № 6. P. 1782–1802.
6. Peng Y., Zhou T., Wang Q. et al. Fatty acid composition of diet, cord blood and breast milk in Chinese mothers with different dietary habits // Prostaglandins Leukot. Essent. Fatty. Acids. 2009. Vol. 81. № 5–6. P. 325–330.
7. Mardones F., Urrutia M.T., Villarroel L. et al. Effects of a dairy product fortified with multiple micronutrients and omega-3 fatty acids on birth weight and gestation duration in pregnant Chilean women // Public Health Nutr. 2008. Vol. 11. № 1. P. 30–40.
8. Yakes E.A. Polyunsaturated fatty acid intake and status of breast fed and non-breast fed bangladeshi children 24–47 months of age [PhD thesis]. Davis: University of California, 2010.
9. Muthayya S., Dwarkanath P., Thomas T. et al. The effect of fish and omega-3 LCPUFA intake on low birth weight in Indian pregnant women // Eur. J. Clin. Nutr. 2009. Vol. 63. № 3. P. 340–346.
10. Parra-Cabrera S., Stein A.D., Wang M. et al. Dietary intakes of polyunsaturated fatty acids among pregnant Mexican women // Matern. Child Nutr. 2011. Vol. 7. № 2. P. 140–147.
11. Nyuar K.B., Min Y., Ghebremeskel K. et al. Milk of northern Sudanese mothers whose traditional diet is high in carbohydrate contains low docosahexaenoic acid // Acta Paediatr. 2010. Vol. 99. № 12. P. 1824–1827.
12. Richardson E.S., Iaizzo P.A., Xiao Y.F. Electrophysiological mechanisms of the anti-arrhythmic effects of omega-3 fatty acids // J. Cardiovasc. Transl. Res. 2011. Vol. 4. № 1. P. 42–52.
13. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial / Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico // Lancet. 1999. Vol. 354. № 9177. P. 447–455.
14. Mohammadi E., Rafraf M., Farzadi L. et al. Effects of omega-3 fatty acids supplementation on serum adiponectin levels and some metabolic risk factors in women with polycystic ovary syndrome // Asia. Pac. J. Clin. Nutr. 2012. Vol. 21. № 4. P. 511–518.
15. Громова О.А., Торшин И.Ю., Баранов А.А. и др. Роли различных форм омега-3 ПНЖК в акушерстве и неонатологии // Национальный проект «Здоровье». М., 2009.
16. Judge M.P., Harel O., Lammi-Keefe C.J. A docosahexaenoic acid-functional food during pregnancy benefits infant visual acuity at four but not six months of age // Lipids. 2007. Vol. 42. № 2. P. 117–122.
17. Souied E.H., Delcourt C., Querques G. et al. Oral docosahexaenoic acid in the prevention of exudative age-related macular degeneration: the nutritional AMD treatment 2 study // Ophthalmology. 2013. Vol. 120. № 8. P. 1619–1631.
18. Yoneda H., Shirao S., Nakagawara J. et al. A prospective, multicenter, randomized study of the efficacy of eicosapentaenoic acid for cerebral vasospasm: the EVAS study // World Neurosurg. 2014. Vol. 81. № 2. P. 309–315.
19. Malekshahi Moghadam A., Saedisomeolia A., Djalali M. et al. Efficacy of omega-3 fatty acid supplementation on serum levels of tumour necrosis factor-alpha, C-reactive protein and interleukin-2 in type 2 diabetes mellitus patients // Singapore Med. J. 2012. Vol. 53. № 9. P. 615–619.
20. Nobili V., Alisi A., Della Corte C. et al. Docosahexaenoic acid for the treatment of fatty liver: randomised controlled trial in children // Nutr. Metab. Cardiovasc. Dis. 2013. Vol. 23. № 11. P. 1066–1070.
21. Much D., Brunner S., Vollhardt C. et al. Effect of dietary intervention to reduce the n-6/n-3 fatty acid ratio on maternal and fetal fatty acid profile and its relation to offspring growth and body composition at 1 year of age // Eur. J. Clin. Nutr. 2013. Vol. 67. № 3. P. 282–288.
22. Munro I.A., Garg M.L. Prior supplementation with long chain omega-3 polyunsaturated fatty acids promotes weight loss in obese adults: a double-blinded randomised controlled trial // Food Funct. 2013. Vol. 4. № 4. P. 650–658.
23. Van Eijsden M., Hornstra G., van der Wal M.F. et al. Maternal n-3, n-6, and trans fatty acid profile early in pregnancy and term birth weight: a prospective cohort study // Am. J. Clin. Nutr. 2008. Vol. 87. № 4. P. 887–895.
24. Olsen S.F., Grandjean P., Weihe P. et al. Frequency of seafood intake in pregnancy as a determinant of birth weight: evidence for a dose dependent relationship // J. Epidemiol. Community Health. 1993. Vol. 47. № 6. P. 436–440.
25. Olsen S.F., Sorensen J.D., Secher N.J. et al. Randomised controlled trial of effect of fish-oil supplementation on pregnancy duration // Lancet. 1992. Vol. 339. № 8800. P. 1003–1007.
26. Warstedt K., Furuhjelm C., Duchen K. et al. The effects of omega-3 fatty acid supplementation in pregnancy on maternal eicosanoid, cytokine, and chemokine secretion // Pediatr. Res. 2009. Vol. 66. № 2. P. 212–217.
27. Furuhjelm C., Warstedt K., Larsson J. et al. Fish oil supplementation in pregnancy and lactation may decrease the risk of infant allergy // Acta Paediatr. 2009. Vol. 98. № 9. P. 1461–1467.
28. Phang M., Lincz L.F., Garg M.L. Eicosapentaenoic and docosahexaenoic acid supplementations reduce platelet aggregation and hemostatic markers differentially in men and women // J. Nutr. 2013. Vol. 143. № 4. P. 457–463.
29. McEwen B.J., Morel-Kopp M.C., Chen W. et al. Effects of omega-3 polyunsaturated fatty acids on platelet function in healthy subjects and subjects with cardiovascular disease // Semin. Thromb. Hemost. 2013. Vol. 39. № 1. P. 25–32.
30. Громова О.А., Торшин И.Ю., Керимкулова Н.В. и др. О возможности использования стандартизированных форм омега-3 ПНЖК в терапии и профилактике тромбофилий. Биоинформационный анализ данных молекулярной физиологии и доказательной медицины // Эффективная фармакотерапия. Акушерство и гинекология. 2012. № 5. С. 32–40.
31. Hashimoto M., Hossain S., Shido O. Docosahexaenoic acid but not eicosapentaenoic acid withstands dietary cholesterol-induced decreases in platelet membrane fluidity // Mol. Cell. Biochem. 2006. Vol. 293. № 1–2. P. 1–8.
32. Larson M.K., Shearer G.C., Ashmore J.H. et al. Omega-3 fatty acids modulate collagen signaling in human platelets // Prostaglandins Leukot. Essent. Fatty Acids. 2011. Vol. 84. № 3–4. P. 93–98.
33. Steffen L.M., Folsom A.R., Cushman M. et al. Greater fish, fruit, and vegetable intakes are related to lower incidence of venous thromboembolism: the longitudinal investigation of thromboembolism etiology // Circulation. 2007. Vol. 115. № 2. P. 188–195.
34. Nordøy A., Svensson B., Hansen J.B. Atorvastatin and omega-3 fatty acids protect against activation of the coagulation system in patients with combined hyperlipemia // J. Thromb. Haemost. 2003. Vol. 1. № 4. P. 690–697.
35. Gajos G., Rostoff P., Undas A. et al. Effects of polyunsaturated omega-3 fatty acids on responsiveness to dual antiplatelet therapy in patients undergoing percutaneous coronary intervention: the OMEGA-PCI (OMEGA-3 fatty acids after pci to modify responsiveness to dual antiplatelet therapy) study // J. Am. Coll. Cardiol. 2010. Vol. 55. № 16. P. 1671–1678.
36. Lev E.I., Solodky A., Harel N. Treatment of aspirin-resistant patients with omega-3 fatty acids versus aspirin dose escalation // J. Am. Coll. Cardiol. 2010. Vol. 55. № 2. P. 114–121.
37. Carta G., Iovenitti P., Falciglia K. Recurrent miscarriage associated with antiphospholipid antibodies: prophylactic treatment with low-dose aspirin and fish oil derivates // Clin. Exp. Obstet. Gynecol. 2005. Vol. 32. № 1. P. 49–51.
38. Мозговая Е.В., Малышева О.А., Иващенко Т.Э., Айламазян Э.К. Эндотелиальная дисфункция при гестозе. СПб.: НИИ акушерства и гинекологии им. Д.О. Отта РАМН, 2012.
39. Громова О.А., Керимкулова Н.В., Никифорова Н.В. и др. Течение беременности и ее исход на фоне дефицита соединительной ткани с использованием нутрициальной коррекции омега-3 ПНЖК и цитратом магния. Случаи из практики // www.9-mes.ru/spec/st_1.
40. Громова О.А., Торшин И.Ю., Егорова Е.Ю. Интеллектуальные способности: омега-3 ПНЖК и когнитивное развитие детей // Практическая медицина. 2011. Т. 11. № 5. С. 16–21.
Regarding Prophylactic, Curative and Excessive Dose of Omega-3 Polyunsaturated Fatty Acids during Pregravidal Period, Pregnancy and Breastfeeding
O.A. Gromova, I.Yu. Torshin, O.A. Limanova, V.N. Serov
Ivanovsky State Medical Academy
Russian Center of the Institute of Trace Elements for UNESCO, Pirogov Russian National Research Medical University
Kulakov Research Center for Obstetrics, Gynecology, and Perinatology
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
Drugs containing highly purified standardized formulations of omega-3 polyunsaturated fatty acids represent one of the most promising yet underutilized reserve for prevention of pathologies of pregnancy and somatic diseasaes complicating pregnancy. High efficacy and safety of therapeutic usage of omega-3 polyunsaturated fatty acids are due to their intrinsic regulatory effects emerging via parallel molecular action on inflammation, function of endothelium, blood coagulation, platelet aggregation and angiospasm (including coiled arteries of the uterus). Effective curative impact of omega-3 polyunsaturated fatty acids may be exerted only under intake at sufficient amounts (900-1200 mg/day) in a form of docosahexaenoic and eicosapentaenoic acids. Here, the data of clinical studies of using omega-3 polyunsaturated fatty acids at prophylactic doses (up to 300 mg/day) aimed at obtaining desired therapeutic effects are discussed.
Новости на тему
СТАТЬИ по теме
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.