Окислительный стресс и старение. Роль витамина D в генезе ассоциированных с возрастом заболеваний
- Аннотация
- Статья
- Ссылки
- English

![Таблица 2. Корреляционные связи между недостаточностью витамина (гормона) D и возраст-ассоциированными заболеваниями [7, 13–16]](/upload/resize_cache/iblock/348/195_350_1/esparma3.jpg)
Введение
В последнее десятилетие особенно вырос интерес к антивозрастной медицине. Это неудивительно, поскольку ожидаемая продолжительность жизни населения Земли неуклонно растет и в целом ряде стран уже превышает 80 лет. Соответственно увеличивается частота возраст-ассоциированных болезней (так называемых болезней цивилизации). Сегодня человечество пришло к пониманию, что красота и молодость зависят не только от косметических средств, которые мы используем наружно. Ученые доказали, что красота идет изнутри. Регулярная физическая активность, рациональное питание с высоким содержанием пищевых волокон и витаминов, отказ от вредных привычек – основа хорошего самочувствия и долголетия. Однако в современном постоянно меняющемся мире этого оказывается недостаточно.
Роль окислительного стресса в старении организма
В настоящее время предложено множество теорий старения, выявлены различные пагубные процессы, со временем развивающиеся в организме, и разработаны методы их торможения. Одной из основных гипотез старения является теория окислительного стресса [1, 2].
Окислительный стресс – это несостоятельность антиоксидантной системы организма, при которой клетки подвергаются воздействию чрезмерных уровней реактивных форм кислорода и других свободных радикалов. Свободные радикалы – нестабильные атомы и соединения, они действуют как агрессивные окислители и в результате повреждают жизненно важные структуры организма. Свободные радикалы образуются при влиянии неблагоприятных факторов окружающей среды (плохая экология, курение, хроническая интоксикация, ультрафиолетовое облучение). Кроме того, выработка свободных радикалов может увеличиваться при целом ряде возраст-ассоциированных заболеваний: сахарном диабете второго типа и инсулинорезистентности, ожирении, артериальной гипертонии, возрастном снижении половых гормонов (как у мужчин, так и у женщин), дефиците витамина D [3, 4].
Окислительный стресс возникает при нарастающем поступлении и/или образовании in vivo свободных радикалов и преобладании окислительных реакций над восстановительными. Образование свободных радикалов и свободнорадикальные реакции – физиологический процесс, неизбежно приобретающий патофизиологические черты по мере старения человека. Физиологичность заключается в том, что некоторые свободные радикалы (активные формы кислорода, перекиси) закономерно образуются:
-
при окислении жирных кислот как энергетического субстрата и в норме нейтрализуются антиоксидантной системой;
-
перекисном окислении липидов – необходимом процессе в обновлении фосфолипидов клеточных мембран;
-
индуцированном локальном окислительном стрессе (контакте иммунокомпетентных клеток с антигеном с целью его разрушения).
Физиологичность свободнорадикального окисления прекращается при лавинообразном нарастании окислительных процессов.
«Физиологическое» старение приводит к неизбежной кумуляции (накоплению) свободных радикалов и эффекту накопления мутаций в течение жизни. Несмотря на эффективную систему антиоксидантной защиты организма, уровень образования свободных радикалов при старении превосходит мощность антиоксидантного потенциала. Таким образом, наряду с дисфункцией транскрипции генов происходит прогрессивное нарастание окислительного стресса. Окислительный стресс следует рассматривать как неизбежный для каждого человека процесс – основную причину старения и возраст-ассоциированных заболеваний, в том числе сердечно-сосудистых, метаболических (ожирение и сахарный диабет второго типа) и онкологических, являющихся основными причинами смерти [5].
Как уже упоминалось, определенный вклад в развитие и прогрессирование окислительного стресса при старении организма вносит дефицит витамина D. Рассмотрим механизм этого взаимодействия подробнее.
Метаболизм витамина D и его роль в патогенезе возраст-ассоциированных заболеваний
Традиционные представления о витамине D связаны прежде всего с его ключевой ролью в кальциево-фосфорном обмене и влиянием на минеральную плотность костной ткани [6]. В последнее время произошло обогащение существующих представлений, и сегодня известно, что витамин D является по сути стероидным гормоном, обладающим целым рядом важных эффектов, которые крайне необходимы для обеспечения широкого спектра физиологических процессов и оптимального состояния здоровья человека.
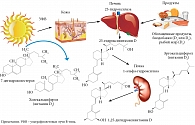
Термин «витамин D» включает целую группу веществ (табл. 1), из которых наиболее известны холекальциферол – витамин D3 и эргокальциферол – витамин D2. Витамин D3 синтезируется в коже человека и животных из 7-дегидрохолестерола (производного холестерина) под воздействием ультрафиолетовых В-лучей солнечного света и поступает в организм в основном из пищевых продуктов животного происхождения (рыбьего жира, сливочного масла, яиц, молока). Витамин D2 можно получить только из пищи растительного происхождения (дрожжей, хлеба, грибов, некоторых овощей).
Витамины D2 и D3 биологически инертны. Для активации и превращения в активную форму D-гормона в организме должны пройти два процесса химического превращения (гидроксилирования). Первый происходит преимущественно в печени и превращает витамин D3 в 25-гидроксивитамин D [25(OH)D], также известный как кальцидол. Второй происходит преимущественно в почках с участием фермента CYP27B1 – альфа-гидроксилазы, его результатом является синтез биологически активного 1,25-дигидроксивитамина D [1,25(OH)2D], или кальцитриола [7] (табл. 1, рис. 1). Ограничивает образование активной формы витамина стимуляция фермента CYP24A1 (24-гидроксилазы), который превращает кальцитриол в неактивную водорастворимую форму кальцитроевой кислоты, в дальнейшем выводимой из организма с желчью [6, 8].
В отличие от витаминов к активной форме витамина D (1,25(OH)2D, или кальцитриолу) в клетках различных органов и тканей выявлены специфические рецепторы (Vitamin D Receptors – VDR). Это позволяет классифицировать витамин D как D-гормон, функции которого состоят в способности генерировать и модулировать биологические реакции в тканях-мишенях за счет регуляции транскрипции генов [8, 9].
Новые представления о витамине D как о мощном стероидном гормоне привели к существенной переоценке его физиологической роли в организме человека в разные периоды жизни. Оказалось, что достаточный уровень D-гормона необходим от внутриутробного развития до самой глубокой старости. D-гормон регулирует крайне важные гены, отвечающие за синтез половых гормонов и регуляцию углеводного обмена, нарушение функции которых закономерно сопровождается низкой продолжительностью и качеством жизни.
Сегодня дефицит витамина (гормона) D – это новая метаболическая пандемия XXI в. Особенно подвержены развитию дефицита витамина D люди, проживающие севернее 35-й параллели (в Северном полушарии), что обусловлено недостаточным уровнем инсоляции большую часть года [7]. Согласно данным современных исследований, можно утверждать, что не менее 50% населения Земли имеют дефицит витамина D [10–12]. Среди лиц старшего возраста дефицит витамина D наблюдается уже в 80–90% случаев [7], что сопровождается развитием разнообразных возраст-ассоциированных заболеваний. Последние эпидемиологические и экспериментальные данные показали, что низкий уровень витамина D тесно связан с высоким риском общей смертности, сердечно-сосудистых и онкологических заболеваний (в основном рака молочной железы, простаты и толстого кишечника), саркопении (дефицита мышечной массы), ожирения, метаболического синдрома, а также инсулинорезистентности и сахарного диабета первого и второго типов (табл. 2) [13–16].
Дефицит витамина D может способствовать проявлению кардиометаболических факторов риска с помощью различных биологических путей. Так, витамин D может модулировать артериальное давление, подавляя ренин-ангиотензин-альдостероновую систему с помощью прямого воздействия на клетки эндотелия сосудов, оказывая ренопротективный эффект, а также влияя на метаболизм кальция [17–19].
Связь дефицита витамина D и развития сахарного диабета второго типа достаточно сложна. С одной стороны, витамин D непосредственно индуцирует секрецию инсулина бета-клетками за счет увеличения внутриклеточного уровня кальция с помощью неселективных потенциал-зависимых кальциевых каналов. Витамин D опосредованно активирует кальций-зависимую эндопептидазу бета-клеток, которая преобразует проинсулин в активный инсулин, а также участвует в механизмах промоции гена инсулина человека и обеспечивает активацию его транскрипции [20, 21]. С другой стороны, витамин D может влиять на чувствительность тканей к инсулину либо непосредственно, стимулируя экспрессию рецепторов инсулина в клетках, либо косвенно. Во втором случае увеличивается уровень внеклеточного кальция. Таким образом в тканях, зависимых от инсулина, повышается приток внутрь клетки кальция, необходимого для инсулин-опосредованных внутриклеточных процессов [22–24].
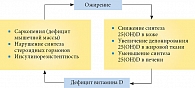
Витамин D находится в тесной взаимосвязи с половыми стероидами, которые также влияют на экспрессию генов инсулинового рецептора и его чувствительность [25]. Половые гормоны – важнейшие активаторы гена инсулинового рецептора, а тестостерон у представителей обоего пола обеспечивает метаболизм мышечной ткани – основного места утилизации глюкозы в организме. Существует точка зрения, что дефицит витамина D, приводя к дефициту половых гормонов, способствует нарушению соотношения жирозапасающих (пролактин, инсулин, кортизол) и жиросжигающих (гормон роста, катехоламины, половые гормоны, тиреоидные гормоны) факторов. Возникшее и прогрессирующее ожирение уменьшает уровень циркулирующего в крови 25(ОН)D в результате повышенного захвата кальцидола жировой тканью и снижения скорости гидроксилирования в печени из-за жирового гепатоза. Так формируется порочный круг патогенеза, характерный для ожирения (рис. 2) [26]. Доказано, что низкий уровень витамина D может рассматриваться как независимый предиктор формирования и прогрессирования ожирения, ведущего к инсулинорезистентности и сахарному диабету второго типа [27].
Витамин D также оказывает существенное влияние на синтез некоторых воспалительных цитокинов, препятствуя транскрипции ряда генов цитокинов, таких как интерлейкины 1, 6, фактор некроза опухоли альфа, или подавляя факторы транскрипции, участвующие в генерации цитокинов [28]. Предшествующие исследования показали экспрессию VDR в T- и В-лимфоцитах. В частности, экспрессия VDR была выражена только у иммунологически функционально активных пролиферирующих клеток, что позволяет предположить антипролиферативную роль 1,25(OH)2D для этих клеток [19, 30]. Таким образом, витамин D оказывает мощное модулирующее влияние на иммунную систему, а дефицит витамина D может вызывать системный воспалительный ответ, который является одним из основных кардиометаболических факторов риска, а также фактором риска развития онкологических заболеваний [31, 32].
Учитывая вышеизложенное, можно рекомендовать рутинную оценку уровня витамина D, особенно у тех, кто подвержен риску его дефицита, например пожилых людей, лиц с нарушением всасывания, страдающих ожирением, не имеющих возможности регулярного пребывания на солнце. Наиболее адекватным методом оценки достаточности витамина D является определение в крови его промежуточного метаболита 25-гидроксивитамина D [25(OH)D]. 25(OH)D в полной мере отражает суммарное количество витамина D, производимого в коже из 7-дегидрохолестерола под действием ультрафиолетовых B-лучей и получаемого из пищевых продуктов и пищевых добавок, и имеет довольно продолжительный период полураспада в крови – около 15 дней [7]. Золотым стандартом определения концентрации 25(ОН)D в крови во всем мире является метод тандемной хромато-масс-спектрометрии (мультистероидный анализ), который позволяет максимально точно (в отличие от наиболее распространенного радиоиммунного анализа) выявить дефицит или недостаточность витамина D. При подтверждении низкого уровня витамина D восполнение его дефицита может стать важным дополнительным методом лечения возраст-ассоциированных заболеваний.
Альфа-липоевая кислота в борьбе с окислительным стрессом
Поддержание гормонально-метаболического равновесия (в том числе нормальной концентрации витамина D в крови) несомненно является основополагающим направлением профилактики и лечения возраст-ассоциированных заболеваний, развивающихся на фоне окислительного стресса. Старение приводит к неизбежной кумуляции свободных радикалов, уровень образования которых превосходит мощность физиологического антиоксидантного потенциала. Защитить клетки от окислительного повреждения, восстановить нормальный окислительно-восстановительный баланс возможно путем приема антиоксидантов.
Альфа-липоевая, или тиоктовая, кислота и промежуточный продукт ее обмена – дигидролипоевая кислота относятся к самым эффективным эндогенным антиоксидантам [33]. Альфа-липоевая кислота была впервые выделена в 1951 г. L.J. Reed и его сотрудниками из бычьей печени и изначально носила название «витамин N», что подчеркивало ее значение для функции нервной ткани (витамины – незаменимые вещества, поступающие с пищей, N – «невро»). Однако витамином она не является по химической структуре, к тому же в небольшом количестве образуется в организме, что не позволяет причислить ее к абсолютно незаменимым жирным кислотам.
Альфа-липоевая кислота – кофермент как минимум двух дегидрогеназных комплексов цикла трикарбоновых кислот (цикла Кребса). Ключевое значение дефицита именно альфа-липоевой кислоты как кофермента доказано экспериментально в проведенных исследованиях и теоретически обосновано [5, 34, 35]. Дефицит альфа-липоевой кислоты возникает из-за того, что актуальный для других коферментов (витамины группы B, пантотеновая кислота) алиментарный способ поступления необходимых доз для нее невозможен: содержание этой кислоты в продуктах питания крайне мало. В условиях окислительного стресса отмечается повышенный расход альфа-липоевой кислоты, и ее суточная потребность для взрослого человека достигает около 300 мг в сутки [34, 35].
Альфа-липоевая кислота предотвращает свободнорадикальное повреждение клетки. Будучи мощным утилизатором свободных радикалов (супероксидного и гидроксильного радикалов, перекисных радикалов, синглетного кислорода и оксида азота), а также модулятором воспалительного процесса, альфа-липоевая кислота оказывает выраженный антивозрастной эффект [36].
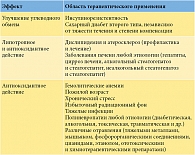
К сожалению, терапевтическая ценность этой кислоты недооценена, а показания к назначению необоснованно сужены. Исходя из представлений о биохимических свойствах альфа-липоевой кислоты, истории ее изучения и доказанной эффективности в лечении, в том числе невропатии любой этиологии, показания к ее применению должны быть значительно шире (табл. 3) [5]. Кроме того, альфа-липоевая кислота не только обладает универсальным антиоксидантным эффектом, но и повышает эффективность любой другой терапии.
Альфа-липоевая кислота – уникальный компонент борьбы со старением, крайне необходимый при проявлениях окислительного стресса. В отсутствие выраженных проявлений окислительного стресса альфа-липоевая кислота показана каждому человеку начиная с 35–40 лет, поскольку примерно с этого возраста естественная антиоксидантная защита организма начинает ослабевать. Средняя суточная терапевтическая доза альфа-липоевой кислоты, на наш взгляд, должна составлять 300–600 мг. В терапевтической практике традиционно используются таблетированные препараты альфа-липоевой кислоты, капсулы с альфа-липоевой кислотой и внутривенные инъекции. Одним из наиболее привлекательных по фармакоэкономическим показателям препаратом альфа-липоевой кислоты, представленным в России, является препарат Эспа-Липон.
Заключение
Необходимость приема эндогенных антиоксидантов в качестве основы профилактической и антивозрастной терапии не вызывает сомнений. Своевременная защита от проявлений окислительного стресса позволяет не только предупреждать и лечить возраст-ассоциированные заболевания, но и увеличивает продолжительность жизни и ее качество. Коррекция гормонально-метаболических нарушений (в том числе дефицита витамина D) наряду с назначением антиоксидантной терапии – это основополагающие направления борьбы с окислительным стрессом и старением.
S.Yu. Kalinchenko, D.A. Gusakova, L.O. Vorslov, Yu.A. Tishova, I.A. Tyuzikov, A.N. Nizhnik
Russian Peoples' Friendship University
Professor Kalinchenko Clinic (Moscow)
N.A. Lopatkin Urology and Interventional Radiology Research Institute – Branch of the National Medical Research Radiological Center
Clinic of Novel Medical Technologies ‘ArkhiMed’
Contact person: Darya Aleksandrovna Gusakova, dariagusakova@gmail.com
Modern understanding regarding a role of oxidative stress in development and progression of age-related diseases and aging as a whole are outlined in the current paper. Therapy with vitamin D-containing drugs according to the current studies on mechanism of its action and role of its deficiency in pathogenesis of cardiovascular diseases, obesity, insulin resistance, diabetes mellitus, and systemic inflammation is proposed as one of the components for prevention and treatment of such diseases. Special attention is paid to antioxidant therapy to fight against oxidative stress, with justifying a rational use of currently most efficient antioxidant such as alpha-lipoic acid in treatment and prevention of age-related diseases.

