Опыт применения препарата Дексалгин® при лечении острых скелетно-мышечных болевых синдромов
- Аннотация
- Статья
- Ссылки
Среди скелетно-мышечных болевых синдромов лидирующими по частоте обращаемости за медицинской помощью являются острые боли в спине. Показано, что из всех пациентов, предъявляющих жалобы на «боль в спине», боль в «верхней части» спины изолированно отмечается лишь у 15% [1]. По данным эпидемиологического исследования, проведенного в городской поликлинике г. Москвы, из 1300 первичных пациентов, обратившихся за амбулаторной медицинской помощью, 24,9% жаловались на боль в пояснично-крестцовой области [2]. Следует отметить, что эпидемиология боли в пояснично-крестцовой области изучена значительно лучше, чем боли в шейном или грудном отделах позвоночника [3].
При анализе первичной обращаемости к врачам общей практики по поводу острой боли в пояснично-крестцовой области ее скелетно-мышечные причины выявляются приблизительно у 85% пациентов. Предположительно, микротравматизация и растяжение мышцы при выполнении «неподготовленного движения» являются причинами боли у подавляющего большинства пациентов (> 70% случаев). «Дискогенная» боль и боль, связанная с дисфункцией дугоотростчатых суставов, отмечается у 10% пациентов. Компрессионная радикулопатия отмечается в 4%, а неврологические осложнения поясничного стеноза – в 3% случаев. Компрессионные переломы тел позвонков, связанные с остеопорозом, обнаруживаются у 4%, а спондилолистез – у 2% пациентов. Кроме этого, причиной боли в спине может быть травматическое поражение позвоночника, которое иногда приводит к переломам позвонков и разрывам дисков, но чаще – к растяжению капсулы суставов и связок позвоночного столба.
Основными потенциально опасными вертеброгенными причинами, которые отмечаются у 1% пациентов, обращающихся за медицинской помощью по поводу боли в спине, являются первичные и метастатические опухоли позвоночника (0,7% случаев), воспалительные (спондилоартриты) и инфекционные (туберкулез, дисцит) его поражения (0,3 и 0,01% случаев соответственно). Воспалительные спондилоартриты (анкилозирующий спондилит – болезнь Бехтерева, псориатический артрит, реактивные артриты и др.) нередко сопровождаются энтезитами – воспалением в местах прикрепления сухожилий или связок к кости [4].
Согласно определению Международной ассоциации по изучению боли (IASP), острая боль длится менее 3 месяцев, что соответствует периоду заживления тканей после повреждения. Эта боль, как правило, хорошо локализована и является необходимым биологическим приспособительным сигналом о начинающемся или произошедшем повреждении. Хроническая боль сохраняется длительный период времени (более 3 месяцев), часто даже после устранения причины, первоначально ее вызвавшей. Необходимо отметить, что острая, подострая и хроническая боль в спине – это состояния, которые отличаются подходами к диагностике и лечению, а также прогнозом на выздоровление и восстановление трудоспособности.
В отличие от хронической боли в спине, острая боль в пояснично-крестцовой области является доброкачественным и самоограничивающимся состоянием. Однако точный источник боли в спине выявляется с частотой около 15% без применения инвазивных диагностических вмешательств (например, блокад дугоотростчатых суставов с местным анестетиком). Трудность точного определения источника скелетно-мышечной боли была проиллюстрирована рядом исследований, показавших, что болевая импульсация от различных висцеральных структур, межпозвоночного диска, фасеточных суставов может имитировать отраженную боль и гипералгезию, сходную с таковой при миофасциальном болевом синдроме и описанную в ранних работах по экспериментальному раздражению мышц [5].
Однако основной задачей лечения острой скелетно-мышечной боли является купирование болевого синдрома (с помощью нестероидных противовоспалительных препаратов (НПВП), простых анальгетиков, миорелаксантов) и сохранение повседневной активности. Следовательно, направление пациента с острой болью в пояснично-крестцовой области для обследования узким специалистом (неврологом, травматологом, мануальным терапевтом и др.) и проведение диагностических блокад в каждом случае для выявления точного источника не являются оправданными. Диагностический поиск в случаях острой боли в спине целесообразно проводить между:
- потенциально опасными заболеваниями вертебрального и невертебрального происхождения (компрессия конского хвоста, травматическое, опухолевое, воспалительное и инфекционное поражение позвоночника, остеопороз и заболевания внутренних органов);
- компрессионной радикулопатией;
- доброкачественной скелетно-мышечной болью [6].
Последнюю в современных клинических рекомендациях нередко обозначают как «неспецифическую», подчеркивая одновременно и трудность установления источника болевой импульсации, и в то же время относительную нецелесообразность его точного выявления, так как это не оказывает принципиального влияния на успешность лечения [7]. Как правило, во многих зарубежных странах ведением пациентов с острой «неспецифической» болью в спине успешно занимаются врачи общей практики [8, 9]. В подавляющем числе случаев пациенты с острой болью в спине не нуждаются в проведении дополнительных инструментальных исследований. Однако наличие выраженных неврологических и соматических расстройств может потребовать срочного параклинического обследования. Так, слабость в мышцах ног, снижение чувствительности в аногенитальной области («седловидная анестезия»), тазовые нарушения указывают на наличие компрессии корешков конского хвоста и требуют незамедлительного проведения магнитно-резонансной (МРТ) или компьютерной томографии (КТ) позвоночника с последующим рассмотрением совместно с нейрохирургом вопроса о необходимости срочного оперативного вмешательства.
Иногда требуется проведение дополнительных методов обследования уже при первом обращении пациента, например, если отсутствует связь боли с движением, боль сохраняется в ночное время, в анамнезе имеются злокачественное новообразование, ВИЧ-инфекция, применение иммунодепрессантов, внутривенных инфузий, беспричинное снижение веса, лихорадка и ночной гипергидроз, а также если возраст больного младше 20 и старше 50 лет. Во всех перечисленных случаях с целью исключения, в первую очередь, инфекционного и опухолевого поражения позвоночника необходима рентгенография позвоночника в прямой и боковой проекциях, исследование общего анализа крови и мочи, а при подозрении на остеомиелит, эпидуральный абсцесс и поражение корешков конского хвоста – дополнительное проведение КТ или МРТ пояснично-крестцового отдела позвоночника.
При необходимости уточнения состояния костных структур (при подозрении на онкологическое заболевание) в ряде случаев после проведения рентгенографии показана сцинтиграфия. При подозрении на злокачественное новообразование предстательной железы необходимо определить уровень простатспецифического антигена. При наличии травмы в недавнем анамнезе (падение с высоты, дорожно-транспортные происшествия и т.п.), а также при длительном применении кортикостероидов и возрасте пациентов старше 55 лет необходимо провести рентгенографию позвоночника, а при недостаточной ее информативности и сохранении боли свыше 10 дней – сцинтиграфию или КТ позвоночника.
Показания для костной денситометрии имеются у всех женщин в возрасте старше 65 лет, у женщин в постменопаузальном периоде моложе 65 лет при наличии факторов риска, у мужчин старше 70 лет, у взрослых с переломами костей при минимальной травме, при заболеваниях или состояниях, приводящих к снижению минеральной плотности костной ткани, приеме препаратов, снижающих костную массу. Всем пациентам с острым болевым синдромом длительностью свыше 1 месяца, а также всем больным с хроническими болями в спине показано проведение рентгенографии позвоночника в прямой и боковой проекциях с целью исключения опухолевого поражения позвоночника. При наличии клинических симптомов компрессии корешков или спинного мозга и в других диагностически сомнительных случаях показано проведение МРТ соответствующего отдела позвоночника для уточнения состояния структур позвоночного канала и определения дальнейшей тактики ведения пациента. При болях в поясничном отделе позвоночника и конечностях особое значение имеют методы визуализации, целесообразность применения которых определяется длительностью болевого синдрома, анамнестическими особенностями и наличием изменений в неврологическом и соматическом статусе пациентов [10–13].
Кроме хорошо изученных острых болей в пояснично-крестцовой области, необходимо выделять и дифференцировать причины болей в мышцах в других анатомических областях. Так, интенсивная и, особенно, необычная для любой мышцы нагрузка может являться причиной развития в ней боли. Известно, что определенный характер труда приводит к повышению частоты болей в спине, связанных с перегрузкой тех или иных мышечных групп. Например, операторы швейных машин чаще страдают от болей в шейном отделе позвоночника и плечевом поясе. Мышечная боль может ощущаться локально в отдельных частях пораженной мышцы; распространяться на всю мышцу и ощущаться в областях, расположенных на расстоянии от пораженной мышцы (отраженная боль). Типично мышечная боль описывается пациентами как «ноющая», «сжимающая», «тянущая», «сверлящая», «разлитая». Паттерны боли, отраженной от мышц, детально описаны J.G. Travell и D.G. Simons и наиболее стабильно воспроизводятся при исследовании мышц плечевого пояса [14]. Наиболее выражена миогенная боль при нагрузке на пораженную мышцу. Она также может возобновляться при нагрузке на мышцу после ее отдыха, например, после сна. Часто это сопровождается ощущением «скованности» в мышце и необходимостью «разогреть» и «разработать» ее для уменьшения болезненности и зажатости при движении.
В отличие от суставной миогенная боль, как правило, возобновляется или усиливается при возрастании нагрузки на мышцу. Показано, что большая болезненность отмечается в так называемых «статических» (тонических) мышцах, находящихся в состоянии длительного напряжения для поддержания определенного положения тела, то есть несущих позную нагрузку. Примером такой «статической» мышцы является надостная мышца. В отличие от «статических» мышц, «фазические» мышцы «включаются» только при необходимости выполнения движения. Примером «фазической» мышцы является четырехглавая мышца бедра, которая задействуется только при динамической нагрузке. Даже у здорового человека с высокой частотой выявляется болезненность и уплотнения при пальпации «статических» мышц [15], что следует учитывать при обследовании больных.
Боль в мышцах может быть локальной и распространенной. Часто встречающимся состоянием, для которого характерна локальная боль в мышце, сопровождающаяся формированием отраженной боли, является миофасциальный болевой синдром (МФБС). МФБС – обычно хронический болевой синдром, при котором в различных частях тела возникает локальная или сегментарная боль. Патогномоничным признаком МФБС является триггерная зона (ТЗ). ТЗ – участок локального продольного уплотнения, расположенный по направлению мышечных волокон, при раздражении которого (пальпаторном, уколом, перкуссией) вызывается местная болезненность и иррадиации боли. Размер ТЗ составляет от 2 до 5 мм. Хотя при МФБС неврологической симптоматики, свидетельствующей о поражении нервной системы, как правило, не выявляется, пациенты могут жаловаться на ощущение «онемения», «ползание мурашек», покалывание в зоне иррадиации боли. Для каждой ТЗ характерна своя строго определенная область отраженной боли и парестезий. Еще в 1938 г. ученым J. Kellgren были картированы зоны отраженной боли от большинства мышц путем введения в них здоровым добровольцам гипертонического солевого раствора. Детальное описание ТЗ в различных группах мышц дано в работах J.G. Travell и D.G. Simons (1989, 1992) [16]. Наиболее часто ТЗ выявляются в мышцах головы, шеи, надплечий и в поясничной области.
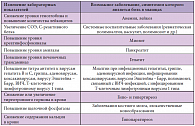
К формированию распространенной боли в мышцах приводят системные заболевания соединительной ткани, полимиозит, фибромиалгия. Боль в мышцах может отмечаться и при соматических заболеваниях. В таблице 1 приведены лабораторные методы обследования, необходимые для исключения соматического заболевания в качестве причины боли в мышцах [5]. Очень часто крайне затруднительно отличить боль, источником которой является сустав, от боли, обусловленной повреждением мышц или их сухожилий, связанных с суставом. Например, воспалительные изменения, затрагивающие сустав, часто распространяются и на прилежащие к нему мягкие ткани, включая мышцы. Распространенные болевые синдромы выявляются у 20–25% пациентов, страдающих ревматоидным артритом или системной красной волчанкой. Альгогенные вещества, такие как брадикинин, серотонин, простагландины, выделяющиеся при воспалении суставов, играют важную роль в формировании мышечной боли. Патология сустава может вызывать перегрузку мышц, которая приводит к формированию локальной мышечной боли. Например, травма медиальных отделов коленного сустава, нередко отмечающаяся у пациентов с остеоартрозом коленного сустава, вызывает боль в сухожилиях мышц, формирующих «гусиную лапку»: портняжной, тонкой и полусухожильной.
Межпозвоночные (дугоотростчатые, фасеточные) суставы являются потенциальными источниками боли в шее, грудном отделе и пояснично-крестцовой области (чаще – в шейной и поясничной областях), надплечьях и ногах. Кроме этого, «отраженная» от дугоотростчатых суставов шейного отдела позвоночника боль может ощущаться в голове (цервикогенная головная боль). Существует большое число причин, приводящих к поражению суставов позвоночника. Боль в межпозвоночных суставах может быть связана с их острым и хроническим инфекционным поражением (например, туберкулезным спондилитом), системными воспалительными артритами (ревматоидным артритом, спондилоартритами), метаболическими расстройствами (подагрой и псевдоподагрой). Потенциальными причинами боли в спине являются подвывихи, разрывы капсулы и хряща суставов, их микропереломы, однако роль указанных изменений остается неизвестной. Наиболее частой причиной боли в спине, связанной с поражением дугоотростчатых суставов, принято считать дистрофические изменения (спондилоартроз, или «фасеточный» синдром).
В подавляющем большинстве случаев поражение дугоотростчатых суставов – результат многолетней повторяющейся травматизации, связанной с неоптимальным объемом движений в суставах и повышением нагрузки на них вследствие дегенерации межпозвоночных дисков. В отдельных случаях поражение дугоотростчатых суставов может развиваться остро, например, в случаях хлыстовой травмы шеи, при спортивных травмах, когда отмечается травматизация сустава вследствие гиперфлексии, избыточной ротации или тракционного механизма воздействия. По-видимому, гиперэкстензионный механизм редко является причиной травматического поражения дугоотростчатых суставов. Частота поражения дугоотростчатых суставов у пациентов с хронической посттравматической болью в шейном отделе позвоночника составляет 60%. Однако травма в дебюте боли в шейном отделе позвоночника отмечается менее чем в 13% случаев [5].
Стандартом диагностики фасеточного синдрома являются положительные результаты блокады медиальной ветви задней первичной ветви спинномозгового нерва местным анестетиком или его внутрисуставного введения под контролем КТ [17–19]. Исчезновение боли в течение нескольких минут после проведения диагностической блокады считается достаточным для связи боли в спине с патологией дугоотростчатых суставов. Показано, что диагностические блокады без соответствующего рентгенологического контроля приводят к ложноположительным результатам в 25–41% случаев [20–23]. Лечение острых скелетно-мышечных болевых синдромов, учитывая, что их развитие связано с прямой активацией болевых рецепторов, включает в качестве препаратов первого выбора НПВП, уменьшающие синтез альгогенных соединений, в частности, продуктов каскада метаболизма арахидоновой кислоты – лейкотриенов и простагландинов, которые стимулируют и повышают возбудимость ноцицепторов.
НПВП наиболее эффективны для лечения обострений скелетно-мышечных болевых синдромов и болей, связанных с заболеваниями суставов [24]. Еще в 1971 г. было показано, что на фоне применения НПВП снижается синтез провоспалительных простагландинов [25]. Ингибирование активности циклооксигеназы (ЦОГ) рассматривается в качестве основного, но не единственного механизма действия НПВП. В последние десятилетия в экспериментах на животных показано, что определенный вклад в развитие анальгетического эффекта на фоне применения НПВП вносит и снижение синтеза простагландинов в центральной нервной системе (ЦНС) [26, 27]. Пока наличие такого эффекта у человека не может быть подтверждено в клинических исследованиях. Таким образом, ЦНС остается потенциальной мишенью для реализации анальгетического эффекта НПВП, который, по-видимому, зависит от способности отдельных препаратов преодолевать гематоэнцефалический барьер. Тем не менее основные мишени, на которые действуют НПВП, расположены на периферии.
В настоящее время насчитывается около 50 лекарственных средств, относящихся к группе НПВС. Они составляют несколько гетерогенных по химической структуре классов веществ. За небольшим исключением, НПВП являются производными слабых кислот и несколько различаются по силе анальгетического, антипиретического и противовоспалительного действия [28]. Особое внимание для лечения острых болевых синдромов привлекают НПВП с высокой анальгетической активностью, коротким периодом полувыведения, обладающие низкой частотой побочных явлений и быстрым наступлением анальгетического эффекта. С этой точки зрения заслуживает внимания препарат Дексалгин®, который содержит только правовращающий энантиомер кетопрофена.
Энантиомерами (оптическими изомерами) являются пары оптических веществ – антиподов, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в оптически активной среде). Как и многие другие молекулы, представители группы арилпропионовых кислот, к которым относится кетопрофен, содержат асимметрический атом углерода, а вещества, связанные с ним, могут формировать две различные конфигурации одной молекулы (энантиомеры). Биологически активные макромолекулы (ферменты, гормоны, рецепторы) по своей природе являются одиночными энантиомерами, и их взаимодействия с другими молекулами являются стереоселективными. Поэтому в смеси двух энантиомеров в составе кетопрофена только один – правовращающий (декскетопрофен) – обладает высокой способностью к связыванию с мишенями в организме человека. В частности, анальгетическая активность кетопрофена связана только со свойствами его правовращающего энантиомера. Препарат Дексалгин®, состоящий из трометамоловой соли декскетопрофена, позволяет исключить воздействие на пациента терапевтически неактивного и потенциально более опасного в отношении поражения желудочно-кишечного тракта левовращающего изомера [29, 30]. Трометамоловая соль обеспечивает более быструю абсорбцию препарата в желудочно-кишечном тракте с более быстрым достижением пика дозы по сравнению с кетопрофеном [31].
У пациентов с травматическим поражением нижних конечностей скорость наступления терапевтического эффекта на фоне приема 25 мг декскетопрофена была выше, чем при приеме 50 мг диклофенака натрия [32]. На классической модели острого болевого синдрома – боли, связанной с удалением зуба, – Дексалгин® в дозе 25 мг показал более выраженное и быстрее наступающее снижение интенсивности боли по сравнению с 575 мг метамизола и 600 мг ибупрофена. 25 мг декскетопрофена оказались равно эффективны 50 мг кетопрофена [28]. При острых скелетно-мышечных болевых синдромах эффективность препарата Дексалгин®, назначаемого перорально (75 мг/сут), была выше, чем при применении трамадола (150 мг/сут), по показателям уменьшения боли при движении, боли в ночное время и количеству принимаемого дополнительного анальгетика (парацетамола). Переносимость препарата была также лучше по сравнению с трамадолом [33].
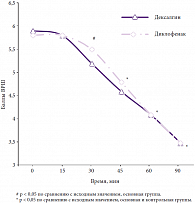
Открытое сравнительное исследование эффективности препарата Дексалгин® (75 мг/сут) и диклофенака натрия (100 мг/сут) у пациентов с острой болью в спине скелетно-мышечного происхождения показало, что на фоне применения декскетопрофена отмечается достоверное более быстрое, по сравнению с диклофенаком натрия, наступление анальгетического эффекта. Достоверное (p < 0,05) снижение интенсивности боли в группе, получавшей декскетопрофен, отмечалось уже через 30 минут после приема первой дозы препарата, в то время как в группе, получавшей диклофенак натрия, – только к 45-й минуте наблюдения (рис. 1). К концу 1-го дня лечения 10% пациентов, получавших Дексалгин®, отмечали полное, 40% – значительное, 30% – некоторое и 20% – незначительное облегчение от боли. К концу лечения в основной группе пациентов полное облегчение от боли отмечалось в 30% случаев, значительное – в 45%, некоторое – в 20%, и лишь в 5% случаев отмечался незначительный регресс болевого синдрома. Достоверное (p < 0,05) уменьшение ограничения повседневной активности у пациентов, получавших Дексалгин®, отмечалось уже к 3-му дню лечения. Так, на 2-й день терапии повседневную активность из-за боли в спине ограничивали 55% пациентов, на 3-й день лечения – 25%, а на 4-й и 5-й дни – только 5% пациентов [34].
При высокой интенсивности болевого синдрома и необходимости быстрого достижения обезболивания требуется иногда парентеральное применение НПВП. При скелетно-мышечных болевых синдромах это может быть в случае острой боли, связанной с травматизацией мышцы или сустава, отличающейся высокой интенсивностью, необходимости подготовки пациента к проведению диагностических процедур, визуализации и т.п. Исследование, проведенное с участием 370 пациентов с острой болью в пояснично-крестцовой области умеренной и высокой интенсивности, по сравнению анальгетической активности 50 мг декскетопрофена и 75 мг диклофенака натрия, назначаемых внутримышечно 2 раза в сутки, показало их одинаковую эффективность в отношении снижения интенсивности боли и ограничения повседневной двигательной активности пациентов [28, 35].
При остром послеоперационном болевом синдроме показана сопоставимая эффективность 50 мг декскетопрофена в/м и 100 мг кетопрофена в/м [36]. По данным другого исследования, Дексалгин® в дозе 50 мг в/м оказался несколько более эффективным при остром послеоперационном болевом синдроме, чем 75 мг диклофенака натрия в/м [37]. В специально проведенных исследованиях не было выявлено аккумуляции декскетопрофена у пожилых пациентов как после однократного, так и после повторного его назначения. Однако следует учитывать замедленное выведение препарата из-за сниженной функции почек у этой категории больных и назначать уменьшенные дозы препарата [38]. Таким образом, при острых скелетно-мышечных болевых синдромах легкой и умеренной интенсивности Дексалгин® может применяться в пероральной форме в дозе 75 мг в 3 приема в течение 5 дней. При необходимости быстрого купирования болевого синдрома умеренной и высокой интенсивности целесообразно парентеральное назначение препарата Дексалгин® в дозе 100–150 мг/сут в виде 2–3 внутримышечных инъекций в течение 1–2 дней с переходом на пероральный прием препарата в дозе 75 мг/сут в течение последующих 3–4 дней.
Кроме НПВП, при острой скелетно-мышечной боли в спине эффективны миорелаксанты при достоверном отсутствии преимуществ какого-либо отдельного препарата. Согласно современным клиническим рекомендациям, миорелаксанты целесообразно назначать коротким курсом в виде монотерапии или в комплексе с парацетамолом и НПВП при недостаточной эффективности последних [39]. Что касается нелекарственных методов лечения острой скелетно-мышечной боли в спине, можно выделить несколько показаний к их использованию. Мануальную терапию можно рекомендовать пациентам, не вернувшимся к нормальному уровню повседневной активности после проведенного курса медикаментозной терапии. Работающим пациентам с подострой болью в спине и ограничением активности более 4–8 недель могут помочь мультидисциплинарные программы лечения. Обычно они включают образовательную программу («школа боли в спине»), лечебную физическую культуру, по возможности, изменение условий труда, поведенческую психотерапию.
Таким образом, в подавляющем числе случаев острая боль в спине является доброкачественным состоянием, и большинство пациентов не нуждаются в проведении дополнительных инструментальных обследований. Оптимальным считается активный подход к лечению. При необходимости медикаментозной терапии препаратами выбора являются НПВП. Пациентам, у которых не отмечается улучшение состояния в течение 4 недель лечения, необходим повторный скрининг на маркеры «потенциально опасных» заболеваний позвоночника, а также определение признаков психосоциального неблагополучия и коррекция терапии с учетом выявленных нарушений. В лечении боли в спине можно использовать также методы немедикаментозной терапии.