Опыт применения Резорбы (золедроновой кислоты) при лечении костных метастазов рака легкого
- Аннотация
- Статья
- Ссылки
![Таблица 1. Частота появления скелетных осложнений при метастазах в кости различных злокачественных опухолей (Адаптировано по [12].)](/upload/resize_cache/iblock/ecc/195_350_1/ecc2696e5bef4be0167c9f1dd904c49c.png)
![Рис. 1. Шкалы оценки выраженности боли (Адаптировано по [38, 39])](/upload/resize_cache/iblock/d46/195_350_1/d46e8030714a3bfa99791918219f5bb0.png)
Злокачественные опухоли нередко сопровождаются поражением костей. В основе патогенеза костной резорбции при опухолях лежит нарушение нормального костеобразования. Опухолевые клетки продуцируют вещества, стимулирующие как остеокласты, так и остеобласты, основным из которых является PTHrP (белок, ассоциированный с паратиреоидным гормоном). Этот белок способен прямо или косвенно стимулировать остеокласты к деградации кости и высвобождению факторов роста (включая интерлейкин-6 (ИЛ-6), трансформирующий фактор роста (TGF-β) и другие), стимулирующих рост опухолевых клеток, одновременно поддерживающих цикл резорбции кости и ее аномальный рост [1–3].
Чаще всего в кости метастазирует рак молочной [4] и предстательной [5] железы, что может отражать как высокую частоту этой патологии, так и длительность течения этих заболеваний [6]. Вероятно, существуют и другие причины предрасположенности опухолей определенной локализации к метастазированию в кости [7]. Из других опухолей часто метастазируют в кости рак почки [8], щитовидной железы, легкого и множественная миелома. Частота метастатического поражения костей скелета при раке молочной и предстательной железы составляет до 75%, щитовидной железы – 60%, легких – 30–40%, почки – 20–25% и менее чем 10% – при раке яичников и опухолях желудочно-кишечного тракта.
Немелкоклеточный рак составляет большую часть всех опухолей легкого (75–80%), причем на момент установления диагноза у большинства больных уже наблюдается распространенный процесс. Отдаленные метастазы отмечаются у 11–36% пациентов, наиболее часто диагностируются костные метастазы, выраженные преимущественно остеолитическими очагами [9–11]. У 2,3% больных раком легкого метастазы в кости являются первичным проявлением заболевания. При мелкоклеточном раке легкого в 10% случаев кости являются единственным местом метастазирования. Около 60% больных раком легкого на момент установления диагноза имеют IIIb–IV стадии заболевания. Долгое время считалось, что лечение больных с такими стадиями рака легкого носит сугубо паллиативный или симптоматический характер. Однако развитие химиотерапии в последнее десятилетие привело к удвоению средней продолжительности жизни больных с IV стадией немелкоклеточного рака легкого (с 4 до 8–12 мес.), а также к повышению почти в три раза показателя 1-летней выживаемости – с 11–14% до 32–37%.
Появлению метастазов в кости при солидных опухолях сопутствует нарушение минерального обмена и структуры костной ткани. Костные метастазы, в свою очередь, клинически могут проявляться болью, гиперкальциемией, патологическими переломами и сдавлением спинного мозга – так называемые события, связанные со скелетом (skeletal related events, SRE), – что приводит к ухудшению качества жизни и инвалидизации больных. Зачастую развитие SRE препятствует продолжению специфического противоопухолевого лечения и впоследствии негативно влияет на продолжительность жизни больных. Костные осложнения в ряде случаев требуют дополнительного хирургического вмешательства и проведения лучевой терапии. Частота таких осложнений варьирует в зависимости от характера опухоли (табл. 1) и интенсивности проводимого лечения [12].
Боль, возникающая при метастазах в кости, часто плохо локализуется и может зависеть от множества факторов, таких как разрастание опухолевых масс, нестабильность скелета, образование микропереломов, развитие патологических переломов, химическая стимуляция болевых рецепторов цитокинами, высвобождающимися из опухолевых клеток. Боль и другие осложнения, вызванные костными метастазами, могут значительно ограничивать функции различных органов, при этом пациенты зачастую нуждаются в госпитализации и хирургических вмешательствах различного объема для их коррекции. Переломы позвонков приводят к изменению осанки, уменьшению роста, функциональным нарушениям и значительному ограничению подвижности. Кроме того, результаты исследований, проведенных с участием больных раком предстательной железы, и данные страховых компаний показывают, что развитие осложнений, связанных с метастатическим поражением костей, существенно повышает стоимость лечения. Так, общая стоимость лечения больного со скелетными осложнениями превосходит стоимость лечения больного с метастазами в кости без осложнений более чем на 48 000 долларов США в ценах 1990 г.
На долю гиперкальциемии, вызванной злокачественными опухолями, приходится около 45% всех случаев гиперкальциемии, которая представляет собой угрожающее жизни метаболическое осложнение рака и встречается у 10–20% онкологических больных. Чаще всего гиперкальциемия возникает у пациентов с миеломной болезнью (21–33%), раком легкого (7–16%), пищевода (6–28%) и молочной железы (5–23%). Гиперкальциемия встречается как у больных с метастазами в кости, так и без метастазов. В клинической практике под гиперкальциемией понимают концентрацию кальция в крови более 2,6 ммоль/л и выделяют три ее степени: легкая – уровень кальция 2,6–3,0 ммоль/л, средняя – 3,0–3,38 ммоль/л и тяжелая – выше 3,38 ммоль/л. Проявления гиперкальциемии зависят от уровня кальция в крови и общего состояния пациента: сухость во рту, жажда, полиурия, запор, тошнота, рвота; в тяжелых случаях могут наблюдаться почечная недостаточность и потеря сознания.
Наличие костных метастазов может быть подтверждено при помощи различных диагностических методов. Одним из наиболее простых является проведение рентгенологического исследования, которое применяют для выявления значительных костных деструкций. Наиболее часто для диагностики изменений в костной ткани используют радиоизотопное сканирование скелета. Однако для выявления ранних стадий бессимптомных метастазов подобный метод является недостаточно точным. Так, ложно-позитивное исследование может указывать на дегенеративные и травматические повреждения костной системы. Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) не используются как скрининговые методы для выявления костных метастазов, но эти технологии могут применяться для дальнейшего более детального исследования аномальных зон, выявленных сканированием или прямой рентгенографией. Сканирование методом позитронно-эмиссионной томографии (ПЭТ) в настоящее время рекомендуется проводить тем больным раком легкого, кто потенциально подходит для хирургического лечения. При сравнении методов ПЭТ и обычного сканирования точность выявления метастазов в кости составляла 96% и 66% соответственно [13, 14]. В настоящее время для лечения костных метастазов используют весь арсенал методов:
- системную специфическую противоопухолевую терапию;
- локальное воздействие (хирургия, лучевая терапия);
- поддерживающую терапию (бисфосфонаты для подавления костной резорбции);
- анальгетики.
Установление основных этапов патогенеза костных метастазов послужило основанием для создания препаратов, обладающих способностью оказывать влияние не столько на метаболизм самой опухоли, сколько на костный обмен, нарушенный опухолевым процессом [15]. Подобными свойствами обладают бисфосфонаты, ставшие первыми специфическими средствами для лечения метастазов в кости, представляя собой стабильные аналоги природных неорганических фосфатов. Механизм их действия сложен и до конца не ясен. С одной стороны, бисфосфонаты проникают в костную ткань, концентрируются вокруг остеокластов, создавая высокую концентрацию в лакунах резорбции, захватываются остеокластами, в которых нарушают формирование цитоскелета, необходимого для прикрепления остеокласта к костной ткани, а также снижают секрецию лизосомальных ферментов [16–21].
Другой эффект бисфосфонатов заключается в стимулировании апоптоза остеокластов, что подтверждается появлением особых изменений в клетке и структуре ядра [22]. Одновременно отмечается потеря клетками-предшественниками остеокластов способности к дифференцировке и созреванию, что приводит к уменьшению числа остеокластов. Кроме того, бисфосфонаты действуют на остеобласты и макрофаги в зоне костной резорбции, ингибируя синтез остеокластстимулирующих факторов [23]. Как показали последние исследования, бисфосфонаты не только снижают потерю костной ткани, но и уменьшают объем опухолевых масс [24–26]. Вероятно, это происходит за счет блокирования функции остеокластов, что ведет к разрыву порочного круга и прекращению подпитки опухолевых клеток факторами роста и цитокинами, вырабатываемыми костной тканью. Однако это может также быть результатом прямого действия бисфосфонатов (или, возможно, токсических продуктов метаболизма остеокластов) на опухолевые клетки [27]. Поднимался в литературе и вопрос о возможном влиянии бисфосфонатов на висцеральные метастазы, но подтверждения этого влияния получено не было [28] .
Все бисфосфонаты являются производными пирофосфата, основой которого является группа фосфор-кислород-фосфор (Р–О–Р), однако в отличие от него характеризуются наличием структуры Р–С–Р, обеспечивающей активность бисфосфонатов и связывание с костным матриксом, а также боковой цепи, определяющей их антирезорбционную активность, побочные эффекты и механизм действия [29]. Бисфосфонаты, как и пирофосфат, связываются с кристаллами гидроксиапатита кости и предотвращают их рост и растворение.
Обычно бисфосфонаты хорошо переносятся большинством пациентов. Самые частые побочные эффекты – гриппоподобный синдром (лихорадка, артралгии, миалгии и обострение болей в костях), повышенная утомляемость, желудочно-кишечная реакция (более выраженная у препаратов третьего поколения – вплоть до эрозивных эзофагитов и гастритов), могут отмечаться слабость, одышка и отеки. Эти симптомы обычно слабо выражены, быстро купируются и требуют минимальной медикаментозной коррекции. При применении внутривенных бисфосфонатов возможно нарушение функции почек, особенно у пациентов с ранее существующей почечной патологией, что требует постоянного мониторинга уровня креатинина. При применении золедроновой кислоты (золедроната) единственным серьезным осложнением является остеонекроз челюсти, хотя, по мнению большинства исследователей, причины возникновения этого типа осложнений достаточно многочисленны, включая применение кортикостероидов и цитостатиков, сопутствующую патологию и распространенность опухолевого процесса.
Золедроновая кислота (золедронат) – представитель третьего поколения сильнодействующих бисфосфонатов – содержит два атома азота в гетероциклическом кольце и обладает наивысшей антирезорбтивной активностью. Аминобисфосфонаты обладают способностью как подавлять активность остеокластов и снижать резорбцию костной ткани при метастазах опухоли, так и влиять на клеточное микроокружение в кости и препятствовать адгезии опухолевых клеток благодаря угнетению ряда ферментов. Стоит отметить, что именно для золедроната в исследованиях in vitro в отношении клеток рака легкого, так же как и клеток рака молочной и предстательной железы, показана прямая противоопухолевая активность за счет снижения клеточной пролиферации, индукции апоптоза, подавления адгезии и инвазии в костный матрикс. Эти данные подтверждены рядом клинических исследований, в которых показаны возможности золедроновой кислоты потенцировать эффект цитостатиков [30–37]. Целью настоящего исследования была оценка эффективности использования препарата золедроновой кислоты (Резорба, ЗАО «Фарм-Синтез») для уменьшения интенсивности болевого синдрома и предупреждения и/или снижения частоты развития осложнений у больных с костными метастазами рака легкого.
Характеристика больных и методы исследования
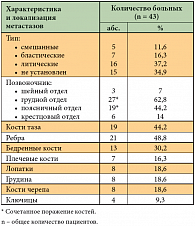
В период с января 2008 г. по январь 2012 г. в отделении химиотерапии РОНЦ им. Н.Н. Блохина РАМН было проведено исследование, в которое были включены 43 пациента, из них 32 мужчины (74,4%) и 11 женщин (25,6%), в возрасте от 31 до 77 лет (средний возраст 54 года), получивших 206 введений Резорбы. У всех больных на момент включения в исследование была IV стадия заболевания. По морфологическому типу у 33 (76,7%) пациентов диагностирован немелкоклеточный рак легкого (22 – аденокарцинома, 11 – плоскоклеточный рак), у 10 (23,3%) пациентов – мелкоклеточный рак легкого. Необходимо отметить, что 6 больных имели длительный анамнез заболевания (свыше 12 месяцев), а у 3 пациентов кости были единственным местом метастазирования рака. У всех больных наличие метастазов в кости было подтверждено радиоизотопным, рентгенологическим методами исследования, КТ и/или МРТ, в некоторых случаях проводилась ПЭТ. В таблице 2 представлены характеристика и частота поражения определенных отделов скелета больных. В процессе лечения препаратом Резорба состояние всех пациентов контролировалось по рентгенологическим параметрам.
20 больных на момент включения предъявляли жалобы на боли от незначительной до сильной (I–IV степени по шкале CTCAE (Common Terminology Criteria for Adverse Events)) и использовали для обезболивания анальгетики, НПВП и даже препараты наркотического ряда. Для оценки изменения интенсивности болей в процессе лечения бисфосфонатом Резорба пациенты 1 раз в 3 дня заполняли подобранные для данного исследования шкалы оценки выраженности боли: визуально-аналоговую шкалу, шкалу вербальных оценок и мимическую шкалу оценки боли (рис. 1). Для объективной оценки степени выраженности болевого синдрома пациенты или их родственники заполняли график приема обезболивающих препаратов в период лечения. Общее состояние для всей группы пациентов перед началом лечения Резорбой по шкале ECOG (Eastern Cooperative Oncology Group) было ≥ 2, что характеризует неполноценное качество жизни. У всех больных перед каждым введением препарата производили забор крови на биохимический анализ с обязательным исследованием уровня креатинина, щелочной фосфатазы (ЩФ) и кальция.
Одиночные метастазы в кости отмечались у 8 пациентов. Множественные метастазы: 2 – у двух пациентов, 3 – у двух пациентов, более 3 – у 31 пациента. На момент включения в исследование 6 (14%) больных получили курс паллиативной лучевой терапии (ЛТ) с целью обезболивания, однако специфического противоопухолевого лечения они не получали; у 16 больных наличие метастазов в кости было диагностировано одновременно с основным онкологическим диагнозом, поэтому они также не получали никакого лечения; в анамнезе у 21 пациента уже были многократные циклы цитостатической терапии с использованием различных химиопрепаратов – этопозида, цисплатина, карбоплатина, Адриамицина, Аранозы, гемцитабина, паклитаксела, иринотекана, винкристина, Алимты, бевацизумаба и др. Однако несмотря на проводимую химиотерапию, у больных последней группы при оценке эффекта выявлялись метастазы в кости, после чего к основному лечению добавляли бисфосфонаты. У 7 больных еще до начала лечения в рамках нашего исследования по данным КТ отмечался перелом II ребра, компрессионные переломы тел С7, Th8, Th10, L3 и L5 позвонков и шейки бедра соответственно.
Результаты исследований
Клиническую эффективность проводимой терапии оценивали по следующим показателям:
- изменение выраженности болевого синдрома;
- отсутствие новых очагов поражения костей по данным рентгенологических исследований;
- репарация костных метастазов.
Оценить результаты лечения удалось лишь у 30 (69,8%) пациентов, так как некоторые из включенных в исследование получили лишь по 1 или 2 введения Резорбы. В оцениваемой группе каждый больной получил от 3 до 14 (в среднем 6) введений Резорбы по 4 мг в виде 15–30-минутной инфузии в среднем каждые 30 дней (26–34 дня). Лечение проводилось в основном в амбулаторных условиях. Необходимо отметить, что непосредственных побочных реакций во время инфузии не наблюдалось. До начала лечения гиперкальциемия не отмечалась ни у одного из 30 больных. В процессе лечения не наблюдалось случаев гипокальциемии и повышения уровня креатинина в плазме крови.
Повышение уровня ЩФ до начала лечения было выявлено у 14 больных (46,7%), снижение этого показателя до нормальных значений у 5 из них (35,7%) наблюдали уже после 2–4 инфузий Резорбы. У 7 (50%) пациентов отмечали снижение уровня ЩФ, однако норма не была достигнута, возможно, вследствие ограниченного срока наблюдения или из-за наличия метастазов в печени. На протяжении всего периода лечения Резорбой у 22 (73,3%) больных рентгенологически не было выявлено новых очагов в костях. Новые метастатические очаги в кости у 8 больных (26,7%) появились после 2 и 6 инфузий Резорбы, что составило 2 и 8 месяцев между контрольными обследованиями соответственно.
Патологические переломы наблюдались у 9 (30,0%) больных: у 2 из них они были выявлены в процессе проводимой сопутствующей терапии золедронатом, у 7 больных переломы отмечались (по данным КТ), как указано выше, еще до момента включения в исследование. Клиническая картина компрессии спинного мозга наблюдалась у 1 из этих 9 пациентов, однако в связи с тяжестью его состояния рентгенологически это подтвердить не удалось. У 2 больных патологические переломы были зарегистрированы рентгенологически: у 1 больного компрессионный перелом на уровне тел позвонков L1–L2 был выявлен после 1-й инфузии Резорбы; у второго патологический перелом правой бедренной кости в области ранее определяемого метастаза был обнаружен после 6-й инфузии Резорбы. 8 (18,6%) пациентам на фоне применения химиотерапии и бисфосфонатов была добавлена ЛТ на область перелома с анальгезирующей целью.
Период времени от завершения ЛТ до начала введения Резорбы составил в среднем 12 месяцев (от 2 дней до 24 месяцев). При рентгенологическом контроле у 8 (26,7%) из 30 оцененных больных отмечалась репарация костной ткани разной степени интенсивности, которую регистрировали после 1–5 курсов (в среднем после 3 курсов) лечения Резорбой. Болевой синдром отмечался у 20 (46,5%) больных перед началом лечения Резорбой. В ходе лечения интенсивность его снижалась в 65% случаев (у 13 пациентов). После 2–3 инфузий препарата жалоб на боли не предъявляли 14 (70%) больных, у 5 пациентов (25%) болевой синдром оставался на прежнем уровне, и только один пациент отмечал нарастание болей в костях.
При анализе дневников пациентов, состоящих из трех шкал выраженности боли (субъективная оценка) и графика приема анальгетиков (объективная оценка), обращает на себя внимание усиление болей на 2–5-е сутки после инфузии Резорбы у 3 пациентов (10%). Однако в течение последующих 26–34 дней между курсами лечения бисфосфонатом пациенты отмечали снижение болевого синдрома до минимального уровня на 13–25-е сутки лечения.
Интересно, что у 40% пациентов отмечалось несоответствие между самооценкой боли по шкалам выраженности болевого синдрома и дозировками используемых обезболивающих препаратов, что, возможно, связано с психологической зависимостью больных от приема анальгетиков и страхом возобновления боли. Среди нежелательных реакций на введение Резорбы отмечалась лихорадка легкой степени тяжести на 2–3-и сутки у 6 больных (20%), которая быстро купировалась приемом жаропонижающих средств. Следует отметить, что концентрации гемоглобина, лейкоцитов, эритроцитов и нейтрофилов на фоне применения Резорбы не изменялись. В проведенном исследовании, согласно биохимическим показателям, не было выявлено отрицательного влияния Резорбы на функциональное состояние почек, несмотря на параллельно вводимые нефротоксичные цитостатики.
Бисфосфонаты не являются альтернативой противоопухолевому лечению и применяются независимо от него. Однако по сравнению с другими препаратами, оказывающими влияние на костную резорбцию, они обладают рядом преимуществ (высокая эффективность, низкая токсичность, наличие пероральной формы). Это делает их препаратами выбора при наличии костных метастазов [40, 41], так как бисфосфонаты, обладая уникальной способностью ингибировать костную резорбцию при метастазах солидных опухолей, оказывают лечебное и профилактическое действие при гиперкальциемии, болевом синдроме, существенно снижают риск развития патологических деформаций и переломов костей. Несмотря на различную антирезорбционную активность in vitro, использование любого из представителей группы бисфосфонатов при костных метастазах обеспечивает снижение риска патологических переломов, уменьшение выраженности болевого синдрома, нормализацию уровня кальция крови.
Заключение
Резорба является эффективным и безопасным препаратом из группы бисфосфонатов. Лечение Резорбой удобно для пациентов, так как препарат вводится посредством кратковременной инфузии 1 раз в месяц и лечение может проводиться в амбулаторных условиях. В проведенных исследованиях показано, что Резорба быстро купирует болевой синдром, обеспечивает эффективную защиту костной ткани, подавляет деструктивные процессы в костях скелета и способствует их регенерации, улучшая качество жизни больных с диссеминированным раком легкого. Препарат хорошо переносится в сочетании с противоопухолевой терапией. По эффективности и профилю безопасности Резорба не уступает другим препаратам на основе золедроновой кислоты. Таким образом, полученные данные позволяют заключить, что препарат Резорба может занять важное место в сопроводительной терапии больных раком легкого с метастазами в кости.

