Отдаленные исходы полушарного ишемического инсульта, осложненного инфекционными заболеваниями
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование были включены 96 пациентов, перенесших острый ИИ.
У 48 пациентов первой группы в остром периоде ИИ имелись инфекционные осложнения.
У 48 больных второй группы такие осложнения отсутствовали. Оценивались выраженность очагового неврологического дефицита (шкала NIHSS, индекс Бартел), состояние когнитивных функций (опросники MMSE и MoCA), характер течения заболевания.
Результаты и обсуждение. Для пациентов первой группы характерными оказались более старший возраст, более тяжелая выраженность неврологического дефицита на момент госпитализации, более частые нарушения глотания (различия по сравнению с пациентами первой группы статистически достоверны). На протяжении шести месяцев после ИИ у больных первой группы сохранялся более тяжелый очаговый неврологический дефицит, а также более выраженные когнитивные нарушения (p < 0,05 по сравнению с пациентами второй группы). Указанные отличия через 12 месяцев отсутствовали (p > 0,05), равно как и значимые различия течения постинсультного периода у пациентов с заболеванием нижних дыхательных или мочевыводящих путей.
Заключение. На протяжении шести месяцев у пациентов, перенесших острый каротидный ИИ, наблюдались более выраженные очаговые неврологические и когнитивные нарушения. Тяжесть очаговой неврологической симптоматики, выраженность когнитивных нарушений, а также уровень независимости от посторонней помощи в повседневной жизни значимо не отличались у больных двух групп.
Материал и методы. В исследование были включены 96 пациентов, перенесших острый ИИ.
У 48 пациентов первой группы в остром периоде ИИ имелись инфекционные осложнения.
У 48 больных второй группы такие осложнения отсутствовали. Оценивались выраженность очагового неврологического дефицита (шкала NIHSS, индекс Бартел), состояние когнитивных функций (опросники MMSE и MoCA), характер течения заболевания.
Результаты и обсуждение. Для пациентов первой группы характерными оказались более старший возраст, более тяжелая выраженность неврологического дефицита на момент госпитализации, более частые нарушения глотания (различия по сравнению с пациентами первой группы статистически достоверны). На протяжении шести месяцев после ИИ у больных первой группы сохранялся более тяжелый очаговый неврологический дефицит, а также более выраженные когнитивные нарушения (p < 0,05 по сравнению с пациентами второй группы). Указанные отличия через 12 месяцев отсутствовали (p > 0,05), равно как и значимые различия течения постинсультного периода у пациентов с заболеванием нижних дыхательных или мочевыводящих путей.
Заключение. На протяжении шести месяцев у пациентов, перенесших острый каротидный ИИ, наблюдались более выраженные очаговые неврологические и когнитивные нарушения. Тяжесть очаговой неврологической симптоматики, выраженность когнитивных нарушений, а также уровень независимости от посторонней помощи в повседневной жизни значимо не отличались у больных двух групп.
Ишемический инсульт (ИИ) – тяжелое распространенное заболевание, являющееся одной из основных причин наступления летального исхода и тяжелой инвалидизации [1, 2]. Ранние и поздние исходы ИИ в значительной степени определяются обширностью очага поражения, сопутствующей соматической патологией, а также осложнениями острого периода заболевания. В острой стадии ИИ часто имеют место инфекционные осложнения со стороны дыхательной и мочевыделительной систем, тромбоз вен малого таза и нижних конечностей с тромбоэмболией легочной артерии, острый коронарный синдром. С указанными осложнениями в значительной степени связаны внутрибольничная летальность и выраженность очагового неврологического дефицита [3].
Особый интерес вызывают инфекционные осложнения со стороны нижних дыхательных путей, а также органов мочевыделительной системы, что связано с их широкой распространенностью и возможностями эффективной профилактики. Согласно имеющимся данным, подобные осложнения развиваются примерно у 12–16% пациентов с острым ИИ [4]. Инфекционные осложнения острого ИИ обусловлены рядом причин, в частности нарушениями дыхания, в том числе требующими искусственной вентиляции легких, внутрибольничной инфекцией, нарушением иммунного ответа в условиях острого заболевания [5, 6]. Сопутствующие соматические заболевания, в частности сахарный диабет (СД), способны не только повышать риск сердечно-сосудистых заболеваний и ИИ, но и изменять характер и выраженность воспалительной реакции у пациентов с ИИ [7].
Наиболее существенный вклад, определяющий течение острого ИИ, вносят заболевания нижних дыхательных путей (чаще пневмония). Несколько меньшую роль играют инфекции мочевыделительной системы [8]. Традиционно наиболее значимыми считаются инфекционные заболевания органов дыхания, причем такие заболевания иной локализации наблюдаются намного реже. Как продемонстрировали данные метаанализа, воспалительные заболевания мочевыводящей системы при остром ИИ изучены в меньшей степени, чем заболевания бронхолегочной системы, и их распространенность у таких больных составляет 19% [9]. Вместе с тем данные ряда исследований последних лет говорят, что распространенность указанных состояний существенно выше, чем считалось ранее, они могут развиваться примерно у 2/3 пациентов с ИИ [10]. Вероятно, такие отличия обусловлены различными критериями постановки диагноза, а также лабораторно-инструментальными диагностическими возможностями.
Инфекционные осложнения острого ИИ связаны с формированием системной воспалительной реакции, увеличением сроков госпитализации, в том числе из-за пребывания в реанимационном отделении, материальных затрат на лечение, летальности [11]. Установлено, что больные с острым ИИ, осложненным инфекционными заболеваниями, при выписке из неврологического стационара имеют более выраженный очаговый дефицит, более тяжелую инвалидизацию, в большей степени зависят от посторонней помощи в быту [12, 13]. Соответственно такие пациенты требуют более длительной и дорогостоящей реабилитации и более сложной вторичной профилактики повторного ИИ. Поскольку системные воспалительные и инфекционные заболевания ассоциируются с повышением риска развития тромботических осложнений, очевидно, что у пациентов с инфекционными осложнениями острого ИИ повышен риск развития острых цереброваскулярных заболеваний.
Значительно меньше известно о связи осложнений острого периода ИИ с его отдаленными исходами. Имеются отдельные сообщения, посвященные данной проблеме. В частности, установлено, что пациенты с ИИ, осложненным бронхолегочными заболеваниями, характеризуются более высоким уровнем летальности и более тяжелой инвалидизацией на протяжении первых трех месяцев [14, 15]. Особенности отдаленных исходов ИИ у таких больных требуют оценки связи отдаленных исходов острого ИИ в каротидной системе с инфекционными осложнениями, перенесенными в остром периоде заболевания.
Материал и методы
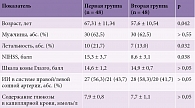
В ходе проспективного исследования под наблюдением находились 96 пациентов с острым ИИ. У 48 пациентов первой группы течение заболевания осложнялось развитием инфекционных осложнений (42 пациента с инсульт-ассоциированной пневмонией (ИАП), шесть пациентов с инфекцией мочевыводящих путей (ИМВП)). У 48 пациентов второй группы инфекционные осложнения отсутствовали. Основные характеристики больных представлены в табл. 1.
Всем пациентам проведены клиническое и лабораторно-инструментальное обследование и лечение в соответствии со стандартами оказания медицинской помощи больным с острым нарушением мозгового кровообращения (ОНМК). Протокол исследования одобрен этическим комитетом медицинского факультета Кабардино-Балкарского государственного университета им. Х.М. Бербекова.
Критерии включения больных в исследование:
- острый первичный/повторный нелакунарный ИИ в системе сонных артерий;
- подтверждение ИИ результатами рентгеновской компьютерной томографии (КТ) головного мозга;
- госпитализация в отделение для лечения больных с ОНМК в течение 12 часов от момента появления неврологического дефицита.
Критерии невключения в исследование:
- геморрагический или смешанный инсульт;
- лакунарный ИИ;
- острый ИИ в вертебрально-базилярной системе;
- проведенная тромболитическая терапия;
- перенесенные воспалительные, травматические и другие заболевания головного мозга с очаговым неврологическим дефицитом;
- опухоли головного мозга;
- когнитивные, психические и речевые нарушения, исключающие возможность речевого контакта с больным;
- развитие настоящего ИИ на фоне инфекционного заболевания;
- потребность в искусственной вентиляции легких в первые сутки госпитализации.
Клинический диагноз и патогенетический подтип ИИ определяли на основании анамнестических сведений, клинической картины, данных КТ головного мозга, ультразвуковой допплерографии экстракраниальных артерий, мониторирования электрокардиограммы. Выраженность очагового неврологического дефицита оценивали по шкале инсульта Национального института здоровья (National Institute of Health Stroke Scale, NIHSS), уровень бодрствования – по шкале комы Глазго (ШКГ), степень утраты способности к самообслуживанию – с помощью индекса Бартел (ИБ). Оценка когнитивных функций проводилась по результатам выполнения тестов краткой шкалы оценки психических функций (КШОПФ) и Монреальской шкалы оценки когнитивных функций (Montreal Cognitive Assessment, МоСА). Обследование выполнялось на момент госпитализации (за исключением нейропсихологического тестирования), на 11-е сутки ИИ, через три, шесть и 12 месяцев.
Критериями ИАП считали наличие не менее одного из следующих признаков:
- температура тела < 38 °C без другой установленной причины;
- лейкоцитоз < 12 000 в мм3;
- у пациентов старше 70 лет – угнетение сознания, которое не могло быть обусловлено другими установленными причинами, а также не менее двух из следующих критериев: 1) гнойная мокрота (изменение ее характера)/увеличение объема отделяемого из дыхательных путей/необходимость более частой санации бронхиального дерева, впервые появившиеся на протяжении 24 часов; 2) впервые возникшие или усилившиеся по интенсивности кашель/диспноэ/тахипноэ (> 25 в минуту); 3) хрипы и/или крепитация, выслушиваемые над легкими; 4) изменения лабораторных показателей газообмена (индекс оксигенации < 240); 5) потребность в ингаляции кислорода; 6) инфильтрат в легких, впервые выявленный или увеличивающийся в объеме, обнаруженный при одном из не менее чем двух рентгенографических исследований.
Для диагностики ИАП не требовались положительные результаты первого рентгенологического обследования.
Наличие ИМВП диагностировали на основании не менее двух из перечисленных ниже критериев:
- обнаружение нитритов в общем анализе мочи;
- присутствие не менее 100 000 колоний/мл при бактериологическом исследовании мочи;
- содержание лейкоцитов в моче > 35/мл;
- лихорадка > 38 °C [11, 12].
Полученные результаты обработаны статистически с помощью программы SPSS 20.0. При сравнении двух независимых выборок использовали U-критерий Манна – Уитни (с поправкой Йетса для малых выборок). Для оценки связи независимыми переменными использовали коэффициент корреляции Пирсона (r). Достоверными считались различия при р < 0,05.
Результаты и обсуждение
Пациенты обеих групп были сопоставимы по полу, уровню бодрствования, локализации очага ИИ в правой или левой каротидной системе, показателям систолического и диастолического артериального давления, уровню гликемии на момент госпитализации (табл. 1).
Пациенты первой группы оказались достоверно старше (p = 0,042), имели большую выраженность неврологического дефицита, в соответствии с NIHSS (p = 0,038). В первой группе показатели летальности были выше (p = 0,032).
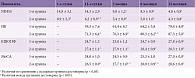
В результате проводимой терапии у пациентов обеих групп наблюдалась положительная динамика – снижалась выраженность очагового неврологического дефицита, прежде всего пирамидных нарушений в конечностях (табл. 2). У пациентов второй группы статистически значимые различия по сравнению с исходным уровнем отмечались уже на момент выписки из стационара, впоследствии выраженность неврологического дефицита уменьшалась. У пациентов первой группы уменьшение выраженности неврологического дефицита имело отсроченный характер, о чем свидетельствовало отсутствие статистически значимых отличий при исследовании через три месяца по сравнению с исходным уровнем.
При обследовании через шесть и 12 месяцев статистически значимые различия между группами отсутствовали, показатели в обеих группах достоверно отличались от исходных. Увеличение ИБ у пациентов второй группы отмечалось с момента прекращения стационарного периода лечения. К максимальным показателям ИБ приблизился через 12 месяцев, что свидетельствовало о существенном расширении степени независимости в повседневном быту. У пациентов первой группы на момент выписки из стационара показатели ИБ оказались статистически значимо ниже, чем у пациентов второй группы, и оставались на том же уровне при осмотре через три месяца. Только с шестого месяца регистрировалась тенденция к увеличению данного показателя (отличия по сравнению с исходным уровнем приобрели статистически значимый характер). Спустя 12 месяцев от момента развития ИИ у больных обеих групп ИБ достиг максимальных значений и не различался между группами.
При исследовании состояния когнитивных функций установлено, что результаты обследования по опросникам КШОПС и МоСА среди больных первой группы через три и шесть месяцев оказались несколько выше исходных, но отличия не носили достоверного характера. Только при обследовании через 12 месяцев от момента развития ИИ отличия указанных показателей продемонстрировали статистическую значимость по сравнению с исходными. У пациентов второй группы результаты обследования по опросникам КШОПС и МоСА статистически значимо увеличивались по сравнению с исходным уровнем с третьего месяца, нарастая к шестому и 12-му месяцу. При обследовании через три и шесть месяцев значения по указанным шкалам были статистически значимо выше у больных второй группы, причем отличия между группами нивелировались только при обследовании через 12 месяцев.
Выявлена тесная прямая зависимость риска развития ИАП и ИМВП с возрастом больных (r = 0,678; p < 0,05), исходной выраженностью неврологического дефицита (r = 0,518; p < 0,05), наличием псевдобульбарного синдрома с дисфагией (r = 0,536; p < 0,05). Кроме того, установлена связь развития инфекционных осложнений с СД 2-го типа (r = 0,452; p < 0,05) и угнетением сознания на момент госпитализации (r = 0,441; p < 0,05). Не обнаружено статистически значимых отличий выраженности неврологического дефицита, степени инвалидизации и характера инфекционных осложнений. Не зафиксировано отличий влияния ИАП и/или ИМВП на характер течения постинсультного периода и отдаленные исходы ИИ.
Заключение
Результаты проведенного исследования указывают на то, что инфекционные осложнения острого ИИ в каротидной системе чаще возникают у пациентов более старшего возраста с соматическими заболеваниями, изначально более высокой выраженностью неврологического дефицита.
Важным предиктором развития ИАП является наличие псевдобульбарного синдрома с дисфагией. Наличие инфекционных осложнений ассоциируется с более высоким уровнем летальности в остром периоде ИИ, замедленным темпом восстановления когнитивных и неврологических функций в течение года после перенесенного ИИ.
Через 12 месяцев выраженность очагового неврологического дефицита, степень независимости в повседневном быту от посторонней помощи, состояние когнитивных функций существенно не отличаются у пациентов с инфекционными осложнениями острого ИИ.
L.B. Tlapshokova, PhD, Prof., A.Ch. Zhemukhov, L.V. Santikova, D.T. Chipova, PhD
Kh.M. Berbekov Kabardino-Balkar State University, Nalchik
City Clinical Hospital № 1, Nalchik
Contact person: Dinara T. Chipova, dinara.chipova@mail.ru
The purpose – the relationship of long-term outcomes of acute ischemic stroke (AI) in the carotid system with infectious complications suffered in the acute period of the disease.
Material and methods. The study included 96 patients who underwent acute AI, 48 of them had infectious complications in the acute period of AI (group 1), such complications were absent in 48 patients (group 2). The severity of focal neurological deficit (NIHSS scale, Bartel index), the state of cognitive functions (MMSE and MoCA questionnaires), the nature of the course of the disease were evaluated.
Results and discussion. The patients of group 1 were characterized by an older age, a more severe severity of neurological deficit at the time of hospitalization, more frequent swallowing disorders (differences compared to group 1 were statistically significant). For 6 months after AI, group 1 patients had more severe focal neurological deficit, as well as more pronounced cognitive impairment (p < 0.05 compared to group 2). These differences were absent after 12 months (p > 0.05). There were no significant differences in the course of the post-stroke period of differences in patients with lower respiratory or urinary tract disease.
Conclusion. For 6 months in patients those who have undergone acute carotid AI have more pronounced focal neurological and cognitive impairments. The severity of focal neurological symptoms, the severity of cognitive impairment, as well as the level of independence from outside help in everyday life did not significantly differ in patients of the two groups.

