Персонализированная терапия метастатической меланомы кожи
- Аннотация
- Статья
- Ссылки
- English
Метастатическая меланома кожи (мМК) характеризуется крайне неблагоприятным прогнозом и высокой смертностью в течение первого года от момента появления отдаленных метастазов. Так, медиана общей продолжительности жизни у пациентов с мМК, получавших стандартную химиотерапию, как правило, не превышает девяти месяцев [1–4].
До 2011 г. химиотерапия считалась стандартным и единственным вариантом лечения пациентов с мМК. Предпринимались попытки комбинировать химиотерапию с иммунотерапией (интерферон альфа-2b, интерлейкин 2) для повышения эффективности лечения. Но оказать существенное влияние на показатели общей выживаемости с помощью биохимиотерапии так и не удалось.
Реальные успехи в лечении мМК появились в 2011 г., когда FDA (Food and Drug Administration – Управление по контролю качества пищевых продуктов и лекарственных средств) зарегистрировало в США ипилимумаб (anti-CTLA4 – цитотоксический антиген Т-лимфоцита-4) и вемурафениб (BRAFi – ингибитор BRAF) для лечения мМК. Оба препарата впервые продемонстрировали достоверное увеличение общей выживаемости пациентов с мМК по сравнению со стандартной химиотерапией.
Предпосылкой применения ингибиторов BRAF при мМК стало открытие роли мутации в гене BRAF при мМК. Исследователи из Института по изучению генома Sanger Institute (Великобритания) в 2002 г. обнаружили, что приблизительно в 40–60% образцов МК присутствуют мутации гена, кодирующего протеинкиназу BRAF [5]. Наиболее частой мутацией в гене BRAF при МК (около 90%) является мутация V600E – замена аминокислоты валин на глутамин в 600-м кодоне, что приводит к увеличению киназной активности фермента BRAF по отношению к нижестоящей киназе MEK во внутриклеточном пути передачи сигнала MAPK. Помимо мутации V600E в гене BRAF встречаются и другие виды мутаций (V600K, V600R, V600D), которые также активируют киназную активность фермента. Активация MAPK-пути внутриклеточной передачи сигнала через последовательную активацию киназ MEK и ERK вызывает неконтролируемую пролиферацию клетки и блокаду апоптоза [6–8].
Доклинические и клинические данные подтвердили, что противоопухолевый эффект препарата, селективно блокирующего BRAF, реализуется в опухоли с мутацией в гене BRAF. Воздействие ингибиторов BRAF на опухолевые клетки с нормальным «диким» типом киназы BRAF (не имеющим мутации в этом гене), напротив, сопровождается патологической активацией каскада BRAF – MEK – ERK и стимулирует рост меланомы. Поэтому перед началом терапии ингибиторами BRAF всегда необходимо исследовать образец опухоли на наличие BRAF-мутации.
Первым таргетным препаратом, продемонстрировавшим статистически значимое увеличение общей выживаемости пациентов с мМК, стал вемурафениб. Препарат блокирует патологический сигнальный путь MAPK, который запускается мутацией BRAFV600. Вемурафениб рекомендован к применению в дозе 960 мг дважды в день per os (суточная доза 1920 мг) для пациентов с метастатической (IV стадия) и неоперабельной меланомой кожи IIIC стадии при наличии мутации BRAFV600. Лечение проводят до прогрессирования заболевания или развития непереносимости терапии. Вемурафениб разрешен для клинического применения в США и Евросоюзе в 2011 г., в России – с декабря 2013 г. Основанием для регистрации препарата послужили данные клинического исследования III фазы BRIM-3, в котором эффективность вемурафениба сравнили с эффективностью стандартной химиотерапии дакарбазином у пациентов с мМК, ранее не получавших системного лечения. Главными целями данного исследования были оценка общей выживаемости и выживаемости без прогрессирования (ВБП) [9].
В исследовании участвовали 675 пациентов с мутацией BRAFV600, с неоперабельной МК IIIC или IV стадии. Рандомизацию пациентов проводили в соотношении 1:1. В группу вемурафениба (960 мг внутрь, два раза в сутки per os) вошли 337 пациентов, в группу дакарбазина (1000 мг/м2 внутривенно каждые три недели) – 338 пациентов. Лечение продолжали до прогрессирования заболевания, неприемлемой токсичности или отзыва согласия пациентом по любой причине.
В данном исследовании было показано, что по сравнению со стандартной химиотерапией вемурафениб на 30% снижает риск смерти (относительный риск (ОР) 0,70; p = 0,0008) и на 62% (ОР 0,38; p < 0,0001) риск прогрессирования заболевания. Кроме того, наблюдалось значительное увеличение частоты объективного ответа на лечение в группе вемурафениба (57%, включая 5,6% полных ответов) по сравнению с группой дакарбазина (8,6% (1,2% полных ответов)). Медиана общей выживаемости при использовании вемурафениба составила 13,6 месяца и была значимо выше, чем в группе дакарбазина, – 9,7 месяца (р < 0,001). Медиана ВБП на фоне вемурафениба в четыре раза превысила таковую на фоне химиотерапии: 6,9 против 1,6 месяца (р < 0,001). Несмотря на разрешенный протоколом исследования переход больных из группы дакарбазина в группу вемурафениба после прогрессирования заболевания, статистически достоверные различия между группами сохранились. Обновленные результаты данного исследования демонстрируют показатели 36- и 48-месячной общей выживаемости в группе вемурафениба на уровне 20,8 и 17% соответственно [10]. Таким образом, в исследовании BRIM-3 каждый пятый пациент с мМК, получавший вемурафениб в первой линии терапии, прожил три года и более.
Другим представителем ингибиторов BRAF, воздействующих на сигнальный путь MAPK, является дабрафениб. Препарат зарегистрирован для клинического применения у пациентов с мМК и мутацией BRAFV600 в дозе 150 мг дважды в день per os (суточная доза 300 мг). Основанием для регистрации дабрафениба в США и странах Евросоюза в 2013 г. стали результаты рандомизированного исследования III фазы BREAK-3 [11].
Первичной целью данного исследования являлась оценка ВБП, вторичной – оценка общей выживаемости. В исследование было включено 225 пациентов с мутацией BRAFV600, с неоперабельной МК IIIC и IV стадий. Дабрафениб сравнивали со стандартной химиотерапией дакарбазином. В группу дабрафениба было включено 187 пациентов, в группу химиотерапии дакарбазином – 63 пациента.
В ходе исследования установлено, что у пациентов, получавших дабрафениб, медиана ВБП была достоверно выше, чем у пациентов, получавших дакарбазин (6,9 против 2,7 месяца; p < 0,0001). Частота объективных ответов на лечение в группе дабрафениба достигла 50% (включая 3% полных ответов), в группе дакарбазина – 7% (2% полных ответов). Медиана общей продолжительности жизни в группе дабрафениба составила 18 месяцев. В группе дакарбазина она превысила 15 месяцев. Высокий показатель общей выживаемости в группе дакарбазина связан с кроссовером: пациенты при прогрессировании заболевания на дакарбазине в соответствии с условиями протокола могли получать дабрафениб. Обновленные результаты исследования, представленные на ESMO в 2014 г., подтвердили увеличение показателей выживаемости в группе дабрафениба до 20,8 месяца (по условиям протокола, при прогрессировании заболевания на фоне терапии дабрафенибом, если исследователь считал, что в интересах пациента продолжить терапию, терапия могла быть продолжена) [12].
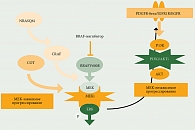
Безусловно, полученные результаты свидетельствовали об увеличении общей выживаемости пациентов с мМК. Вместе с тем стало очевидно, что у большинства пациентов рано или поздно заболевание на фоне терапии ингибиторами BRAF начинает прогрессировать. Детальное изучение механизмов возникновения резистентности позволило сделать вывод, что резистентность к BRAF-ингибиторам может развиваться двумя способами – путем активации нижележащей киназы МЕК, так называемый МЕК-зависимый путь, и путем активации другого пути – PI3K/Akt/mTOR – МЕК-независимый путь (рисунок).
Для предотвращения МЕК-зависимой резистентности к ингибиторам BRAF и улучшения результатов лечения было предложено комбинировать ингибиторы киназы BRAF с ингибиторами нижестоящей в MAPK-пути киназы МЕК.
Рассмотрим результаты исследований комбинированной терапии (coBRIM, COMBI-V и COMBI-D). Интересно, что клиническая эффективность монотерапии мМК ингибиторами МЕК незначительна, поэтому использовать эти препараты вне комбинации с ингибиторами BRAF нецелесообразно. В то же время добавление ингибитора MEK к ингибитору BRAF усиливает блокирование опухолевого роста, замедляет (а в ряде случаев препятствует) развитию приобретенной резистентности, а также блокирует парадоксальный механизм активации пути MAPK (уменьшая частоту кожной токсичности ингибиторов BRAF) [13, 14].
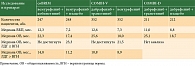
Исследование coBRIM – комбинация вемурафениба с кобиметинибом у пациентов с мМК с мутацией BRAFV600 в качестве терапии первой линии. Это многоцентровое рандомизированное двойное слепое плацебоконтролируемое исследование III фазы, в котором участвовало 495 пациентов (рандомизировано) с метастатической или местно-распространенной меланомой кожи с мутацией BRAFV600. В качестве первичной цели данного исследования была выбрана оценка ВБП. Дополнительно оценивали общую выживаемость, частоту объективного ответа. Пациенты случайным образом были распределены в группу «вемурафениб + кобиметиниб» (n = 247) и «вемурафениб + плацебо» (n = 248). Вемурафениб назначали в стандартной дозе 960 мг два раза в сутки рer оs длительно, непрерывно. Кобиметиниб назначали в дозе 60 мг утром однократно per os с первого по 21-й день, семь дней перерыв. Медиана ВБП достигла 12,3 месяца в группе комбинированной терапии, 7,2 месяца – в группе монотерапии вемурафенибом. Медиана общей выживаемости в группе комбинированной терапии составила 22,3 месяца, в группе монотерапии вемурафенибом – 17,4 месяца (ОР 0,70; 95%-ный доверительный интервал (ДИ) 0,55–0,90; р = 0,005). При проведении анализа в зависимости от исходного уровня лактатдегидрогеназы (ЛДГ), которая является независимым фактором неблагоприятного прогноза, было выявлено, что при нормальном уровне ЛДГ медиана общей выживаемости в группе комбинированной терапии не достигнута (срез данных 28.08.2015), а в группе «вемурафениб + плацебо» она составила 23,3 месяца (ОР 0,59; 95% ДИ 0,40–0,87). Частота объективного ответа в группе комбинированной терапии достигла 69,6% (полных ответов – 15,8%, частичных – 53,8%), в группе «вемурафениб + плацебо» – 50% (полных ответов – 10,5%, частичных – 39,5%). Нежелательные явления вемурафениба в основном представлены дерматологической токсичностью (сыпь, гиперкератоз, повышенная чувствительность к солнечному свету, развитие кератоакантом/ПКР), артралгиями, утомляемостью. Для комбинированной терапии менее характерна дерматологическая токсичность, чаще развивается гастроинтестинальная токсичность (диарея, тошнота, рвота), отмечается изменение лабораторных показателей (повышение уровней креатинфосфокиназы, аланинаминотрансферазы, аспартатаминотрансферазы).
Комбинацию ингибитора BRAF и ингибитора МЕК c монотерапией ингибитором BRAF сравнивали и в других исследованиях – COMBI-V (дабрафениб + траметиниб vs вемурафениб) и COMBI-D (дабрафениб + траметиниб vs дабрафениб).
COMBI-V – многоцентровое рандомизированное исследование III фазы, в которое было включено 704 пациента с метастатической или местно-распространенной МК с мутацией BRAFV600. Первичной целью данного исследования была оценка общей выживаемости, вторичной – оценка ВБП и частоты объективного ответа. Пациенты случайным образом были распределены на группы комбинированной терапии: дабрафениба в дозе 150 мг два раза в сутки рer оs длительно, непрерывно и траметиниба 2 мг per os однократно утром ежедневно, непрерывно (n = 352) и группу вемурафениба в стандартной дозе 960 мг два раза в сутки рer оs (n = 352). Медиана ВБП в группе комбинированной терапии составила 12,6 месяца, в группе монотерапии вемурафенибом – 7,3 месяца (ОР 0,61; 95% ДИ 0,51–0,73; р < 0,001), медиана общей выживаемости – 25,6 и 18,0 месяца соответственно (ОР 0,66; 95% ДИ 0,53–0,81; р < 0,001). Частота объективного ответа в группе комбинированной терапии, как и ожидалось, оказалась выше – 64% (полный ответ – 13%, частичный – 51%) по сравнению с 51% в группе вемурафениба (полный ответ – 8%, частичный – 44%) [15]. В исследовании COMBI-V при проведении подгруппового анализа были получены данные о наибольшей эффективности комбинированной терапии в подгруппе пациентов с нормальным уровнем ЛДГ (медиана общей выживаемости не достигнута vs 21,5 месяца соответственно). В группе с исходно повышенным уровнем ЛДГ существенных различий между группами не зарегистрировано (10,8 vs 8,9 месяца соответственно).
COMBI-D – многоцентровое рандомизированное исследование III фазы, в котором участвовали 423 пациента с метастатической или местно-распространенной меланомой кожи с мутацией BRAFV600. Первичной целью данного исследования стала оценка ВБП, вторичной – оценка общей выживаемости, частоты объективного ответа. Группу комбинированной терапии составили 212 пациентов, группу монотерапии дабрафенибом – 211 пациентов. Медиана ВБП на фоне комбинированной терапии достигла 11 месяцев, на фоне монотерапии дабрафенибом – 8,8 месяца (ОР 0,67; 95% ДИ 0,53–0,84; p < 0,001), медиана общей выживаемости – 25,1 vs 18,7 месяца соответственно (ОР 0,71; 95% ДИ 0,55–0,92; p = 0,011), частота объективного ответа – 69 vs 53% соответственно.
Исследования показали также, что переносимость комбинированной терапии характеризуется снижением частоты дерматологических нежелательных явлений, однако необходимо отметить увеличение частоты гастроинтестинальных нежелательных явлений (диарея, тошнота), а также повышения артериального давления.
Сводные данные по всем исследованиям представлены в таблице.
Таким образом, использование BRAF-/MEK-ингибиторов у пациентов с мМК с BRAF-мутацией представляет первый успешный пример персонализированной терапии, изменившей представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Эти препараты пришли на смену химиотерапии и стали новым стандартом лечения меланомы с BRAF-мутацией, что подтверждает ранее сформулированный постулат о необходимости разработки разных подходов к лечению различных молекулярно-генетических подтипов меланомы. Появляются результаты исследований таргетных препаратов и при других типах меланомы с альтернативными мутациями (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлемой частью разработки стратегии лечения каждого пациента с диагнозом «меланома».
На сегодняшний день все существующие BRAF- и MEK-ингибиторы зарегистрированы в России и при соответствующем лекарственном обеспечении с успехом могут быть использованы в терапии мМК. Профиль безопасности этих препаратов позволяет использовать их в амбулаторных условиях.
K.V. Orlova, G.Yu. Kharkevich, I.A. Utyashev, L.V. Demidov
N.N. Blokhin Russian Cancer Research Center
Contact person: Kristina Vyacheslavovna Orlova, krisman03@gmail.com
Treatment with BRAF inhibitors such as vemurafenib or dabrafenib in patients with advanced BRAFV600 mutated melanoma has shown objective tumor responses in approximately half of the patients. However, the duration of responses is limited in a majority of these patients, with progression-free survival rates around 6 months due to tumor progression from development of acquired resistance. Preclinical studies have suggested that concurrent inhibition of the BRAF kinases and MEK of the mitogen-activated protein kinase (MAPK) pathway could decrease MAPK-driven acquired resistance, resulting in longer duration of responses, higher rate of tumor responses, and a decrease in the cutaneous toxicities. This article provides an overview of currently available data from clinical studies BRAF and MEK inhibitors, which are registered in the Russian Federation.

