Подходы к иммунотерапии рецидивирующего простого герпеса
- Аннотация
- Статья
- Ссылки



Взаимодействие между вирусом и организмом человека является решающим этапом в развитии течения герпесвирусной инфекции. Различные механизмы применяются вирусом для подавления иммунной защиты. Изучение врожденных и специфических механизмов защиты является важным и может иметь значимость для предупреждения развития тяжелой системной инфекции. Первая линия защиты представлена врожденными факторами (клетки моноцитарно-макрофагального ряда, естественные киллеры). Активация комплемента ускоряет мобилизацию и способствует направленному движению клеток к очагу воспаления. Быстро синтезируются a- и β-интерфероны, что переводит чувствительные клетки в состояние резистентности к ВПГ, под их влиянием усиливается функция макрофагов и естественных киллеров, в результате чего разрушаются инфицированные клетки. Эта система защиты вступает в действие с первых дней контакта с вирусными антигенами (9, 15, 18).
Фаза позднего специфического воздействия начинается с переработки антигена и представления его макрофагами Т- и В-лимфоцитам с дальнейшей дифференциацией последних в плазматические антителообразующие клетки. Синтезирующиеся антитела обеспечивают связывание внеклеточного вируса. Кроме того, происходит секреция цитокинов активированными макрофагами (ИЛ-1, ФНО) и лимфоцитами (ИЛ-2 и др.). Типоспецифический иммунный ответ формируется в течение 14-28 дней после первого контакта клеток с антигенами ВПГ. Наиболее важную роль в формировании специфического иммунитета против герпесвирусов играют высокоспециализированные Т-лимфоциты и специфические антитела классов IgM, IgG2 и IgG1. Формирование противогерпетического иммунитета происходит как при манифестном, так и при бессимптомном инфицировании (2, 12). При реактивации инфекции происходит повторный контакт с антигеном, в результате чего активируется многокомпонентный иммунный ответ. В случае попадания в организм того же типа вируса, но с измененной антигенной структурой (новый штамм ВПГ), уже имеющийся противогерпетический иммунитет активируется и блокирует вирусные частицы факторами врожденной защиты (прежде всего интерферонами, естественными киллерами, макрофагами). Однако наработка антител, Т-специфических лимфоцитов начинается заново, только в более короткий срок от 7 до 14 дней. Формирующийся иммунитет направлен, прежде всего, на нейтрализацию и удаление из организма вируса, его антигенов и зараженных вирусом клеток.
Стоит отметить, что благодаря способности вируса простого герпеса к длительному персистированию, приводящему к снижению противовирусной иммунной защиты, лечение больных простым герпесом представляет сложную проблему. Прогресс в области лечения герпесвирусной инфекции был достигнут в 80-е годы прошлого столетия и связан с разработкой первого препарата из группы ациклических нуклеозидов – Ацикловира. В настоящее время согласно международным стандартам лечения герпесвирусных инфекций препаратами выбора являются Ацикловир, Валтрекс, Фамвир. Это наиболее часто назначаемые противогерпетические препараты (3, 5, 11). При первичном эпизоде герпесвирусной инфекции и во время рецидивов заболевания препараты применяются внутрь и местно.
Выделяют два основных способа применения противовирусных химиопрепаратов: эпизодическое назначение (по мере необходимости при обострениях герпесвирусной инфекции) и пролонгированная терапия (8, 17). В первом случае препарат назначают коротким курсом в течение 5-10 дней. Во втором – пациенты принимают препарат ежедневно в течение нескольких месяцев для купирования данного рецидива, а также для профилактики последующих рецидивов. Эпизодическая терапия предпочтительна для пациентов, имеющих невыраженные и нечастые рецидивы. Целью терапии в этом случае является уменьшение выраженности симптомов рецидива и сокращение периода вирусовыделения. Для наибольшей эффективности прием препаратов необходимо начинать во время продромального периода или первых суток клинических проявлений. Согласно данным зарубежной литературы, при рецидивах простого герпеса назначают Ацикловир по 200 мг 5 раз в день (или 400 мг 3 раза в день) в течение 10 дней. Альтернативой может являться прием Валацикловира – 1 г в день в течение 5 дней – либо Фамцикловир – по 125 мг 2 раза в день в течение 5 дней (13).
Для пациентов, имеющих частоту рецидивов более 6 раз в год, рекомендована пролонгированная схема приема противовирусных препаратов. При этом такая схема терапии должна быть разъяснена пациенту и обсуждена с ним. По данным литературы, эти схемы лечения эффективны у 70-80% пациентов. Безопасность и эффективность продолжительного приема Ацикловира показана у пациентов, получавших терапию в течение 6 лет, а также пациентов, принимавших Валацикловир или Фамцикловир в течение одного года. По данным зарубежных авторов, Ацикловир по супрессивной схеме назначается по 400 мг 2 раза в сутки, Валацикловир – по 500 мг в сутки (для пациентов с частотой рецидивов более 9 раз в год – 1 г в сутки), Фамцикловир – 250 мг 2 раза в сутки (11, 20). По мнению многих исследователей, пролонгированная терапия – это эффективная стратегия улучшения качества жизни больных простым герпесом (10, 20).
Применение химиопрепаратов, влияющих на процессы репликации вирусной ДНК, для купирования и предупреждения рецидивов является широко принятым и доступным способом. Однако прием этих препаратов не обеспечивает полной элиминации вируса из организма, и иногда после отмены препаратов возможно продолжение рецидивов заболевания с прежней частотой. Хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ) является иммунологической проблемой, что требует применения иммунотропных препаратов. Основанием для применения иммунотерапии при рецидивирующей герпесвирусной инфекции является зависимость тяжести и частоты рецидивов от активности противовирусного иммунитета. Поэтому многие исследователи возлагают большие надежды на иммунотерапию, включающую иммуномодуляторы и вакцины (6, 12, 16).
Как показал проведенный нами анализ литературы, в России для лечения герпесвирусной инфекции используют множество иммуномодуляторов: Имунофан, Галавит, Иммуномакс, Миелопид, Ликопид, Нуклеинат натрия и др. (1, 2, 6, 7). В иностранной литературе встречаются сообщения об успешном применении новых иммуномодуляторов местного действия. Имиквимод (торговое название Aldara) – первый иммуномодулятор, разрешенный для лечения генитальных бородавок. Применяется местно в форме 5% крема. Это иммуномодулятор с непрямым противовирусным действием, in vivo обладает противогерпетической активностью за счет индукции цитокинов (ИФН-a и ИЛ-12) и Т-клеточного ответа. Резиквимод (resiquimod) – аналог имиквимода. Стимулирует моноциты/макрофаги, дендритные клетки и В-лимфоциты к продукции цитокинов (ИФН-α, ИЛ-12, ФНО-α и ИФН-γ), которые способствуют развитию Th1-типа иммунного ответа (19).
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации (7). Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция различной локализации. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний® – отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире (4). Опыт применения Полиоксидония® с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в лечении вирусных инфекций. Полиоксидоний® обладает дезинтоксикационными свойствами, способствует активации фагоцитоза, естественных киллеров, антителообразования.
Целью настоящего исследования стало определение клинической эффективности комплексной терапии Полиоксидонием® пациентов с хронической рецидивирующей герпесвирусной инфекцией (ХРГВИ) и оптимизация схем применения этого иммуномодулятора у данной категории больных.
Материалы и методы. Исследование проводилось открытым методом у 75 пациентов с ХРГВИ. В состав исследуемых включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с установленным диагнозом – ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к Полиоксидонию® и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Условием включения для женщин детородного возраста было соблюдение полноценной контрацепции. На предварительном этапе было сформировано две основные равнозначные группы пациентов по 25 человек. Контрольной группой послужили 25 пациентов с диагнозом ХРГВИ, соответствующие критериям исследования. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки при поступлении на амбулаторное лечение. У всех пациентов были жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика мазка из области высыпаний на ВПГ-1, 2 типа – положительный результат получен в 98,3%.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата в первой половине дня. В I группе проводили терапию в течение 45 дней: по 6 мг Полиоксидония® в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия – по 6 мг в/м 2 раза в неделю в течение месяца. Во II группе схема введения Полиоксидония® – по 6 мг в/м через день в течение 10-ти дней (всего 5 инъекций на курс). Обследование проводилось до приема препарата (0 день) и на 12-14 день от начала приема препарата, через 1 и 6 месяцев после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (Ацикловир по 0,2 г 5 раз в день в течение 10-ти дней и антиоксиданты – витамины А, Е). В контрольной группе пациентов проводилось лечение только ациклическими нуклеозидами.
Результаты и обсуждение. Критериями оценки эффективности являлись следующие параметры: первичные критерии – время достижения полного выздоровления (полная реэпитализация); вторичные критерии – длительность ремиссии и частота рецидивов в ближайшем отдаленном периоде после терапии. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие элементов в виде везикул, эрозий, эпителизации, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
Длительность течения герпесвирусной инфекции у вошедших в обследование больных в среднем составила 4,8 ± 1,2 года. По локализации герпетического процесса пациенты распределились следующим образом: у 64,0% пациентов – генитальная локализация, у 16,0% – экстрагенитальная, у 20,0% – смешанная. При анализе жалоб больных с простым герпесом преобладали остро возникшие везикулезные высыпания, эрозии и отечность в области гениталий, кожи промежности и бедер, зуд, жжение, болезненность. У части больных отмечалось ухудшение общего состояния, связанное с интоксикацией. Приблизительно 30% пациентов предъявляли жалобы на головную боль, повышение температуры тела, сопровождающееся ознобом, миалгию.
При анализе жалоб у мужчин в основных группах в 30,8% случаях отмечалась тяжесть в промежности, у 23,1% – снижение сексуальной активности, у 15,0% – зуд и жжение в мочеиспускательном канале. У 30,0% обследуемых женщин были жалобы на изменение характера выделений, у 10,8% – трещины на коже и слизистых, у 9,2% – зуд, жжение в уретре.
До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-инфекции 1 и 2-го типа и оценка выраженности местных и общих клинических симптомов в зависимости от типа вируса простого герпеса. Так из 50 обследованных больных чаще (в 38 случаях) выявлялся ВПГ-2 типа, ВПГ-1 – только в 12 случаях. Как видно из таблицы 1, местные клинические проявления, а также симптомы интоксикации в виде повышения температуры тела, отражающие остроту процесса, были более выражены при наличии ВПГ-2.
Клиника генитальной формы простого герпеса, обусловленная ВПГ-1, протекала в более благоприятной форме: местные симптомы в виде гиперемии, зуда были не столь выражены, повышение температуры, признаки интоксикации носили единичный характер.
На фоне лечения Полиоксидонием® в 1-ой группе длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,50 дней (p < 0,05). На фоне стандартной терапии (Ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дней соответственно (таблица 2).
После курса терапии в ближайшем отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составила 4 дня. В процессе лечения препаратом свежие высыпания ни у кого не наблюдались. При дальнейшем наблюдении 76% (19 человек) отметили уменьшение тяжести течения рецидива после лечения. На фоне лечения Полиоксидонием® во II группе длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дней (p < 0,05). После лечения Полиоксидонием® в ближайшем отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляла 4 дня. В этой группе 64% (16 человек) отметили уменьшение тяжести течения рецидива по сравнению с периодом до получения препарата.
Наблюдение за пациентами в течение 6 месяцев после лечения показало, что частота рецидивов в I группе после лечения уменьшилась в среднем с 6,5 до 3-х раз по сравнению с периодом ближайших 6-ти месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Частота рецидивов у пациентов, получавших Полиоксидоний® по 2-ой схеме, в течение 6-ти месяцев после лечения уменьшилась в среднем с 6 до 3,6 раз по сравнению с периодом ближайших 6-ти месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней.
Отмечено уменьшение частоты встречаемости и выраженности местных и общих клинических проявлений ХРГВИ в обеих группах по сравнению с теми же показателями на фоне лечения Полиоксидонием® (таблица 3).
Кроме того, длительность ремиссии оценивалась при динамическом наблюдении за больными на протяжении последующих 2-х лет после проведенного лечения.
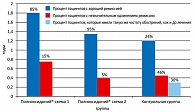
Так, в I группе в 85% случаев длительность ремиссии отмечалась в среднем 1,8 года, во II группе 95% больных имели стойкую ремиссию в среднем 1,3 года. Максимальная длительность ремиссии увеличилась в среднем с 45-ти до 180-ти дней (у отдельных пациентов максимальная ремиссия достигала 190-220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). Никто не отметил ухудшения течения заболевания. Во II группе максимальная длительность ремиссии увеличилась в среднем так же, как и у пациентов I группы, с 45 до 180-ти дней. Так же, как и в I группе, никто из пациентов не отметил ухудшения течения заболевания.
В контрольной группе длительность ремиссии более года составила лишь 24%, оставшиеся 76% больных имели такую же частоту обострений, как и до лечения. Более наглядно длительность ремиссии по исследуемым группам представлена на рисунке 1.
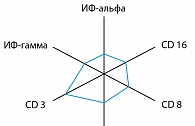
У всех пациентов, включенных в исследование, до начала лечения оценивалось состояние противовирусного иммунитета. Адекватный специфический противогерпетический иммунный ответ формируется при контакте антигенов герпесвирусов с иммунной системой. Цельные вирионы сами по себе являются слабыми сигналами для иммунной системы, поэтому первичная герпесвирусная инфекция, как правило, на первых этапах протекает при абсолютном превосходстве вирусов. В результате разрушения вирионов фагоцитирующими клетками образуются антигены герпесвирусов, представляющие все генетические особенности оболочки, капсида и ДНК определенного герпесвируса. Полноценный набор противовирусной защиты: специфические антитела классов M и G, цитотоксические Т-лимфоциты, NK-клетки и интерферон, противопоставляемые выраженной антигенной нагрузке, как правило, обеспечивают быструю элиминацию вируса, что клинически обусловливает отсутствие частых, затяжных рецидивов. При хронизации герпесвирусной инфекции отмечается несостоятельность противовирусной защиты. При иммунологическом обследовании пациентов, имеющих клинические проявления инфекции, обусловленной ВПГ2, выявлены нарушения в противовирусном ответе в виде снижения продукции a- и g-ИФН, уменьшении количества NK-клеток (рисунок 2).
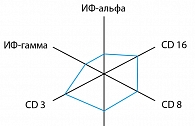
Оценка противовирусного иммунитета проводилась до начала лечения, через месяц после окончания и в динамике через 6 месяцев. Высокоинтенсивный иммунный ответ регистрировался в первой и второй исследуемых группах и достоверно отличался от показателей до лечения. Так, в сыворотке крови пациентов с ВПГ-2 обеих групп через месяц после лечения отмечалась тенденция к увеличению процентного и абсолютного содержания естественных киллерных клеток (NK), цитотоксических Т-лимфоцитов с фенотипом CD8+. Активность спонтанного и индуцированного a- и g-ИФН в обеих группах оставалась на исходно низком уровне (рисунок 3).
В контрольной группе через месяц по окончании лечения достоверных изменений в показателях противовирусного иммунитета выявлено не было.
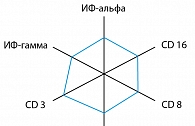
Динамика показателей противовирусного иммунитета через 6 месяцев после проведенного лечения в первой и второй исследуемых группах также имела достоверные различия с показателями до лечения (рисунок 4). При этом сравнительный анализ полученных результатов выявил активацию интерферонового звена, что является, по всей видимости, индуктивным эффектом действия Полиоксидония®.
Таким образом, применение Полиоксидония® в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения продолжительности рецидивов и заметного уменьшения их частоты в отдаленном периоде. Раннее назначение Полиоксидония® способствует более быстрой реэпителизации, а назначение препарата по пролонгированной схеме приводит к выраженному удлинению периода ремиссии.

