Повышение качества жизни у мужчин с недержанием мочи после простатэктомии и рациональное применение абсорбирующих средств
- Аннотация
- Статья
- Ссылки
Введение
Самым значимым осложнением радикальной простатэктомии является недержание мочи. Доказанная эффективность этой операции обусловливает ее широкое применение у больных с локализованным раком простаты, а следовательно, и рост количества пациентов с симптомами недержания. Частота недержания мочи после простатэктомии, по данным разных авторов, составляет от 0,8 до 87% [1–11]. Разброс данных можно объяснить различными критериями понятия «недержание» [12].
Динамика симптомов недержания мочи
Считается, что в раннем послеоперационном периоде, непосредственно после удаления уретрального катетера, возможно эпизодическое частичное недержание мочи. Эта ситуация не должна вызвать волнения ни у врача, ни у пациента. До операции с пациентом проводится беседа, в ходе которой его предупреждают о длительности процесса восстановления адекватного мочеиспускания после радикальной простатэктомии. Основные этапы нормализации функции удержания мочи таковы [13]:
1. Через 1 месяц после радикальной простатэктомии недержание мочи должно отсутствовать ночью в положении лежа.
2. Через 3 месяца после радикальной простатэктомии недержание мочи должно отсутствовать днем при обычной активности.
3. Через 6–12 месяцев недержание мочи должно отсутствовать при физическом напряжении.
В послеоперационный период врач должен предложить пациенту с недержанием мочи методы, которые помогли бы ему адаптироваться в повседневной жизни. Наиболее востребованным в клинической практике является применение абсорбирующих средств, которое позволяет преодолеть восстановительный период с минимальным дискомфортом. Кроме того, зная вид и частоту применения абсорбирующих средств, можно судить о процессе восстановления функций нижних мочевых путей. Так, через 3 месяца после радикальной простатэктомии 54% пациентов не прибегают к абсорбирующим средствам [14]. К 8 месяцам после операции этот показатель увеличивается до 80%, к 12 месяцам достигает 93%, в дальнейшем оставаясь на этом же уровне. Следует отметить, что разделение пациентов на применяющих/не применяющих абсорбирующие средства является достаточно бескомпромиссным, поскольку к пациентам, использующим абсорбирующие средства, относят и тех, кто применяет не более 1 прокладки в день [13].
Таким образом, в подавляющем числе случаев функция удержания мочи после оперативного вмешательства восстанавливается с течением времени. Окончательно оценивать результаты операции следует не ранее чем через 9 месяцев после нее [15]. Ряд исследователей сообщили об улучшении контроля мочеиспускания в течение первого года после радикальной простатэктомии. Существуют также данные, что восстановление функции удержания мочи продолжается до 24 месяцев после операции.
Причины недержания мочи
Риск развития недержания мочи после радикальной простатэктомии зависит от множества факторов (качество удержания мочи до операции, техника операции, особенности течения послеоперационного периода и др.) [16].
К предоперационным факторам, которые могут влиять на функцию удержания мочи после радикальной простатэктомии, относят возраст пациента, массу тела, наличие нарушений мочеиспускания в анамнезе, объем простаты и уровень простатического специфического антигена перед операцией, данные гистологического исследования (сумма Глисона) [15].
Существует мнение: чем выше индекс массы тела, тем больше потребуется времени для восстановления функции удержания мочи после радикальной простатэктомии [17–20]. Согласно этой точке зрения, достаточная физическая активность и отсутствие избыточной массы тела могут снизить риск развития недержания мочи в послеоперационном периоде за счет повышения тонуса мышц тазового дна. Кроме того, физически активные пациенты нормостенического телосложения более восприимчивы к упражнениям Кегеля в послеоперационном периоде, что может способствовать восстановлению функции удержания мочи. В свою очередь избыточная масса тела относится к факторам риска развития недержания мочи, поскольку жировой балласт оказывает дополнительное давление и нагрузку на мочевой пузырь. Кроме того, избыточная масса тела может свидетельствовать о наличии метаболического синдрома, что является косвенным признаком нарушения кровоснабжения органов малого таза, в частности сфинктерного аппарата. Однако существуют исследования, в которых связь между избыточной массой тела и риском развития недержания мочи после радикальной простатэктомии не установлена [21–23]. Таким образом, нельзя с точностью сказать, влияет ли наличие избыточной массы тела на удержание мочи после радикальной простатэктомии [15].
Среди интраоперационных факторов риска, которые могут повлиять на функцию удержания мочи, выделяют величину кровопотери, сохранение пубопростатических связок, длину уретральной культи, нервосберегающую технику, диссекцию семенных пузырьков, сохранение шейки мочевого пузыря, реконструкцию и везикализацию шейки мочевого пузыря, опыт хирурга [15].
Увеличенная предстательная железа затрудняет апикальную диссекцию, что может спровоцировать недержание мочи после радикальной простатэктомии. При объеме простаты более 50 см³ период восстановления функции удержания мочи после радикальной простатэктомии увеличивается [18].
Доказана важность пересечения мочеиспускательного канала как можно ближе к верхушке простаты для сохранения мембранозного отдела уретры и наружного сфинктера мочевого пузыря [24]. Тем не менее высказываются опасения относительно попыток сохранения мочеиспускательного канала из-за увеличения риска оставить «положительный хирургический край». Эти представления безосновательны, поскольку шейка мочевого пузыря и простатический отдел уретры имеют отличное от простатической паренхимы гистологическое строение и могут быть точно разделены при деликатной хирургической технике и хорошей визуализации зоны резекции [13].
Утверждение о безопасности экономной резекции уретры в области верхушки простаты может быть отнесено и к проксимальной уретре. Доказано, что сохранение шейки мочевого пузыря в процессе радикальной простатэктомии не приводит к увеличению частоты «положительного хирургического края» [25].
Не выявлено корреляции между объемом кровопотери и длительностью недержания после радикальной простатэктомии [26]. Однако в некоторых работах связь между объемом кровопотери и продолжительностью недержания мочи была установлена [27]. Возможно, этот фактор имеет значение в сочетании с другими техническими моментами, в частности с более аккуратной оперативной техникой [15].
К послеоперационным факторам риска относят стриктуру уретровезикального анастомоза, гиперактивность и изменение комплаентности детрузора [15]. Клинические данные позволили определить основные направления, перспективные с точки зрения уменьшения риска развития недержания мочи после радикальной простатэктомии [13]. Это совершенствование оперативной техники при выделении апикальной части или верхушки предстательной железы, возможно более полное сохранение мочеиспускательного канала и шейки мочевого пузыря, техника выполнения анастомоза [27].
Еще одной важной причиной недержания мочи является уменьшение функциональной длины уретры [24, 28, 29]. Опубликованы данные о прогностической важности функциональной длины уретры, измерявшейся на дооперационном этапе посредством трансректальной магнитно-резонансной томографии [28]. Средняя функциональная длина уретры составила 14 мм (от 6 до 24 мм). Из 180 пациентов, включенных в исследование, 129 (72%) полностью удерживали мочу после операции, еще 45 (25%) применяли не более одной прокладки в день, 5 (3%) – от 2 до 3 прокладок, у 1 (0,5%) отмечено недержание мочи. Среди пациентов с функциональной длиной уретры более 12 мм через год после операции удержание мочи имело место у 88%, в то время как при длине менее 12 мм – только у 77% пациентов. Скорость восстановления функции удержания мочи абсолютно не зависела от возраста больных, но была пропорциональна функциональной длине уретры.
Существует точка зрения о том, что сохранение шейки мочевого пузыря не влияет на скорость восстановления функции удержания мочи, но снижает частоту развития стриктуры уретровезикального анастомоза [30]. Однако, с другой стороны, отмечено более раннее восстановление функции удержания мочи после радикальной простатэктомии в случае сохранения шейки мочевого пузыря [31]. Методика везикализации шейки мочевого пузыря по типу теннисной ракетки способствует ускорению восстановления функции удержания мочи [32].
Общеизвестно, что у многих пациентов недержание мочи может быть следствием формирования стриктуры анастомоза [26]. Частота возникновения стриктуры в области уретро-шеечного анастомоза составляет до 16,5% [33, 34]. Наиболее частой причиной формирования стриктур является неадекватное совмещение слизистой оболочки уретры и шейки мочевого пузыря при выполнении анастомоза. Частота стриктур анастомоза, по данным отечественных авторов, составила 7%. При этом в первые 2–8 месяцев после радикальной простатэктомии данное осложнение выявлено у 8 (3,5%) из 226 пациентов [13]. Если в целом частота стриктур уретровезикального анастомоза составляет около 4,5%, то при недержании мочи этот показатель увеличивается до 33,8% [35]. Стриктура уретровезикального анастомоза – важный этиологический фактор развития слабости дистального сфинктерного механизма [36]. Избыточное рубцевание зоны анастомоза может распространиться на зону сфинктера, повреждая замыкательный механизм, который во многом обеспечивается сосудистой и эластической тканью подслизистого слоя [15].
Частота послеоперационной детрузорной гиперактивности также очень велика (2–77%). Продолжительность этого состояния составляет около 1 года [37]. Гиперактивность, как и повреждение уретрального сфинктера, может быть не столько результатом непосредственного повреждения мышцы, сколько нарушением иннервации, возникающим после операции [38]. Этот фактор может быть причиной слабости сфинктера [36, 39].
Большинство пациентов, страдающих недержанием мочи после радикальной простатэктомии, имеют недостаточность сфинктера как одну из ее причин [36]. У 20–50% больных, по данным уродинамического исследования, недостаточность сфинктера является единственным симптомом [15]. Около 40% пациентов с недостаточностью внутреннего сфинктера имеют признаки гиперактивности детрузора или сниженную комплаентность мочевого пузыря (или сочетание этих факторов) [40]. Сами по себе эти состояния не являются основными причинами развития недержания мочи в послеоперационном периоде, однако могут усиливать клиническую симптоматику.
По данным статистики, после перенесенной радикальной простатэктомии 13% мужчин имеют признаки ургентного недержания мочи [41]. При длительно существующей инфравезикальной обструкции развивается пролиферация и гипертрофия детрузора, отмечается увеличение толщины мышечного слоя и, как следствие, повышение внутрипузырного давления. Это приводит к относительному снижению кровотока в стенке мочевого пузыря и компенсаторной сосудистой пролиферации. Развивающаяся парциальная денервация детрузора приводит к ишемии стенки мочевого пузыря, хронической гипоксии, что способствует проявлению и усугублению симптоматики гиперактивности детрузора [42]. Дисфункция мочевого пузыря в послеоперационном периоде в значительной мере обусловливает гиперактивность детрузора и сниженную способность стенки мочевого пузыря к растяжимости, что приводит к возникновению ургентных позывов и мочеиспусканиям небольшими порциями. Следует подчеркнуть, что в большинстве наблюдений это проявление уже имевшейся дисфункции мочевого пузыря на дооперационном этапе, однако нарушение анатомии малого таза и ослабление сфинктерного аппарата являются отягчающими факторами расстройств мочеиспускания [43].
Таким образом, развитие недержания мочи после радикальной простатэктомии может быть обусловлено недостаточностью сфинктерного механизма, гиперактивностью детрузора, снижением комплаентности мочевого пузыря или сочетанием перечисленных причин. Наиболее часто отмечается стрессовое недержание мочи, проявляющееся подтеканием мочи при увеличении внутрибрюшного давления при кашле или физических нагрузках вследствие недостаточности сфинктерного механизма. Ургентное недержание мочи, развивающееся в силу неконтролируемых сокращений детрузора после перенесенной радикальной простатэктомии, встречается реже [44].
Очевидно также, что не только техника операции, но и индивидуальные реабилитационные возможности организма, во многом определяющиеся возрастом пациента, оказывают большое влияние на результаты радикальной простатэктомии [13]. В этой связи большой интерес вызывает вопрос о значении и выраженности возрастной атрофии сфинктера мочевого пузыря и изменения нейрофизиологии его работы с учетом нарушения иннервации в послеоперационном периоде. При наблюдении в течение от 17 месяцев до 8,5 лет недержание мочи в послеоперационном периоде в количестве 1 столовой ложки в день и более отметили 6,65% из 2415 пациентов. При этом среди мужчин в возрасте до 60 лет этот показатель составил 4%, старше 75 лет – 10% [33]. Это соответствует другим данным, согласно которым у мужчин в возрасте до 50 лет значимо лучше восстанавливается функция удержания мочи, чем у пациентов старше 70 лет [45].
Качество жизни больных с недержанием мочи после радикальной простатэктомии
Под наблюдением в клинике урологии Первого МГМУ им. И.М. Сеченова находилось 104 пациента, перенесших радикальную позадилонную простатэктомию. Возраст больных составил 64 (54–72) года (здесь и далее указана медиана, 5-й и 95-й перцентили).
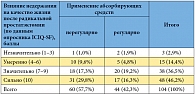
Для оценки выраженности жалоб на недержание мочи, которые возникли после операции, применялся опросник ICIQ-SF (International Consultation on Incontinence Questionnaire Short Form), рекомендованный Европейской ассоциацией урологов. Опросник ICIQ-SF включает несколько простых и доступных для пациентов вопросов [46]. Сумма баллов по шкале ICIQ-SF составила 17 (10–21). Влияние недержания мочи на качество жизни у 3 (2,9%) пациентов было незначительным (1–3 балла), у 15 (14,4%) – умеренным (4–6 баллов), у 38 (36,5%) – значительным (7–9 баллов), у 48 (46,2%) – сильным (10 баллов).
Из 104 мужчин с недержанием мочи 44 (42,3%) применяли абсорбирующие средства регулярно, а 60 (57,7%) – эпизодически или совсем не применяли. В качестве альтернативы абсорбирующим средствам пациенты использовали мочеприемники кондомного типа, самодельные приспособления, полотенца и т.д. Среди больных, которые не применяли регулярно абсорбирующие средства, преобладало значимое снижение качества жизни вследствие недержания мочи (р = 0,282) (использован критерий хи-квадрат) (таблица).
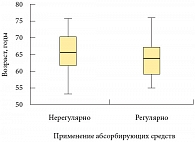
Возраст пациентов, которые регулярно пользовались абсорбирующими средствами, составил 62 (53–72) года, а возраст больных, которые применяли их эпизодически или не использовали совсем, – 64 (55–73) года (рис. 1). Значимых различий по возрасту не выявлено (р = 0,104) (использован критерий Манна – Уитни).
Клиническая симптоматика недержания в целом среди пациентов с недержанием мочи после радикальной простатэктомии была различной. Так, жалобы на подтекание мочи на пути к туалету предъявляли 38 (36,5%) пациентов, при кашле и чихании – 75 (72,1%), во сне – 20 (19,2%), при физической нагрузке – 84 (80,8%), после посещения туалета – 20 (19,2%), без особых причин – 50 (48,1%), все время – 16 (15,4%) пациентов. Однако применение/неприменение абсорбирующих средств не зависело от особенностей клинической симптоматики. Регулярное использование абсорбирующих средств или отказ от них не были связаны с потерей мочи перед посещением туалета (р = 0,144) или потерей мочи при чихании, кашле и физической нагрузке (р = 0,292).
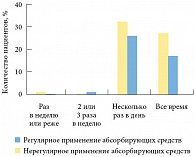
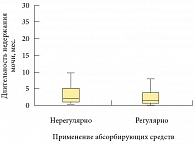
Значимые различия по частоте эпизодов потери мочи в сутки между группами с регулярным и нерегулярным применением абсорбирующих средств отсутствовали (р = 0,477) (рис. 2). Если сравнить более высокие показатели качества жизни у пациентов, применяющих абсорбирующие средства, то можно отметить адаптирующую роль прокладок при сохраненном контроле состояния нижних мочевых путей. Так, абсорбирующие средства, не нарушая восприятия пациентом симптомов недержания, обеспечивали надежное устранение неприятных последствий (влажность, запах, раздражение кожи). То есть пациент знал об эпизодах недержания, однако при этом в меньшей степени испытывал дискомфорт. Уверенность пациента в отсутствии неприятных последствий позволяла ему поддерживать достаточную повседневную активность.
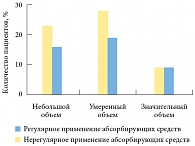
Значимых различий по количеству теряемой мочи в группах также не было выявлено (р = 0,767) (рис. 3). Это еще раз подтверждает тезис о том, что пациенты, использующие абсорбирующие средства, сохраняют контроль над симптомами недержания мочи и имеют гарантию от неблагоприятных последствий. При этом пациенты мотивированы к восстановлению функции удержания мочи, чего нельзя сказать о тех пациентах, которые используют мочеприемники. В этом случае пациент не фиксирует ни частоту, ни объем теряемой мочи, а только меняет мочеприемник по мере его наполнения.
К моменту обращения с целью восстановления функции мочевого пузыря срок недержания мочи у пациентов, которые регулярно применяли абсорбирующие средства, составил 2 (1–20) месяца, так же как и у пациентов, нерегулярно применяющих абсорбирующие средства, – 2 (1–22) месяца (нет значимых различий, р = 0,666) (рис. 4).
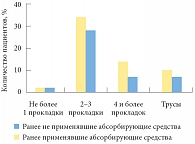
В качестве первой линии лечения симптомов недержания мочи пациентам было предложено выполнять упражнения для мышц тазового дна под контролем биологической обратной связи. Пациентам было также рекомендовано использовать абсорбирующие средства, предварительно они были ознакомлены с преимуществами и особенностями их применения. Частота применения абсорбирующих средств среди пациентов, которые ранее использовали их нерегулярно или совсем не использовали, была выше по сравнению с пациентами, ранее применявшими абсорбирующие средства, однако различия не были статистически значимыми (р = 0,8) (рис. 5).
Применение абсорбирующих средств у больных с недержанием мочи
Должный уровень качества жизни – необходимое условие успешного лечения, реабилитации после операции, а также социальной активности. Обеспечить его во многом позволяют индивидуальные абсорбирующие средства [47]. Абсорбирующие средства, применяемые при недержании, должны отвечать следующим требованиям:
- надежно защищать от протекания;
- препятствовать повреждению кожи мочой;
- поддерживать оптимальный рН кожи (5,5);
- оказывать антибактериальный эффект;
- обеспечивать нейтрализацию неприятного запаха;
- быть комфортными и удобными при ношении в любое время года.
Мы настоятельно советуем пациентам отказаться от мочеприемников кондомного типа, тем более от резаных махровых полотенец, полиэтиленовых пакетов, женских прокладок, детских подгузников, импровизированных зажимов на половой член и т.д., а применять специализированные урологические средства. При производстве урологических вкладышей используются водонабухающий полиакриламид, распушенная целлюлоза, полипропиленовая и полиэтиленовая пленки. Различные комбинации этих материалов обеспечивают не только впитывание, но и удержание жидкости. При этом достигается удержание запаха, исключение протекания, незаметность и удобство применения. Данная продукция позволяет ликвидировать последствия потери мочи, незаметна при использовании, позволяет пациенту контролировать свое состояние. Это создает предпосылки к уменьшению периода восстановления функции удержания мочи после радикальной простатэктомии.
В своей практике мы рекомендуем пациентам использовать мужские урологические вкладыши MoliMed® for men производства немецкой медицинской компании ПАУЛЬ ХАРТМАНН. Эти вкладыши V-образной анатомической формы, изготовленные из экологически чистой целлюлозы, отбеленной без хлора, прошли дерматологическое тестирование, гипоаллергенны, подходят для пациентов с чувствительной кожей. Трехслойная впитывающая подушка с суперабсорбентом обеспечивает максимальную защиту от протекания и надежно удерживает запах внутри. Поверхность, соприкасающаяся с кожей, изготовлена из нетканого материала, что позволяет создать для пациента ощущение комфорта. Верхний проводящий слой на основе закрученной целлюлозы оказывает антибактериальный эффект и поддерживает рН кожи на уровне 5,5, тем самым защищая ее от раздражений. Урологические вкладыши MoliMed® for men незаметны под одеждой, широкая клеящая полоса позволяет надежно фиксировать их к белью. Имеются два вида вкладышей: MoliMed® Premium for men Active (впитываемость 338 мл) и MoliMed® Premium for men protect (впитываемость 481 мл). С целью повышения удобства применения урологических вкладышей их можно комбинировать со специальными сетчатыми трусами.
Результат лечения больных с недержанием мочи после радикальной простатэктомии
Таким образом, в проведенном исследовании возраст, продолжительность недержания мочи и особенность клинической симптоматики не были фактором выбора абсорбирующих средств. Частота и объем теряемой мочи также не влияли на решение пациента об их применении. Следует уточнить, что абсорбирующие средства доступны по цене, а при необходимости могут быть выданы пациенту органами социальной защиты. В этой связи большое значение имеет информированность специалиста, который консультирует пациентов после радикальной простатэктомии. Значительное число больных не применяли абсорбирующие средства, потому что не знали о существовании мужских урологических вкладышей.
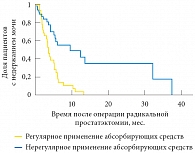
Пациентам в качестве первой линии лечения недержания мочи было предложено тренировать мышцы таза под контролем биологической обратной связи. Медиана времени восстановления функции удержания мочи после начала тренировок в группе пациентов, которые изначально нерегулярно применяли абсорбирующие средства, составила 16 месяцев. У пациентов, которые до обращения регулярно применяли абсорбирующие средства, этот показатель был меньше – 4,3 месяца (р = 0,001) (использован логранговый критерий) (рис. 6). Выявленное различие можно объяснить тем, что использование абсорбирующих средств позволяет пациенту адаптироваться к симптомам недержания, улучшает контроль частоты и объема теряемой мочи. Эти факторы повышают мотивацию пациентов к восстановлению функции мочевого пузыря.
Заключение
Недержание мочи – самое частое осложнение после радикальной простатэктомии. Существуют объективные пред-, интра- и послеоперационные причины недержания мочи. Длительность этого состояния различна. До операции врач информирует пациента о возможности недержания мочи. Однако и в послеоперационном периоде необходимо предоставить пациенту полную информацию о причинах недержания, продолжительности этого состояния и способах адаптации в повседневной жизни. Абсорбирующие средства, созданные специально для мужчин, играют в этом процессе важную роль. Отмечено, что их применение способствует повышению качества жизни в послеоперационном периоде. Выбор типа и частота применения абсорбирующих средств зависят от степени выраженности симптомов недержания, которые можно оценить в рутинной клинической практике. Наиболее эффективными сегодня являются мужские урологические вкладыши MoliMed® for men производства немецкой медицинской компании ПАУЛЬ ХАРТМАНН. Технология производства позволяет применять эти изделия с максимальной эффективностью, побочных эффектов на фоне использования урологических вкладышей не отмечается. Использование абсорбирующих средств не только способствует поддержанию комфорта, но и усиливает мотивацию к восстановлению функции удержания мочи, что подтверждено клинической практикой.

